Les fondamentaux – Chapitre 21 – Processus hémorragiques
O. Chevallier et R. Loffroy
Plan du chapitre
- Introduction
- Imagerie des processus hémorragiques
- Conclusion
Objectifs
- Connaître la séméiologie des hématomes selon les différentes modalités d’imagerie : radiographie, échographie, TDM et IRM.
- Connaître le rôle essentiel et croissant des embolisations percutanées sous contrôle radiologique dans la prise en charge des hémorragies.
- Connaître les examens d’imagerie à demander en fonction du siège de l’hématome.
Introduction
Une hémorragie correspond à une issue de sang hors des vaisseaux. Les processus hémorragiques sont fréquemment explorés en imagerie, qu’ils soient extériorisés (épistaxis, hématémèse ou hémoptysie), collectés dans un espace anatomique (hémothorax, hématome sous-dural, hémopéritoine) ou intratissulaires (hématome cutané, ecchymose, purpura).
Cette issue de sang, en fonction de sa quantité et de son siège, se traduit différemment sur le plan clinique, allant du simple hématome superficiel des tissus mous à l’hémorragie cérébrale, voire au choc hypovolémique.
Au sein des hémorragies collectées ou intratissulaires, il existe trois phases évolutives au cours desquelles les produits de dégradation du sang ont des propriétés différentes en imagerie :
- phase aiguë : l’hématome est constitué de globules rouges intacts contenant de la désoxyhémoglobine ;
- phase subaiguë : transformation de la désoxyhémoglobine en méthémoglobine ;
- phase chronique : détersion complète ou incomplète de l’hématome. Dans ce dernier cas, il existe une coque fibreuse tatouée éventuellement de pigments d’hémosidérine, parfois calcifiée, entourant un liquide citrin correspondant à du sang dégradé.
L’imagerie permet de préciser si le saignement collecté ou intratissulaire est à une phase aiguë ou tardive car la séméiologie en imagerie des saignements est différente en fonction de leur ancienneté.
L’exploration en imagerie d’une hémorragie, qu’elle soit extériorisée, collectée ou intratissulaire, a deux objectifs essentiels :
- diagnostique : affirmer le saignement, le localiser, évaluer son importance, son ancienneté, son potentiel évolutif ;
- thérapeutique : prise en charge de l’étiologie vasculaire, avec le rôle croissant des techniques d’embolisation, procédures mini-invasives réalisées par voie percutanée.
Imagerie des processus hémorragiques
Radiographies
Les radiographies sont souvent l’examen de première intention dans l’exploration des traumatismes ostéoarticulaires. Elles ne permettent cependant pas de caractériser, ni de localiser précisément les hématomes. En effet, à la phase aiguë ou subaiguë, les hématomes ont une densité de tonalité hydrique, non spécifique, qui se confond avec celle des structures musculoligamentaires adjacentes. Il existe une exception qui est celle des épanchements dans une articulation à la phase aiguë d’un traumatisme. L’hémarthrose se traduit par un comblement radio-opaque intra-articulaire avec remplacement du contingent graisseux synovial par du liquide (figure 21.1). Si la densité d’un épanchement sanglant n’est pas différente de celle d’un épanchement liquidien citrin ou purulent, on considère que, lorsque l’épanchement survient à la phase aiguë du traumatisme, il s’agit plus probablement d’une hémarthrose.
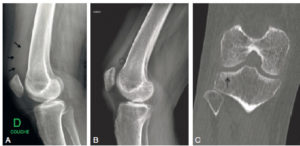
Traumatisme du genou droit chez une femme de 35 ans lors d’une chute.
La radiographie standard du genou droit de profil montre un comblement radio-opaque du récessus sous-quadricipital (A) (flèches) correspondant à l’hémarthrose. Après traitement (B) (astérisque), cette image a disparu. L’hémarthrose est le signe indirect d’une fracture du plateau tibial latéral, visualisée en TDM (C) (flèche).
À la phase chronique, si les parois de l’hématome sont calcifiées, elles apparaîtront sous la forme de lignes radio-opaques en radiographie.
Échographie
L’échographie joue également un rôle dans la détection des hémorragies ou hématomes.
En échographie, l’aspect d’un hématome évolue dans le temps (figure 21.2) :
- les premiers jours, la composante liquidienne (sang fluide) est majeure : l’absorption des ultrasons est minimale avec peu de réflexion et la quasi-totalité des ultrasons traverse l’hématome. L’hématome est anéchogène, c’est-à-dire noir, avec un renforcement postérieur des ultrasons ;
- après 15 jours d’évolution, en phase subaiguë, l’hématome va coaguler et avoir une composante fibreuse « pseudo-tissulaire » : l’hématome n’est plus de structure homogène, entraînant alors des phénomènes de réflexion et de diffusion des ondes ultrasonores. L’hématome devient échogène.
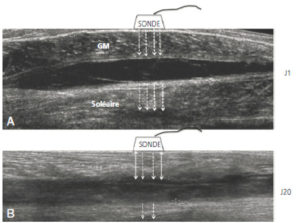
Aspect échographique à J1 et à J20 d’un hématome musculaire du mollet.
À J1 (A), l’hématome est anéchogène sous la forme d’une bande noire entre les muscles gastrocnémien (GM) et soléaire. À J20 (B), l’hématome est échogène (entre les flèches) avec une atténuation plus importante des ultrasons et une augmentation de leur réflexion.
Il existe trois principales indications de l’échographie dans les processus hémorragiques :
- dans la prise en charge du polytraumatisé avec instabilité hémodynamique : « FAST » écho pour la recherche d’une hémorragie dans une cavité séreuse (hémopéritoine ou hémothorax). Lorsque l’instabilité hémodynamique du patient ne permet pas la réalisation d’un bilan lésionnel précis par TDM (chez les accidentés de la route par exemple), une exploration échographique des cavités thoracique et abdominale à la recherche d’un ou de plusieurs épanchements liquidiens (de nature hémorragique dans ce contexte) est réalisée au lit du malade. La constatation et l’évaluation de l’abondance d’un ou de plusieurs épanchements peuvent alors conditionner un transfert au bloc opératoire pour une exploration chirurgicale en vue d’un geste d’hémostase en urgence extrême ;
- dans la prise en charge des lésions musculaires pour la recherche d’hématome (voir figure 21.2) ;
- dans la détection de certains saignements profonds comme les kystes ovariens hémorragiques.
TDM
La TDM joue un rôle fondamental dans le diagnostic des hématomes profonds, mais aussi pour en déterminer la prise en charge optimale.
L’exploration en TDM d’une hémorragie requiert généralement la réalisation d’un protocole d’acquisition multiphasique, sans, puis avec injection de produit de contraste de façon à objectiver les éléments suivants :
- au temps sans injection, la TDM permet d’affirmer l’hémorragie (hématome constitué, épanchement hématique au sein d’un espace, etc.). Une acquisition sans injection de produit de contraste ne permet cependant pas de préciser le caractère actif ou non actif du processus hémorragique ;
- après injection de produit de contraste iodé, la TDM permet de préciser le caractère actif ou non du processus hémorragique, et d’en rechercher sa cause : une malformation vasculaire (comme un anévrisme), une plaie vasculaire, une lésion tumorale, etc.
TDM sans injection
La TDM fournit une image en niveaux de gris. Cette atténuation, propre à chaque tissu, a permis d’établir une échelle de densité en unités Hounsfield ou UH (figure 21.3). Le coefficient d’atténuation du sang à la phase aiguë est compris entre 50 et 70 UH ; la plupart des tissus (cerveau, foie, rate, tube digestif, muscles) ayant généralement une densité spontanée située entre 20 et 50 UH. Ainsi, la présence de sang frais se traduit en TDM par des collections ou épanchements spontanément denses sur une TDM sans injection, c’est-à-dire de densité supérieure aux tissus voisins. On parle d’« hyperdensité spontanée ». Le terme « spontané » sous-entend que la densité est évaluée à partir d’une acquisition réalisée sans injection de produit de contraste. Sur les seules images TDM obtenues après injection de produit de contraste, il peut en effet parfois être difficile de préciser si l’hyperdensité est due au contenu (ici hématique) de la structure étudiée, ou si elle est due à son rehaussement après injection (structure vascularisée).
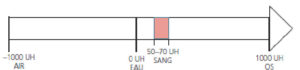
Échelle de densité des tissus selon Hounsfield allant de − 1000 UH à + 1000 UH.
Le sang (caillot, hématomes récents) est compris entre + 50 et + 70 UH.
À titre d’exemple, devant une forte suspicion d’hémorragie sous-arachnoïdienne en cas de céphalées intenses, le temps sans injection de la TDM cérébrale permet de mettre en évidence une hyperdensité spontanée des espaces sous-arachnoïdiens (figure 21.4).
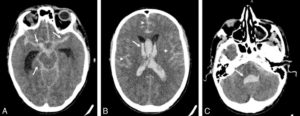
Patient de 28 ans ayant présenté une crise comitiale avec un score de Glasgow à 4 en post-critique. TDM cérébrale sans injection.
A. Hyperdensité spontanée diffuse des espaces sous-arachnoïdiens (flèches) témoignant d’une hémorragie sous-arachnoïdienne. Il existe également une dilatation des ventricules latéraux. B. Hyperdensité spontanée au sein des ventricules (flèche) témoignant d’une hémorragie intraventriculaire. On retrouve également les signes d’hémorragie sous-arachnoïdienne (têtes de flèche). C. Centrée sur la fosse postérieure, la TDM montre une hémorragie au sein du 4e ventricule (flèche) et des citernes de la base.
TDM avec injection
L’hémorragie ou l’hématome ayant été identifié sur le temps sans injection, l’injection de produit de contraste aide à identifier et à localiser la cause de l’hémorragie lorsqu’elle est abondante et, ainsi, à optimiser la prise en charge thérapeutique.
On réalise le plus souvent une seule injection de produit de contraste iodé avec deux acquisitions successives : l’une précoce en phase artérielle et une plus tardive en phase veineuse. D’autres acquisitions peuvent parfois s’avérer nécessaires. Le protocole d’acquisition est prescrit par le radiologue qui l’adapte au contexte clinique. Il est donc absolument nécessaire que les informations cliniques pertinentes lui aient été communiquées (antécédents, histoire de la maladie, signes de gravité, etc.). Un protocole d’acquisition inadapté peut effectivement entraîner un diagnostic erroné ou incomplet et retarder la prise en charge thérapeutique.
Diverses causes peuvent ainsi être mises en évidence ; à titre d’exemples :
- à l’étage cérébral : un anévrisme intracrânien (figure 21.5), une malformation artérioveineuse, une thrombophlébite cérébrale ;
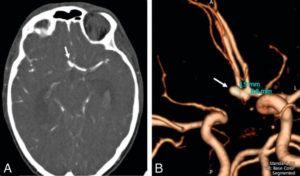
Cas de la figure 21.4 d’hémorragie méningée massive chez un patient de 28 ans.
A. AngioTDM cérébrale après injection en phase artérielle dévoilant la présence d’un anévrisme sacciforme de l’artère communicante antérieure (flèche). B. Reconstruction volumique de l’angio TDM artérielle cérébrale permettant l’analyse tridimensionnelle de l’anévrisme (flèche).
• aux étages thoraciques, abdominopelviens, ou même au niveau d’un membre : un hématome (figure 21.6), une plaie vasculaire (figures 21.7 et 21.8) (traumatique ou chirurgicale).
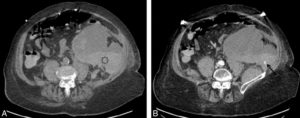
Femme de 80 ans admise aux urgences pour violentes douleurs abdominales après une chute sur le flanc gauche avec instabilité tensionnelle.
La TDM sans injection (A) montre un volumineux hématome du muscle ilio-psoas gauche (hyperdensité spontanée) (astérisque). Après injection de produit de contraste au temps artériel (B), mise en évidence d’une fuite active de produit de contraste (flèche). Cette fuite active apparaît sous la forme d’une flammèche de produit de contraste hyperdense (de la même densité que l’aorte abdominale). La patiente a été prise en charge immédiatement en radiologie interventionnelle pour embolisation.
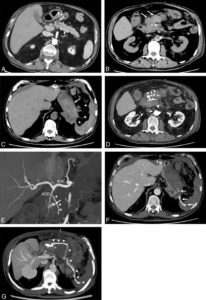
Patient présentant un choc hémorragique 3 jours après la prise en charge chirurgicale par pancréatectomie caudale et splénectomie (+ cholécystectomie) d’une tumeur intracanalaire papillaire et mucineuse du pancréas (TIPMP) des canaux secondaires dégénérée.
A. TDM préopératoire après injection en phase artérielle différée montrant la lésion de TIPMP des canaux secondaire (flèche). Le patient présente un choc hémorragique 3 jours après la chirurgie. Une TDM est réalisée. B. TDM sans injection montrant une collection spontanément hyperdense (flèches) au contact et en avant du moignon pancréatique correspondant à un hématome frais. La structure spontanément très hyperdense désignée par la flèche en pointillés correspond à la ligne de suture chirurgicale. C. TDM sans injection montrant l’extension de l’hématome au contact et en avant de l’estomac (flèche) et au sein de la loge de splénectomie (têtes de flèche). D. TDM après injection en phase artérielle dévoilant une structure de forme nodulaire très dense au contact de la ligne de suture et de l’artère gastroduodénale correspondant à un faux anévrisme (flèche), accompagné d’une importante fuite de produit de contraste en avant (têtes de flèche). Il s’agit donc vraisemblablement d’un faux anévrisme rompu. E. Cette reconstruction coronale oblique et en maximum intensity projection (MIP) de l’acquisition en phase artérielle montre que le faux anévrisme (flèche) provient vraisemblablement d’une petite branche de l’artère gastroduodénale (AGD). AHC : artère hépatique commune. Les têtes de flèche désignent la ligne de suture chirurgicale, spontanément hyperdense. F. Nouvelle acquisition en phase veineuse montrant que la fuite de produit de contraste s’étend jusqu’à la loge de splénectomie (flèches), expliquant donc l’hématome à distance du site de résection pancréatique. G. Reconstruction axiale oblique en MIP de l’acquisition en phase veineuse montrant le trajet de la fuite vers la loge de splénectomie (têtes de flèche).
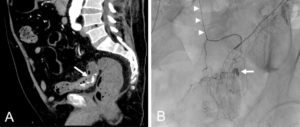
Patient présentant des rectorragies abondantes.
A. TDM après injection en phase artérielle, en reconstruction sagittale, montrant une fuite du produit de contraste dans la lumière digestive (flèche) du côlon sigmoïde, témoignant d’un saignement actif d’origine artérielle (origine diverticulaire non visible ici). B. Angiographie. Par une voie d’abord fémorale droite, une sonde/cathéter a été positionnée à l’origine de l’artère mésentérique inférieure (AMI). Un microcathéter a ensuite été utilisé pour naviguer dans l’AMI et dans une branche plus distale (têtes de flèche). L’injection de produit de contraste dans le microcathéter met en évidence la fuite de produit de contraste, et donc le saignement actif, au sein du côlon sigmoïde (flèche). Une embolisation sélective pourra donc être réalisée.
Dans les cas d’une plaie vasculaire, l’injection de produit de contraste permet de rechercher le site actif de l’hémorragie (ou fuite active ou extravasation). On ne visualise pas directement la brèche vasculaire, mais en regard apparaît une « flammèche » de produit de contraste très hyperdense au sein de l’hématome (voir figure 21.6). La TDM injectée permet donc de déterminer l’artère porteuse de l’hémorragie, ce qui permet de guider le geste thérapeutique (voir figure 21.7).
Lorsqu’il existe une fuite active ou extravasation de produit de contraste d’origine artérielle visible en TDM, un traitement peut être éventuellement entrepris en urgence ; celui-ci sera soit chirurgical, soit radiologique avec embolisation. Cette dernière option est réalisée de façon percutanée et ne nécessite généralement qu’une anesthésie locale, moins invasive pour le patient. Certains saignements actifs d’origine veineuse peuvent également nécessiter un geste d’hémostase en urgence (en cas de rupture d’une varice digestive dans un contexte d’hypertension portale par exemple).
La constatation d’un saignement actif en imagerie n’est cependant pas toujours synonyme de prise en charge chirurgicale ou radiologique par embolisation en urgence. Par exemple, en cas d’hématome musculaire survenant sous traitement anticoagulant avec saignement actif visible en imagerie chez un patient stable ne présentant pas de signe clinicobiologique inquiétant, le traitement consiste en l’arrêt du traitement anticoagulant (avec éventuelle antagonisation), la mise en place d’un pansement compressif si possible, et une surveillance clinicobiologique. A contrario, certains processus hémorragiques nécessitent une prise en charge radiologique ou chirurgicale en urgence, même s’ils ne sont pas objectivés par une fuite active de produit de contraste en imagerie (parce que la cause est connue et la prise en charge urgente, comme une embolisation des artères utérines en cas d’hémorragie de la délivrance), ou parce que le saignement est subintrant (comme pour une embolisation de l’artère gastroduodénale après échec de la prise en charge endoscopique d’un ulcère duodénal).
Artériographie
La prise en charge thérapeutique des hémorragies d’origine artérielle repose actuellement en grande partie sur les techniques d’embolisation, réalisées sous contrôle de l’imagerie par des radiologues interventionnels, permettant l’obtention rapide de l’hémostase. Il s’agit d’une approche mini-invasive où le traitement est réalisé par voie endovasculaire (voir chapitre 15).
L’abord vasculaire se fait par voie percutanée avec ponction le plus souvent d’une artère fémorale, radiale ou brachiale.
La navigation au sein des vaisseaux est réalisée sous contrôle radioscopique/radiographique et à l’aide de sondes/cathéters et de fil-guides, éventuellement de micro-cathéters et de micro-guides. Le radiologue peut ainsi accéder à l’artère porteuse du saignement (par exemple anévrisme) et procéder à l’embolisation (figures 21.8 et 21.9). Les dispositifs d’embolisation sont variés et peuvent être de nature mécanique : coils (spires métalliques), particules, plugs, stents ; ou de nature liquide : colle biologique, agents adhésifs visqueux, etc. (figures 21.10, 21.11 et 21.12) (voir chapitre 15).
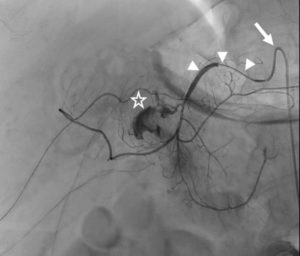
Patient présentant des hématémèses et un méléna sur saignement actif d’un ulcère du bulbe duodénal non contrôlable par voie endoscopique.
Devant l’échec du traitement endoscopique, un traitement radiologique par embolisation est entrepris. Une sonde/cathéter (flèche) a tout d’abord été utilisée pour cathétériser le tronc cœliaque. Ensuite, un microcathéter (têtes de flèche) a été introduit dans l’artère hépatique commune, puis positionné au sein de l’artère gastroduodénale. L’injection de produit de contraste dans le microcathéter met en évidence une importante fuite de produit de contraste (étoile), et donc un saignement actif massif, provenant d’une branche de l’artère gastroduodénale.
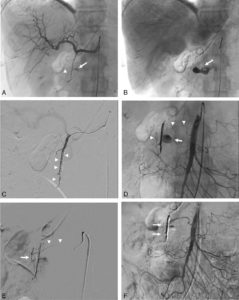
Prise en charge endovasculaire en radiologie interventionnelle d’un patient présentant un choc hémorragique à la suite de la prise en charge chirurgicale par pancréatectomie caudale et splénectomie (+ cholécystectomie) d’une tumeur intracanalaire papillaire et mucineuse du pancréas (TIPMP) des canaux secondaires dégénérée.
La TDM a mis en évidence un saignement actif sur faux anévrisme d’une branche de l’artère gastroduodénale (AGD). Il s’agit du patient de la figure 21.7. A. Angiographie : par une voie d’abord fémorale droite, une sonde/cathéter a été positionnée dans le tronc cœliaque puis à l’origine de l’artère hépatique commune. L’injection de produit de contraste dans le cathéter met en évidence le faux anévrisme (flèche) développé sur une petite branche de l’AGD (tête de flèche ; probable arcade pancréatico-duodénale). B. Acquisition réalisée quelques secondes plus tard montrant l’importante fuite de produit de contraste (flèche) témoignant d’une hémorragie majeure. C. Un microcathéter a permis de cathétériser l’AGD et de l’emboliser à l’aide de multiples micro-coils (têtes de flèche). L’injection de produit de contraste permet de confirmer l’exclusion du segment de l’AGD porteur de la branche porteuse du faux anévrisme. D. Bilan angiographique de l’artère mésentérique supérieure (AMS). La sonde/cathéter a été positionnée à l’origine de l’AMS. L’injection de produit de contraste au travers de la sonde/cathéter permet de dévoiler la reprise du faux anévrisme et du saignement (flèche) par une arcade pancréaticoduodénale (têtes de flèche). Une embolisation complémentaire est donc absolument nécessaire. E. Un microcathéter (têtes de flèche) est positionné en distalité au sein de cette arcade pancréaticoduodénale. L’injection de produit de contraste permet de visualiser le segment porteur du faux anévrisme (flèche). F. Contrôle angiographique après embolisation de l’arcade pancréaticoduodénale par le microcathéter à l’aide de colle biologique (flèches), permettant de confirmer l’exclusion du faux anévrisme et l’arrêt du saignement.
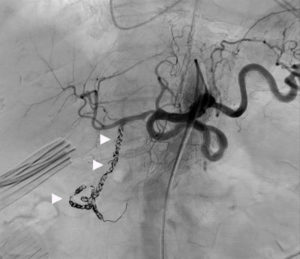
Embolisation par coils (têtes de flèche) de l’artère gastroduodénale pour saignement récidivant d’un ulcère duodénal.
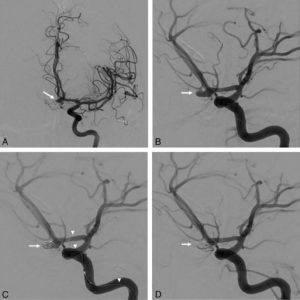
Prise en charge par embolisation en radiologie interventionnelle d’un patient de 28 ans ayant présenté une crise comitiale avec un score de Glasgow à 4 en post-critique suite à la rupture d’un anévrisme intracrânien de l’artère communicante antérieure.
Il s’agit du patient de la figure 21.4. A. Bilan artériographique, incidence frontale, de l’artère carotide interne gauche, permettant la mise en évidence de l’anévrisme sacciforme (flèche) de l’artère communicante antérieure. B. Bilan artériographique, incidence oblique (incidence de travail) de l’artère carotide interne gauche, permettant la mise en évidence de l’anévrisme (flèche) de l’artère communicante antérieure. C. Embolisation par coils (flèche) de l’anévrisme à l’aide d’une micro-cathéter (têtes de flèche). D. Contrôle après embolisation permettant de confirmer l’exclusion de l’anévrisme (flèche).
Les principales indications sont l’hémorragie digestive haute avec ulcère hémorragique et échec du traitement endoscopique par le gastro-entérologue, l’hémorragie de la délivrance et l’hémorragie intracrânienne sur rupture d’anévrisme.
IRM
L’IRM a un rôle fondamental dans le diagnostic positif des hématomes avec un avantage par rapport aux autres techniques d’imagerie : la datation approximative du début du processus hémorragique.
En effet, le signal de l’hématome varie en fonction du délai écoulé entre sa formation et la réalisation de l’IRM (figure 21.13) :
- hyperaigu (quelques heures) : hyposignal en séquence pondérée T1 et hypersignal en séquence pondérée T2 liés au contenu en oxyhémoglobine ;
- aigu (J1-J3) : iso- ou hyposignaux T1 et T2 liés au contenu en désoxyhémoglobine ;
- subaigu précoce (J3-J7) : hypersignal T1 et hyposignal T2 liés au contenu en méthémoglobine ;
- subaigu tardif (J7-J14) : hypersignal T1 et hypersignal T2 au centre de l’hématome. Couronne en hyposignal périphérique T1 et T2 (hémosidérine et tissu fibreux) ;
- chronique (après J14) : hyposignaux T1 et T2 liés à l’hémosidérine et au tissu fibreux.
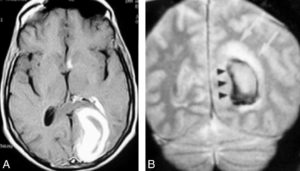
Deux exemples d’hématome intra-parenchymateux en IRM.
A. Coupe axiale en pondération T1 : hématome en phase subaiguë précoce en hypersignal T1. B. Coupe coronale en pondération T2 écho de gradient en phase subaiguë tardive avec centre en hypersignal T2 et périphérie d’hémosidérine en hyposignal T2.
Cette finesse sémiologique est intéressante notamment en neuroradiologie où les patients sont parfois vus à distance de l’épisode initial. Ainsi, en cas d’AVC hémorragique avec hématome intraparenchymateux, il est possible d’apprécier de façon approximative l’ancienneté du saignement.
Scintigraphie aux hématies marquées au 99mTc
La scintigraphie aux hématies marquées peut être utile en cas de saignement digestif occulte, lorsque les méthodes artériographiques et endoscopiques sont négatives, et en dehors d’un contexte d’urgence thérapeutique. Le principe est d’utiliser comme traceur les globules rouges du patient marqués au 99mTc. Ces globules rouges marqués s’accumulent au niveau du site de saignement, à une vitesse dépendant de l’importance du saignement (de quelques secondes à plusieurs heures).
Les techniques scintigraphiques peuvent également permettre de détecter un diverticule de Meckel, cause classique de saignement digestif chez l’enfant (voir chapitre 31).
Conclusion
L’exploration des processus hémorragiques en imagerie est multimodale : hématomes musculaires en échographie, hématomes profonds en TDM, évolution des hématomes intracérébraux en IRM et prise en charge thérapeutique en artériographie.
La TDM joue un rôle clé dans leur prise en charge diagnostique dans le cadre de l’urgence avec la mise en évidence d’une hyperdensité spontanée en phase d’acquisition sans injection. En l’absence de contre-indications, l’examen doit être complété par l’injection de produit de contraste à la recherche d’une fuite active et pour identifier la cause du saignement qui conditionne la prise en charge thérapeutique.
Essentiel à retenir
- Les hémorragies ont une présentation spécifique dans chacune des modalités d’imagerie.
- L’échographie a un rôle chez le polytraumatisé avec instabilité hémodynamique (« FAST » écho), pour la recherche et l’exploration des processus hémorragiques superficiels (hématomes musculaires) et certains saignements profonds.
- La TDM a une place essentielle pour la recherche et l’exploration des processus hémorragiques profonds (urgence +++).
- L’imagerie a un double rôle essentiel dans la prise en charge des hémorragies : 1) diagnostique – affirmer le saignement, le localiser, évaluer son importance, son ancienneté, son potentiel évolutif – ; 2) thérapeutique – prise en charge de la cause du saignement, notamment des techniques d’embolisation, procédures mini-invasives réalisées par voie percutanée.
 |
Chapitre suivant |
 |
Retour au sommaire |
