Les fondamentaux – Chapitre 23 – Imagerie du système nerveux central
A. Chammas , S. Kremer et F. Le Jeune
Plan du chapitre
- Radioanatomie
- Techniques d’exploration neurologique en radiologie et en médecine nucléaire
- Sémiologie normale et éléments de sémiologie pathologique
- Séméiologie pathologique élémentaire en fonction des principaux syndromes
Objectifs
- Connaître les principales techniques d’imagerie utilisées dans l’exploration du système nerveux central.
- Savoir reconnaître les éléments d’anatomie radiologique cérébrale et médullaire.
- Connaître les éléments séméiologiques normaux en TDM et en IRM.
- Connaître les éléments séméiologiques pathologiques élémentaires (sang, œdème vasogénique autour d’une lésion tumorale, œdème cytotoxique en cas d’ischémie) en TDM et IRM.
- Connaître les mécanismes physiopathologiques explorés par la TEP et la scintigraphie dans les pathologies neurologiques.
- Connaître les principaux MRP et le déroulement des examens.
Radioanatomie
Les méthodes d’exploration du système nerveux central (SNC) en radiologie et en médecine nucléaire sont abordées dans ce chapitre. Elles sont morphologiques, mais également fonctionnelles et moléculaires. Les principales structures anatomiques à connaître en imagerie du SNC sont présentées dans les figures 23.1 à figure 23.11. Elles font l’objet d’une séméiologie spécifique dont les principes sont expliqués dans le chapitre.
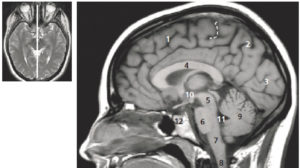
Coupe sagittale médiane pondérée en T1 de l’encéphale.
Cerveau : 1. lobe frontal ; 2. lobe pariétal ; 3. lobe occipital ; 4. corps calleux. Tronc cérébral : 5. pédoncules cérébraux ; 6. pont ; 7. moelle allongée ; 8. moelle spinale ; 9. vermis cérébelleux ; 10. 3e ventricule ; 11. 4e ventricule ; 12. hypophyse. Tirets : extrémité du sillon central à la face interne du cerveau séparant le lobe frontal du lobe pariétal. La figure de gauche permet de repérer la position de la coupe sagittale sur une coupe axiale T2.
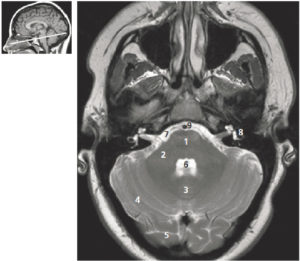
Coupe axiale pondérée en T2 de la fosse postérieure.
1. Pont ; 2. pédoncule cérébelleux ; 3. vermis cérébelleux ; 4. hémisphère cérébelleux ; 5. lobe occipital ; 6. 4e ventricule ; 7. espace sous-arachnoïdien de la base du crâne (ou citernes de la base) ; 8. oreille interne ; 9. artère basilaire. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T1.
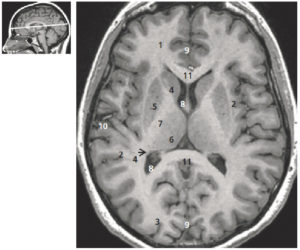
Coupe axiale du cerveau pondérée en T1 avec injection de gadolinium (coupe de Flechsig).
1. Lobe frontal ; 2. lobe pariétal ; 3. lobe occipital. Ganglions de la base du crâne (noyaux gris centraux) : 4. noyau caudé ; 5. noyau lenticulaire ; 6. thalamus ; 7. capsule interne ; 8. ventricule latéral ; 9. scissure interhémisphérique ; 10. scissure frontopariétale (de Sylvius) ; 11. corps calleux. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T1.
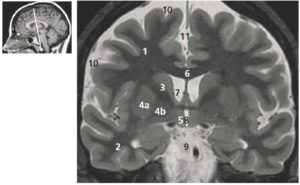
Coupe coronale (ou frontale) pondérée en T2 du cerveau (coupe de Charcot).
1. Lobe frontal ; 2. lobe temporal ; 3. noyau caudé ; 4. noyau lenticulaire (a : putamen, b : pallidum) ; 5. thalamus ; 6. corps calleux ; 7. ventricule latéral ; 8. 3e ventricule ; 9. espace sous-arachnoïdien de la base du crâne (citernes) ; 10. espaces sous-arachnoïdiens péricérébraux ; 11. scissure interhémisphérique. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T1.
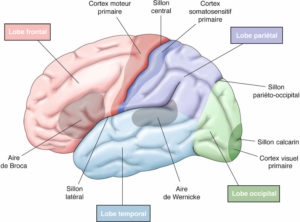
Vue latérale de l’hémisphère gauche : le sillon central sépare le lobe frontal en avant du lobe pariétal en arrière.
Le cortex moteur primaire est situé en avant du sillon central (gyrus précentral). Les aires de Broca (gyrus frontal inférieur) et de Wernicke (gyrus temporal supérieur) sont situées dans l’hémisphère gauche.
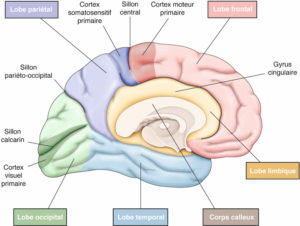
Vue médiale de l’hémisphère gauche.
Dessin : Cyrille Martinet.
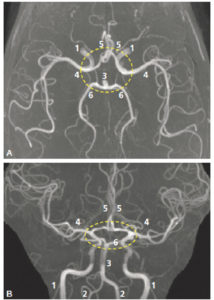
Angio-IRM par temps de vol (sans injection de produit de contraste) des artères de l’encéphale, reconstructions par projection des pixels d’intensité maximale.
Vues supérieure (A) et antérieure (B). 1. Artère carotide interne ; 2. artère vertébrale ; 3. artère basilaire ; 4. artère cérébrale moyenne (sylvienne) ; 5. artère cérébrale antérieure ; 6. artère cérébrale postérieure. Les pointillés entourent le cercle artériel du cerveau (polygone de Willis)
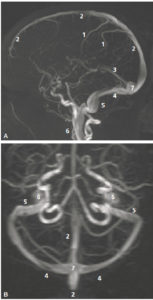
Angio-IRM par temps de vol (sans injection de produit de contraste) des veines de l’encéphale, reconstructions par projection des pixels d’intensité maximale.
Vues latérale (A) et supérieure (B). 1. Veine corticale ; 2. sinus sagittal (longitudinal) supérieur ; 3. sinus droit ; 4. sinus transverse (ou latéral) ; 5. sinus sigmoïde ; 6. veine jugulaire interne ; 7. torcular.
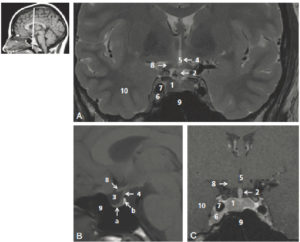
Coupes coronale pondérée en T2 (A), sagittale médiane pondérée en T1 (B) et coronale pondérée en T1 après injection de gadolinium (C) de l’hypophyse.
1. Hypophyse (a : lobe antérieur, b : lobe postérieur) ; 2. infundibulum (tige) hypophysaire ; 3. selle turcique ; 4. hypothalamus ; 5. 3e ventricule ; 6. sinus caverneux ; 7. carotide interne ; 8. chiasma optique (II) ; 9. sinus sphénoïdal ; 10. lobe temporal. La figure de gauche permet de repérer la position de la coupe coronale sur une coupe sagittale T1.
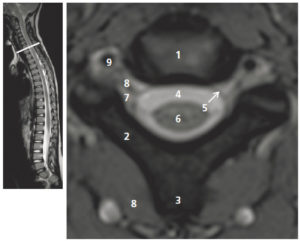
Coupe axiale pondérée en T2 de la colonne cervicale par le disque intervertébral C7-T1.
1. Disque intervertébral C7-T1 ; 2. lame ; 3. processus épineux ; 4. LCS ; 5. dure-mère ; 6. moelle spinale ; 7. foramen intervertébral ; 8. nerf spinal C8 ; 9. artère vertébrale. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T2.
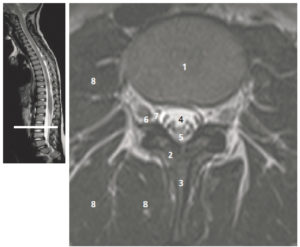
Coupe axiale pondérée en T2 de la colonne lombaire en L3.
1. Corps vertébral de L3 ; 2. lame ; 3. processus épineux ; 4. LCS ; 5. racines de la queue de cheval ; 6. nerf spinal L3 ; 7. foramen intervertébral L3-L4 ; 8. muscles rétrovertébraux. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T2.
Techniques d’exploration neurologique en radiologie et en médecine nucléaire
Explorations neurologiques en radiologie
La neuroradiologie étudie les affections des systèmes nerveux central (SNC) et périphérique (SNP). En fonction des habitudes locales, l’imagerie oto-rhino-laryngologique (ORL) (voir chapitre 24) est réalisée en neuroradiologie, ou en radiologie générale. La neuroradiologie se partage entre la neuroradiologie diagnostique et la neuroradiologie interventionnelle.
Neuroradiologie diagnostique
La neuroradiologie diagnostique est fondée sur l’imagerie en coupes par TDM, ou par IRM.
La TDM est un examen facilement accessible, car de nombreux services d’urgences médicales et chirurgicales sont adossés en France à un service d’imagerie équipé d’une TDM. L’acquisition en TDM est rapide, réalisée en moins de 30 secondes pour l’exploration de l’encéphale ou du rachis. La TDM utilise les rayonnements ionisants et sa résolution en contraste est relativement faible. Son principal avantage est de permettre à la fois l’étude des structures osseuses de la voûte et de la base du crâne, des structures parenchymateuses intracérébrales et des espaces péricérébraux. La TDM a également l’avantage d’étudier les lésions thoraciques et abdominopelviennes dans le même temps d’examen en cas de polytraumatisme.
Ses principales indications sont donc les urgences traumatiques, mais également l’étude des structures osseuses (crâne, rachis).
L’IRM est plus difficile à mettre en œuvre, principalement en raison de son accès limité. En effet, en France, le nombre de machines d’IRM installées est nettement inférieur à celui des TDM. La durée d’examen est plus longue qu’en TDM (environ 20 minutes pour une IRM cérébrale). C’est un examen non irradiant et sa résolution en contraste est élevée.
Ses principales indications sont les affections médicales neurologiques, les suspicions de compression médullaire et les bilans préthérapeutiques des tumeurs cérébrales.
Neuroradiologie interventionnelle
La neuroradiologie interventionnelle (ou thérapeutique) comporte le traitement endovasculaire des malformations vasculaires (malformations artérioveineuses, anévrismes) en angiographie conventionnelle (voir chapitre 15) et le traitement de certaines affections rachidiennes comme les tassements vertébraux sous contrôle TDM ou en radiologie conventionnelle.
L’angiographie par cathétérisme est un examen invasif qui nécessite la ponction d’une artère périphérique (fémorale ou humérale) et expose aux rayonnements ionisants. Les rayons X permettent de suivre la progression du cathéter (radio-opaque) lors de la navigation endovasculaire et de visualiser les lésions vasculaires à traiter. Pour cela, on injecte par le cathéter en intra-artériel un produit de contraste iodé. L’angiographie par cathétérisme n’est pratiquement plus utilisée pour le diagnostic, car elle a été remplacée par les techniques d’imagerie en coupes (angio-TDM, angio-IRM). Elle est donc quasi exclusivement utilisée en neuroradiologie interventionnelle.
La neuroradiologie interventionnelle partage avec la neurochirurgie les indications de traitement des malformations vasculaires, en particulier les anévrismes (figure 23.12).
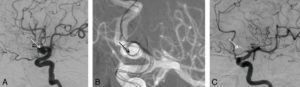
Angiographie conventionnelle par cathétérisme : opacification de l’artère carotide par injection d’iode montrant un anévrisme de l’artère cérébrale antérieure gauche.
A. Mise en évidence de l’anévrisme avant embolisation (flèche blanche). B. Pendant la mise en place par voie endovasculaire des coils au sein de l’anévrisme (flèche noire). C. Après embolisation, seul le paquet de coils est visible, l’anévrisme n’est plus opacifié par l’injection d’iode ; il est donc exclu de la circulation artérielle (flèche blanche).
Explorations neurologiques en médecine nucléaire
L’étude scintigraphique des pathologies neurologiques bénéficie des explorations par tomoscintigraphie (TEMP) ou par TEP ; les deux examens sont couplés à une TDM. Il s’agit d’une imagerie fondée sur des acquisitions volumiques qui permettent d’avoir un reflet de la distribution d’un radiopharmaceutique (MRP) en 3D dans le cerveau et de reconstruire des coupes dans tous les plans de l’espace. Les premières utilisent des MRP émetteurs gamma comme le 99mTc ou l’iode 123, et les secondes des MRP émetteurs de positons comme le 18FDG. Selon le MRP injecté, on obtiendra des informations fonctionnelles (perfusion, métabolisme, etc.) ou moléculaires (expression d’un récepteur ou d’un transporteur, etc.) sur le cerveau. Ces informations sont le plus souvent complémentaires des informations obtenues avec la TDM, et plus encore l’IRM. Dans de nombreuses maladies, l’étude combinée des deux examens est nécessaire au bilan et seule la fusion des images de médecine nucléaire et d’IRM permet d’avancer dans le diagnostic. Cette approche « multimodale » est particulièrement importante pour les explorations neurologiques et elle s’intègre dans le cadre d’un bilan multidisciplinaire.
Mécanismes physiopathologiques explorés par la TEP et la scintigraphie dans les maladies neurologiques
Il existe plusieurs MRP disponibles en routine dans les services de médecine nucléaire qui permettent d’explorer différents mécanismes physiopathologiques au niveau cérébral :
- la perfusion cérébrale globale (débit sanguin cérébral) ;
- le métabolisme glucidique ;
- le versant présynaptique de la synapse dopaminergique ;
- le dépôt des plaques amyloïdes.
Les MRP utilisés pour l’étude de ces mécanismes traversent la barrière hémato-encéphalique normale, contrairement aux produits de contraste dont le passage est le reflet de la rupture de cette barrière.
Principaux MRP et déroulement des examens
Étude de la perfusion et du métabolisme glucidique
Le débit sanguin cérébral et la consommation de glucose sont corrélés à l’activité neuronale. L’imagerie de perfusion ou du métabolisme permet donc de détecter des modifications fonctionnelles locales dues à une perte synaptique ou à un dysfonctionnement synaptique. Le métabolisme neuronal et le débit sanguin sont étroitement couplés dans le temps et dans l’espace dans les maladies neurodégénératives. Le débit sanguin cérébral local est le reflet de la demande énergétique locale et donc de la densité de neurones présents. Il existe ainsi ce qu’on appelle un couplage métabolique-perfusionnel et les deux examens mettent en évidence des anomalies identiques.
La perfusion cérébrale est étudiée après injection intraveineuse d’un MRP marqué au 99mTc comme l’HMPAO, une petite molécule lipophile diffusant facilement à travers la barrière hémato-encéphalique, piégée au niveau cérébral après avoir été transformée en molécule hydrophile. Son avantage majeur est qu’elle reflète la perfusion cérébrale au moment de l’injection puisque sa captation débute 10 à 15 secondes après l’injection. Il n’y a pas de contrainte à la réalisation de cet examen ; le patient ne doit pas être à jeun et peut avoir pris ses médicaments. Un repos neurosensoriel est nécessaire pendant 15 à 30 minutes avant l’injection.
L’acquisition tomoscintigraphique débute environ 20 à 30 minutes après l’injection et dure environ 20 minutes.
L’étude du métabolisme cérébral se fait en TEP après injection de 18F-FDG. La TEP au 18F-FDG permet d’étudier la consommation importante de glucose par le cerveau normal. Après un repos neurosensoriel de 15 minutes, l’injection du traceur se fait par voie intraveineuse et l’acquisition débute environ 30 minutes après l’injection, quand le plateau de fixation est atteint. La durée d’acquisition est de 10 à 20 minutes selon les protocoles.
Étude de la neurotransmission dopaminergique présynaptique
La synapse est constituée de trois parties : un versant présynaptique, la fente synaptique et le versant postsynaptique.
La dopamine est un neurotransmetteur appartenant à la famille des catécholamines. Au niveau cérébral, la dopamine joue un rôle important et complexe, et intervient dans diverses fonctions telles que les fonctions motrices, la cognition, la motivation, les phénomènes de récompense, la mémoire et le sommeil. En imagerie métabolique, c’est surtout sa fonction motrice que l’on va étudier.
La synapse dopaminergique a été très étudiée en médecine nucléaire avec le développement de nombreux MRP au niveau pré- ou postsynaptique dont deux permettent aujourd’hui d’étudier le versant présynaptique : le FP-CIT marqué à l’iode 123 (DatSCAN®) en scintigraphie et la fluorodopa (18F-DOPA) en TEP. Le versant postsynaptique n’est pas étudié en routine.
Le DatSCAN® est un substrat du transporteur présynaptique de la dopamine. L’acquisition débute généralement 3 à 6 heures après l’injection et dure environ 30 minutes. Il n’est pas nécessaire d’arrêter les traitements antiparkinsoniens, agonistes ou antagonistes, puisque ceux-ci agissent au niveau postsynaptique.
La 18F-DOPA est un marqueur de la synthèse de la dopamine et donc également un traceur du versant présynaptique de la synapse dopaminergique. Il est nécessaire d’arrêter les traitements antiparkinsoniens 12 heures avant l’examen. Les acquisitions débutent 90 minutes après l’injection et durent entre 10 et 20 minutes.
Sémiologie normale et éléments de sémiologie pathologique
TDM cérébrale
La substance blanche paraît moins dense (ou plus noire) que la substance grise (cortex et noyaux gris centraux). Le liquide cérébrospinal (LCS) paraît hypodense, alors que les structures osseuses (crâne, rachis) sont hyperdenses (figure 23.13).
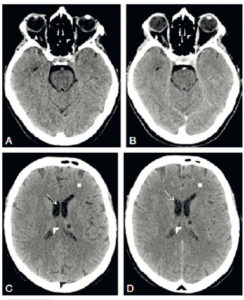
TDM cérébrale sans (A, C) et après injection (B, D) : la substance blanche (croix blanche) est moins dense que la substance grise intrathalamique (croix noire).
Le LCS (flèche blanche) est hypodense. Après injection, les vaisseaux et les plexus choroïdes sont plus hyperdenses que sur la TDM sans injection (têtes de flèche noires). La graisse intra-orbitaire est hypodense (triangles blancs). L’air au sein des cellules ethmoïdales est hypodense (têtes de flèche blanches).
L’eau, l’air et la graisse sont hypodenses (figure 23.14) ; les calcifications et le sang frais sont hyperdenses (figure 23.15).
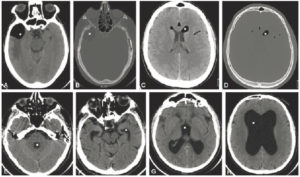
TDM cérébrale sans injection : hypodensités (étoiles).
A, B. Tumeur graisseuse extra-axiale temporale droite (méningiome lipomateux) (graisse). C, D. Pneumencéphalie suite à une fracture de la base du crâne (air). E-H. Hydrocéphalie à pression normale responsable d’une dilatation ventriculaire (liquide).
TDM cérébrales sans injection : hyperdensités spontanées intracrâniennes (croix noires).
A. Calcifications des ganglions de la base du crâne. B. Hématome extradural. C. Hématome sous-dural aigu. D. Hémorragie sous-arachnoïdienne. E. Hématome intraparenchymateux.
Après une acquisition sans injection, une injection intraveineuse de produit de contraste iodé peut être réalisée afin de rechercher des anomalies de rehaussement des vaisseaux ou des prises de contraste tissulaires (méninges, tumeur). Lorsqu’une structure est rehaussée, cela se traduit par une augmentation de la densité (ou hyperdensité) par rapport à la TDM réalisée sans injection. En pratique, on reconnaît le caractère injecté de la TDM par l’augmentation de la densité au sein des artères et des veines ainsi que des plexus choroïdes par rapport à la TDM sans injection (voir figure 23.13).
IRM cérébrale
Les séquences pondérées en T1 sont dites anatomiques. La substance blanche apparaît en hypersignal (plus blanche) que la substance grise, alors que la substance grise (cortex et ganglions de la base) apparaît en hyposignal. Le LCS est en hyposignal (figure 23.16).
IRM cérébrale en pondération T1 (A), T1 après injection de gadolinium (B), T2 (C), et FLAIR (D).
La substance blanche est en hypersignal T1 en hyposignal T2 et FLAIR (croix blanche). La substance grise thalamique est en hyposignal T1, en hypersignal T2 et FLAIR (croix noire). Le LCS intraventriculaire est en hyposignal T1, en hypersignal T2 et en hyposignal FLAIR (flèche blanche). La graisse intraorbitaire est en hypersignal T1, T2 et FLAIR (flèche noire). L’air est en hyposignal T1, T2 et FLAIR (tête de flèche blanche). Après injection de gadolinium, les structures vasculaires apparaissent plus hyperintenses qu’avant injection (tête de flèche noire).
Si l’on cherche une prise de contraste (au niveau des méninges, d’une tumeur bénigne ou maligne, ou d’une lésion inflammatoire), on réalise une séquence en pondération T1 après injection intraveineuse de gadolinium. Les prises de contraste vont se traduire par une augmentation de l’intensité du signal (plus blanche) par rapport au T1 réalisé sans injection. Comme en TDM, on reconnaît le caractère injecté d’une image pondérée en T1 par l’augmentation du signal au sein des artères et des veines du fait de la présence intraveineuse de gadolinium (voir figure 23.16). Il est important de noter que le tissu cérébral normal n’est pas rehaussé après injection de produit de contraste car ce dernier ne traverse pas la barrière hémato-encéphalique quand celle-ci est normale.
Pour visualiser les vaisseaux, il n’est pas toujours nécessaire d’injecter du produit de contraste, contrairement à la TDM. En effet, les séquences angiographiques sans injection (ou acquisitions par temps de vol ou TOF pour Time Of Flight) permettent de reconstruire les vaisseaux en analysant les flux en leur sein. Elles sont le plus souvent suffisantes pour analyser les artères du cercle artériel du cerveau (ou polygone de Willis) et les sinus veineux cérébraux. Le T2 est presque l’inverse d’un T1 : la substance blanche est en hyposignal par rapport à la substance grise (cortex et ganglions de la base ou noyaux gris centraux) et le LCS est en hypersignal (voir figure 23.16). La graisse est en hypersignal en T1 et de signal variable en T2, et l’air et l’os sont noirs en T1 comme en T2.
La séquence FLAIR est une séquence pondérée en T2 sur laquelle le signal des liquides a été annulé. Comme sur une séquence T2, la substance blanche est toujours en hyposignal par rapport à la grise alors que la substance grise (cortex et noyaux gris centraux) paraît plus en hypersignal que la substance blanche. Le LCS apparaît en hyposignal (voir figure 23.16).
Une structure anormale en IRM est décrite selon la terminologie suivante : une structure en hyposignal ou hypo-intensité est de signal ou d’intensité inférieur(e) au parenchyme cérébral normal. Une structure en hypersignal ou hyperintensité est de signal ou d’intensité supérieur(e) au parenchyme cérébral normal. Une structure en isosignal ou iso-intensité est de signal ou d’intensité similaire au parenchyme cérébral normal.
En cas d’hématome, le signal du sang varie en fonction du degré de dégradation de l’hémoglobine (figure 23.17) (voir chapitre 21).
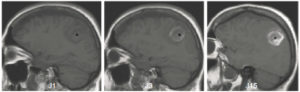
IRM cérébrales en pondération T1 sans injection : évolution du signal au cours du temps d’un hématome intraparenchymateux (croix noire) de l’isosignal vers l’hypersignal de J1 à J15.
IRM hypophysaire
L’hypophyse est explorée uniquement en IRM et par des coupes fines en T1 avant et après injection de gadolinium et en T2 (voir figure 23.9).
L’antéhypophyse est en isosignal T1 et T2 alors que la posthypophyse présente généralement un hypersignal T1 spontané lié au stockage de l’hormone antidiurétique.
Après injection de produit de contraste, l’antéhypophyse saine se rehausse de manière homogène du fait de l’absence de barrière hémato-encéphalique, ce qui permet le passage interstitiel du produit de contraste.
IRM médullaire
La moelle spinale, de petit diamètre, est uniquement explorée en IRM qui offre un meilleur contraste que la TDM (voir figure 23.10). La moelle spinale présente le même signal que le cerveau. En revanche, la substance grise est centrale et prend une forme de H, alors que la substance blanche est périphérique.
Médecine nucléaire
En scintigraphie de perfusion ou en TEP au 18F-FDG, une image normale est caractérisée par une fixation homogène et symétrique du MRP sur l’ensemble du cortex et des ganglions de la base (figure 23.18A). Les images anormales mettent en évidence une hypoperfusion ou un hypométabolisme dans les régions où il existe un dysfonctionnement neuronal ou une perte neuronale (figure 23.18B).
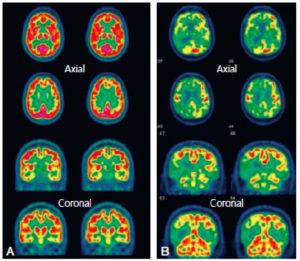
TEP au 18F-FDG.
A. Images normales : la fixation du traceur est intense et homogène, symétrique sur l’ensemble du parenchyme cortical et sous-cortical, apparaissant en rouge uniforme sur cette échelle de couleur communément utilisée. B. Images anormales : la fixation du traceur est diminuée sur l’ensemble du cortex (aspect en jaune) avec des régions cérébrales où l’examen met en évidence un hypométabolisme (aspect en vert) temporopariétal bilatéral et frontal droit. En fonction du contexte, cet aspect peut se rencontrer dans la démence de type Alzheimer. Attention, cet examen rentre dans le cadre d’un bilan spécialisé multidisciplinaire. Il faut toujours interpréter un examen d’imagerie métabolique de façon complémentaire aux données cliniques, neuropsychologiques et d’IRM.
En DatSCAN® ou 18F-DOPA, les images normales montrent une fixation homogène du striatum (noyaux caudés et putamens), sous forme de deux aires symétriques en forme de croissant d’égale intensité (figure 23.19A).
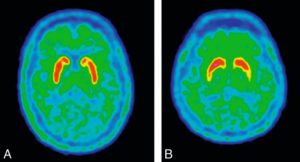
Coupes axiales de TEP à la 18F-DOPA.
A. Image normale : la fixation du traceur s’effectue au niveau des striatum, structures profondes sous-corticales ; la fixation est homogène et symétrique en avant sur les noyaux caudés et en arrière sur les putamens. B. Image anormale : la fixation est diminuée au niveau du putamen gauche avec un aspect aminci et jaune sur l’échelle de couleur utilisée. Le patient présente donc une dénervation dopaminergique présynaptique du putamen gauche en rapport avec un syndrome parkinsonien clinique à droite.
Séméiologie pathologique élémentaire en fonction des principaux syndromes
Tumeurs cérébrales
Une tumeur cérébrale (figure 23.20), du fait de l’augmentation de l’eau libre comme dans les métastases, paraît généralement hypodense en TDM et en hyposignal T1, en hypersignal T2 et FLAIR en IRM. La présence d’une néoangiogenèse et celle d’une rupture de la barrière hémato-encéphalique sont identifiées par une prise de contraste. Les tumeurs très cellulaires (par exemple le lymphome) restreignent la diffusion de l’eau libre ; elles sont en hypersignal en séquence de diffusion et en hyposignal sur la cartographie d’ADC. Les lésions tumorales cérébrales sont souvent entourées d’un œdème vasogénique apparaissant hypodense en TDM, en hyposignal T1, et en hypersignal T2 et FLAIR en IRM. Cet œdème est en plage, mal limité, et atteint préférentiellement la substance blanche, contrairement à l’œdème ischémique, cytotoxique.
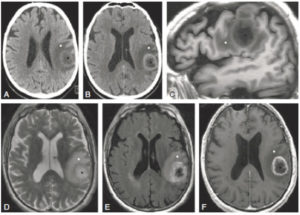
TDM cérébrale sans (A) et avec injection (B) ; IRM cérébrale en T1 sans injection (C), en T2 (D), en FLAIR (E) et T1 après injection de gadolinium (F).
Lésion tumorale intraparenchymateuse (croix noire), hypodense en TDM (A), en hyposignal T1 (C), en hypersignal T2 (D) et FLAIR (E), et rehaussée en périphérie après injection en TDM (B) et en IRM (F). La lésion est entourée d’œdème vasogénique (croix blanche) hypodense en TDM, en hyposignal T1 et en hypersignal T2 et FLAIR en IRM.
Comme les tumeurs cérébrales surexpriment généralement les transporteurs du glucose, la TEP au 18F-FDG peut également être utilisée dans certaines indications des bilans de tumeurs cérébrales, en particulier la recherche de récidive d’une tumeur de haut grade. Dans ce cas, il existe en TEP au 18F-FDG un hypermétabolisme intense lié à l’augmentation de la captation du glucose par les cellules tumorales (mécanisme différent de celui des pathologies neurodégénératives) (figure 23.21).
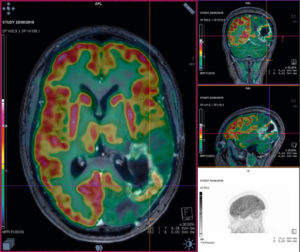
Coupes transversale, sagittale et coronale de TEP au 18F-FDG fusionnée avec l’IRM dans le cadre d’une suspicion de récidive d’un glioblastome occipital gauche, opéré il y a 10 mois.
Foyer hypermétabolique anormal à la partie postéro-inférieure de la prise de contraste en IRM compatible avec une récidive de haut grade comme la tumeur initiale.
La lésion tumorale et l’œdème qui l’entoure occupent de l’espace au sein du parenchyme cérébral, dans le volume non extensible qu’est la boîte crânienne. La lésion et l’œdème sont responsables d’un effet de masse, c’est-à-dire un refoulement des structures anatomiques adjacentes. Cet effet de masse peut aboutir à un engagement (figure 23.22), c’est-à-dire le refoulement de structures cérébrales à travers des orifices intracrâniens physiologiques généralement délimités par la dure-mère. On peut ainsi distinguer l’engagement sous-falcoriel, qui correspond au passage des structures de la ligne médiane sous la faux du cerveau, l’engagement temporal qui correspond à une hernie des structures temporales internes entre la tente du cervelet et le tronc cérébral, et l’engagement amygdalien qui correspond au passage des amygdales cérébelleuses au travers du foramen magnum (figures 23.23 et 23.24).
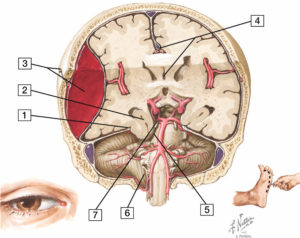
Différents types d’engagement cérébral dans un contexte d’hématome extradural temporo-pariétal droit.
1. Tente du cervelet ; 2. engagement temporal ; 3. fracture temporopariétale droite et hématome extradural droit ; 4. déviation de la faux du cerveau vers la gauche et engagement sous-falcoriel avec déviation du 3e ventricule ; 5. compression du pédoncule cérébral droit se traduisant par une hémiparésie gauche ; 6. engagement de l’amygdale cérébelleuse droite ; 7. compression du 3e nerf crânien se traduisant par un ptosis, un strabisme divergent et une mydriase homolatérale.
Source : Felten DL. Netter’s Neuroscience Flash Cards. Fourth Edition. Elsevier ; 2015.
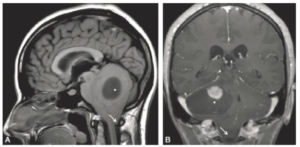
IRM cérébrale en coupe sagittale T1 sans injection (A) et coupe coronale T1 après injection de gadolinium.
Volumineuse lésion kystique cérébelleuse droite avec nodule mural prenant le contraste (astrocytome pilocytique) (croix blanche). Important effet de masse avec engagement bilatéral des amygdales cérébelleuses dans le foramen magnum (flèche blanche).
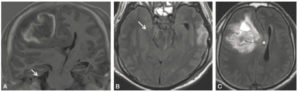
IRM cérébrale en coupe coronale en T1 (A) et en coupes axiales FLAIR (B, C).
Hématome intraparenchymateux responsable d’un engagement sous-falcoriel (croix blanche) et temporal (flèche).
L’engagement cérébral va induire la compression de certaines structures cérébrales comme la moelle allongée, par exemple en cas d’engagement amygdalien, ce qui peut rapidement aboutir au décès du patient.
Ischémie cérébrale
L’ischémie cérébrale est induite par une occlusion artérielle, le plus souvent du fait de la présence d’un caillot au sein d’une artère (voir chapitre 20). Elle se traduit par un œdème cytotoxique aboutissant à la nécrose du parenchyme cérébral au sein du territoire vascularisé par cette artère occluse. Cet œdème est typiquement bien limité à un territoire artériel et atteint plutôt la substance grise dans les premières heures. En TDM, cela se traduit par une hypodensité très discrète à la phase précoce, puis de plus en plus marquée (figure 23.25).
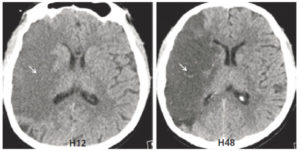
TDM cérébrale sans injection : hypodensité frontale droite (flèche blanche) correspondant à un AVC ischémique dans le territoire de l’artère cérébrale moyenne (ou sylvien) à 12 et à 48 heures du début des symptômes neurologiques.
L’IRM est plus sensible que la TDM à la phase précoce. Cela est particulièrement important car il existe maintenant des traitements de reperfusion de l’AVC ischémique de moins de 6 heures :
- l’injection intraveineuse d’un fibrinolytique, qui permet de détruire le caillot ;
- la thrombectomie, qui consiste à aspirer le caillot par voie endovasculaire en neuroradiologie interventionnelle.
La séquence IRM essentielle au diagnostic précoce de l’ischémie est la séquence de diffusion (voir chapitre 8) : la zone ischémiée est en hypersignal dès la première demi-heure après l’occlusion artérielle. Sur les autres séquences d’IRM (T2 et FLAIR), l’apparition de l’hypersignal est plus tardive : à partir de 6 heures après le début de l’ischémie (figure 23.26).
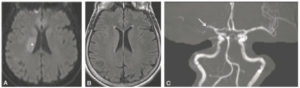
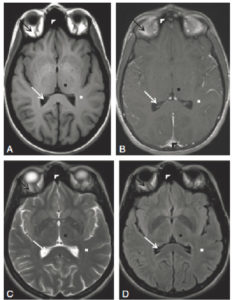
IRM cérébrale en coupes axiales diffusion (A), FLAIR (B) et angio-IRM du cercle artériel du cerveau (C).
Hypersignal en diffusion (croix blanche) correspondant à un AVC ischémique dans le territoire de l’artère cérébrale moyenne droite (ou sylvien droit). Celui-ci n’est pas encore visible en FLAIR, ce qui témoigne du caractère très récent (inférieur à 6 heures). L’angio-IRM montre une occlusion de l’artère cérébrale moyenne droite (flèche).
L’occlusion artérielle peut être mise en évidence par angio-TDM, ou par angio-IRM. Elle se traduit par la non-opacification ou la non-visualisation de l’artère occluse du fait de la présence du caillot (figure 23.26C, figure 23.27).
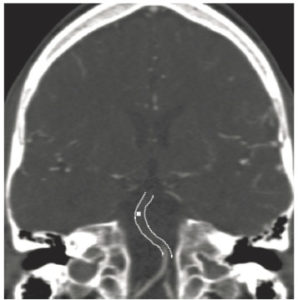
Angio-TDM du cercle artériel du cerveau montrant l’absence de rehaussement de la partie supérieure de l’artère basilaire témoignant d’une occlusion (croix blanche).
Le thrombus est représenté entre les traits en pointillés.
Hémorragie cérébrale
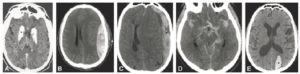
Le sang frais apparaît spontanément hyperdense en TDM, en l’absence de toute injection de produit de contraste (voir figure 23.15 et chapitre 21). Sa densité va ensuite évoluer vers l’hypodensité du fait de la dégradation de l’hémoglobine. Il est important de localiser l’espace dans lequel survient un saignement, en raison de sa valeur étiologique et thérapeutique :
- un hématome extradural est généralement secondaire à un traumatisme crânien avec fracture de la voûte et arrachement d’une structure vasculaire entre la voûte et la dure-mère : il apparaît sous la forme d’une lentille biconvexe hyperdense entre la dure-mère et la voûte osseuse ;
- un hématome sous-dural est généralement secondaire à un traumatisme crânien : il apparaît sous la forme d’un croissant à concavité interne hyperdense entre l’arachnoïde et la dure-mère. Il est généralement plus étendu que l’hématome extradural ;
- une hémorragie sous-arachnoïdienne est généralement secondaire à une rupture d’anévrisme : elle correspond à une hyperdensité entre la pie-mère et l’arachnoïde, dans les citernes de la base du crâne et/ou au fond des sillons corticaux ;
- un hématome intracérébral apparaît sous la forme d’une hyperdensité dans le parenchyme cérébral.
Épilepsie
Lorsqu’un examen d’imagerie est nécessaire, l’IRM est l’examen de référence, car elle permet de rechercher des anomalies responsables de la survenue de crises d’épilepsie : tumeurs, malformations corticales ou vasculaires.
En cas d’épilepsie pharmacorésistante, si un traitement chirurgical est envisagé, on peut réaliser une étude scintigraphique de la perfusion ou du métabolisme.
Celle-ci montre, au niveau de la lésion épileptogène, une hypoperfusion intercritique (en dehors des crises) en TEMP ou en TEP et une hyperperfusion percritique (pendant la crise) en TEMP.
Syndromes démentiels
Dans le cadre de l’évaluation de troubles cognitifs, l’IRM recherche des causes éventuellement curables de démences comme celles décrites ci-dessus (hématome sous-dural, tumeur, AVC), mais permet aussi de montrer les signes directs, mais tardifs, d’une maladie neurodégénérative comme une atrophie des hippocampes dans la maladie d’Alzheimer.
En médecine nucléaire, l’étude de la perfusion cérébrale et du métabolisme glucidique peut mettre en évidence précocement des zones de dysfonctionnement ou de mort neuronale se traduisant par une hypoperfusion ou un hypométabolisme. Les démences ont en général une topographie lésionnelle spécifique selon l’étiologie ; ces examens peuvent donc être utilisés à visée diagnostique et aider au diagnostic différentiel.
Tremblements et mouvements anormaux
L’IRM permet de rechercher des causes aux tremblements et mouvements anormaux (secondaires à des AVC ou lésions tumorales localisés au sein des ganglions de la base). Mais l’IRM, bien que limitée dans la maladie de Parkinson, permet également de rechercher des signes sémiologiques en faveur de certaines maladies neurodégénératives.
Le DatSCAN® et la TEP à la 18F-DOPA peuvent aider au diagnostic différentiel entre syndrome parkinsonien et tremblements essentiels.
Dans un syndrome parkinsonien, il existe une dégénérescence nigrostriée avec atteinte du versant présynaptique de la synapse dopaminergique au niveau striatal. Les images du versant présynaptique sont donc précocement anormales : asymétrie avec hypofixation du traceur du côté controlatéral aux signes cliniques (voir figure 23.19B).
Dans un tremblement essentiel, il n’y a pas d’atteinte neurodégénérative sous-jacente et les images du versant présynaptique de la synapse sont normales (voir figure 23.19A).
Perspectives
Les perspectives sont :
- l’utilisation de champs magnétiques de plus en plus élevés en IRM, qui permet d’augmenter la résolution spatiale mais s’accompagne en contrepartie de nombreuses contraintes ;
- l’utilisation de nouveaux MRP plus spécifiques comme les traceurs de la plaque amyloïde dans la maladie d’Alzheimer ;
- le développement d’appareils hybrides TEP-IRM permettant des acquisitions simultanées.
Essentiel à retenir
- En neuroradiologie, l’IRM est l’examen de première intention dans les affections médicales neurologiques, alors que la TDM est l’examen de première intention en pathologie traumatique.
- La substance blanche apparaît en hypersignal en T1, hyposignal en T2 et FLAIR, alors que la substance grise apparaît en hyposignal en T1 et en hypersignal T2 et FLAIR. Le LCS apparaît en hyposignal T1 et FLAIR et en hypersignal en T2.
- Le sang frais apparaît hyperdense en TDM. Son signal est variable dans le temps en IRM.
- En imagerie métabolique, il existe des MRP spécifiques pour l’exploration de quatre mécanismes physiopathologiques : perfusion cérébrale, métabolisme glucidique, dépôt des plaques amyloïdes, étude de la voie dopaminergique présynaptique.
- En métabolisme cérébral (18F-FDG), la fixation normale est intense, homogène et symétrique sur le parenchyme cortical et sous-cortical. Les régions anormales, où il existe un dysfonctionnement synaptique ou une mort neuronale, sont caractérisées par une fixation diminuée du traceur.
 |
Chapitre suivant |
 |
Retour au sommaire |
