Les fondamentaux - Chapitre 26 - Imagerie cardiovasculaire
A. Cochet et D. Mandry
Plan du chapitre
- Introduction
- Techniques d'imagerie
- Grands syndromes et leurs moyens d'exploration
Objectifs
- Connaissance
- Connaître les spécificités des principales techniques d'exploration de l'appareil cardiovasculaire : radiographie conventionnelle, angiographie, échographie, TDM, IRM, techniques scintigraphiques.
- Connaître leurs intérêts, limites et principales indications en pathologie cardiaque et vasculaire.
- Reconnaître les principales structures anatomiques du cœur et des vaisseaux sur des images d'IRM et de TDM.
- Savoir reconnaître un œdème aigu pulmonaire sur une radiographie de thorax et sur une TDM.
- Savoir reconnaître une ischémie et une nécrose sur une scintigraphie myocardique.
- Reconnaître et savoir décrire une séquelle d'infarctus sur une IRM cardiaque.
- Reconnaître et savoir décrire les éléments sémiologiques des principales pathologies vasculaires : anévrisme (échographie, TDM, IRM) ; dissection aortique (TDM, échographie) ; sténose artérielle (TDM, IRM, échographie, angiographie).
- Communication
- Savoir expliquer les principes de réalisation des examens à un patient.
Introduction
Ce chapitre présente les différentes techniques d'imagerie utilisées pour les explorations cardiovasculaires en insistant sur les particularités de l'exploration cardiaque, et sur leur utilité dans l'exploration des grands syndromes (pathologies vasculaires, ischémie et infarctus myocardique, insuffisance cardiaque).
Les prérequis sont les bases physiques des principales techniques d'imagerie, l'anatomie et la physiologie du cœur et de l'aorte, la physiopathologie et la séméiologie élémentaire des grands syndromes cardiovasculaires.
Techniques d'imagerie
Particularités des explorations cardiovasculaires en imagerie
Les techniques d'imagerie cardiovasculaire doivent tenir compte des particularités anatomiques et physiologiques du cœur.
Orientation des plans de coupe
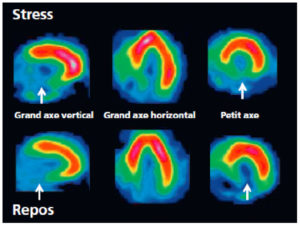
L'imagerie en coupes (TDM, IRM, scintigraphie) du cœur nécessite généralement une orientation selon le grand axe du ventricule gauche (VG). Celui-ci est défini comme une ligne qui passe par le centre de l'orifice mitral et par l'apex du VG. Il permet de définir trois plans de coupe : le plan dit « grand axe vertical » (ou plan « deux cavités »), le plan dit « grand axe horizontal » (ou « quatre cavités »), et le plan « petit axe », perpendiculaire aux précédents (figure 26.1). Cette orientation standardisée est commune à toutes les techniques d'imagerie en coupe du cœur, et permet en particulier une analyse précise de chacune des cinq parois du VG (parois antérieure, septale, inférieure, latérale et apicale).
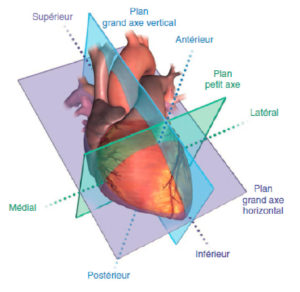
Orientation des trois principaux plans de coupe utilisés en imagerie cardiaque, définis selon le grand axe du ventricule gauche (VG).
VD : ventricule droit.
Source : Mitchell C, Rahko PS, Blauwet LA, et al. Guidelines for performing a comprehensive transthoracic echocardiographic examination in adults: recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr 2019 ; 32 : 1–64..
À partir de ces trois plans standardisés, d'autres orientations sont possibles, par exemple dans le plan de la chambre de chasse du VG, ou l'infundibulum pulmonaire.
Synchronisation à l'électrocardiographie (ECG)
Le cœur présente des mouvements cycliques (cycle cardiaque). Il est parfois nécessaire, selon le type d'imagerie et l'information que l'on veut obtenir, de tenir compte de ces mouvements lors de l'acquisition des images. Cela nécessite un enregistrement de l'ECG du patient en même temps que l'acquisition des images.
La synchronisation de la séquence d'acquisition se fait généralement avec l'onde R de l'ECG ; celle-ci constitue un bon indicateur de synchronisation car elle est brève et de bonne amplitude, ce qui facilite sa détection par des algorithmes de traitement du signal. Comme les phénomènes électriques du cœur précèdent les phénomènes mécaniques, l'onde R, qui signe le début de la systole électrique, précède la systole mécanique et correspond donc à la télédiastole (TD) mécanique.
Cette synchronisation à l'ECG peut être utilisée de deux manières : 1) en réalisant une acquisition à un moment donné du cycle cardiaque, généralement lorsque le VG est le moins mobile, en milieu de diastole (mésodiastole), afin d'obtenir une image « figée » du cœur. Il s'agit d'une synchronisation prospective, c'est-à-dire que les acquisitions des données sont déclenchées par la détection de l'onde R. Cette approche est choisie pour une exploration morphologique ou anatomique du cœur et des artères coronaires ; 2) en réalisant une acquisition tout au long du cycle cardiaque pour obtenir une série d'images consécutives dans le cycle cardiaque et afin de pouvoir produire des boucles d'images en mode « ciné ». Chaque intervalle R-R, correspondant à un cycle cardiaque, est divisé en segments de durée égale (généralement entre 8 et 32). Selon le type de technique d'imagerie, il peut être nécessaire d'associer les données de plusieurs cycles cardiaques (de quelques cycles en IRM jusqu'à plusieurs centaines en ventriculographie isotopique) afin d'obtenir suffisamment de signal pour représenter un seul cycle cardiaque (figure 26.2), à partir d'un cycle cardiaque moyenné à partir de plusieurs cycles acquis. Il s'agit d'une acquisition rétrospective, c'est-à-dire que les acquisitions des données sont simultanées avec celles de l'ECG et les images reconstruites ensuite en prenant en compte cette information. Cette approche est choisie pour une exploration fonctionnelle du cœur.
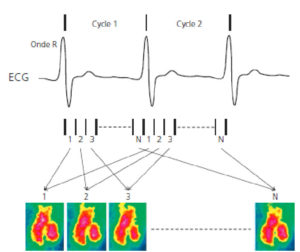
Concept d'acquisition synchronisée à l'ECG, exemple de la ventriculographie isotopique.
Une série de N images de durées égales est acquise au cours de chaque cycle cardiaque. Les premières images de chaque cycle sont associées entre elles pour obtenir une première image combinée, même chose pour les secondes images, etc. jusqu'à obtention d'une série d'images combinées représentant l'évolution du signal au cours d'un cycle.
L'analyse des images ainsi obtenues tout au long du cycle cardiaque permet d'évaluer la fonction ventriculaire gauche ou droite, en mesurant les volumes ventriculaires : volume télédiastolique (VTD) en fin de diastole, volume télésystolique (VTS) en fin de systole. La différence entre ces deux volumes, appelée volume d'éjection systolique (VES = VTD – VTS), correspond au volume sanguin éjecté par chaque ventricule à chaque contraction. Enfin, la fraction d'éjection ventriculaire (FEV) (%) est le rapport entre le volume d'éjection systolique et le volume télédiastolique (FEV = VES/VTD). La diminution de celle-ci (moins de 50 % pour le VG, moins de 45 % pour le ventricule droit [VD]) est un bon indice pour mesurer la dégradation de la fonction systolique ventriculaire dans les cardiopathies9.9..
D'autres paramètres fonctionnels sont également évaluables par l'imagerie, notamment la fonction diastolique, mais leur usage clinique est encore limité. C'est également sur ces images « ciné » que s'analyse la fonction contractile régionale, c'est-à-dire la contraction de chaque segment du cœur, en particulier du VG.
Elle s'apprécie essentiellement visuellement par l'épaississement de chaque segment :
- un segment se contractant normalement est normokinétique ;
- un segment dont la fonction est diminuée est hypokinétique ;
- un segment ne se contractant pas est akinétique ;
- un segment présentant une expansion en systole au lieu d'une contraction est dyskinétique.
De nouvelles modalités d'analyse automatisée de ces mouvements se développent afin de quantifier ce mouvement et cette déformation, ou analyse du strain.
Angiographie
Étymologiquement, l'angiographie est l'exploration des vaisseaux par imagerie. Sans précision, elle désigne les techniques radiographiques avec opacification directe des vaisseaux. Par extension, on parle également d'angiographie par TDM ou d'angiographie par IRM pour les explorations à visée vasculaire par ces techniques (ou plus simplement d'angio-TDM ou d'angio-IRM), voire en précisant les vaisseaux cibles (coroscanner, coro-IRM par exemple).
L'angiographie « classique » par rayons X concerne désormais quasi exclusivement les artères (artériographie), dont les artères du cœur (coronarographie) (figure 26.3A), et plus rarement les veines (phlébographie) ou les lymphatiques (lymphographie). Cet examen nécessite une ponction vasculaire, pour l'introduction d'un guide et d'un cathéter qui seront ensuite amenés sous contrôle radioscopique jusqu'au vaisseau à analyser (voir chapitres 15 et 21), ou le plus près possible de celui-ci ; il est alors procédé à l'acquisition des images concomitamment à une injection de produit de contraste iodé. Progressivement, l'angiographie par projection bidimensionnelle, qui requiert la réalisation de plusieurs incidences, est remplacée par des techniques d'acquisition tridimensionnelle. Cela reste néanmoins une analyse uniquement de la lumière du vaisseau, c'est-à-dire de l'intérieur, sans visualisation de sa paroi ; pour pallier cette limite, des techniques d'échographie endovasculaire et de mesures locales de pression se développent.
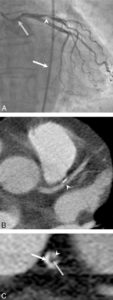
Exploration des coronaires par coronarographie et par coroscanner.
A. Coronarographie montrant un rétrécissement du calibre de l'artère interventriculaire antérieure proximale (tête de flèche). Cathéter dans l'aorte (flèche blanche) et extrémité (flèche grise) à l'ostium du tronc coronaire gauche pour une injection sélective du vaisseau. B. Coroscanner en coupe fine (< 1 mm) montrant la même sténose (tête de flèche) par une plaque d'athérome mixte (composante hypodense, thrombus, et composante hyperdense calcifiée). C. Coroscanner avec reconstruction perpendiculaire à l'axe du vaisseau montrant la lumière circulante, excentrique (tête de flèche), et la plaque d'athérome mixte (thrombus, flèche grise) et calcifiée (flèche blanche).
L'artériographie, en raison de son caractère invasif, est de moins en moins réalisée dans un but purement diagnostique, mais après un (des) examen(s) diagnostique(s) non invasif(s). Elle est utilisée dans un but thérapeutique : angioplastie, qui consiste à dilater un vaisseau, voire à y placer une endoprothèse (stent) pour le maintenir ouvert, ou embolisation pour stopper une hémorragie, par exemple. Cet aspect thérapeutique explique pourquoi l'artériographie reste l'examen de première intention dans certaines situations d'urgence, comme dans un tableau clinique et biologique de syndrome coronarien aigu (SCA).
Échographie et Doppler
L'échographie cardiaque transthoracique (figure 26.4) est l'examen d'imagerie de première intention dans les cardiopathies en raison de son innocuité, de sa disponibilité, et aussi grâce à son excellente résolution temporelle, particulièrement adaptée à l'exploration de cet organe ; en effet, l'échographie est une technique « temps réel », qui ne requiert donc pas le moyennage de données acquises sur plusieurs cycles cardiaques. Il est également possible de la réaliser lors d'un effort ou d'une épreuve de stress pharmacologique, pour analyser les modifications induites (recherche d'ischémie notamment, de modifications de gradients de pression dans certaines cardiomyopathies hypertrophiques).
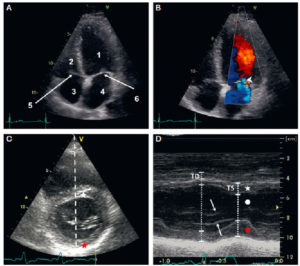
Échographie cardiaque par voie transthoracique.
A. Coupe apicale quatre cavités (grand axe horizontal) en niveaux de gris. 1. VG ; 2. VD ; 3. atrium droit ; 4. atrium gauche ; 5. valve tricuspide ; 6. valve mitrale. B. Même coupe, avec mode Doppler couleur, pour étudier les flux de remplissage ventriculaire et évaluer la sévérité d'une valvulopathie ; noter d'ailleurs ici une insuffisance mitrale physiologique (tête de flèche). C. Repérage, sur la coupe petit axe, de la ligne analysée en mode TM. D. Les segments permettent de mesurer la paroi septale (étoile blanche), la cavité ventriculaire gauche (rond blanc), et la paroi latérale (étoile rouge) en télédiastole (TD) et télésystole (TS), et ainsi de calculer une fraction de raccourcissement – diamètre de la cavité en TD-diamètre en TS)/diamètre en TD ; feuillets valvulaires mitraux (flèches).
La fenêtre acoustique (région de l'espace qui n'est pas masquée par les obstacles aux ultrasons), réduite par la présence des poumons, du sternum et des côtes, est la principale limite de cette technique ; cette limite est majorée chez les patients corpulents, ayant une déformation du thorax ou atteints de bronchopneumopathie chronique obstructive (BPCO).
Dans certains cas, l'échographie transthoracique est complétée par une échographie cardiaque transœsophagienne ; cette voie permet une meilleure appréciation des structures anatomiques proches de l'œsophage : atrium gauche, septum interatrial, valve mitrale, aorte descendante.
De nombreux paramètres fonctionnels peuvent être mesurés en échographie cardiaque, en utilisant différents modes : bidimensionnel, TM (temps-mouvement), Doppler.
En mode bidimensionnel, on analyse la morphologie du cœur, et on apprécie le fonctionnement des valves ainsi que la cinétique segmentaire et globale des ventricules ; la mesure des dimensions des cavités permet de calculer les volumes de celles-ci et la fraction d'éjection. Une autre façon d'apprécier la fonction systolique du VG est de calculer la fraction de raccourcissement entre télédiastole et télésystole de son diamètre interne (mode unidimensionnel TM). Le
Doppler est utilisé pour caractériser la sévérité des valvulopathies, fuyantes ou sténosantes.
De plus, de nouvelles approches d'acquisition et d'analyse se développent, permettant une description plus objective. On citera notamment l'échographie tridimensionnelle et des méthodes d'étude de la cinétique segmentaire (strain pariétal).
L'échographie est également un examen très utile en pathologie vasculaire (figure 26.5), notamment pour les vaisseaux superficiels (troncs supra-aortiques, vaisseaux des membres). En revanche, l'analyse des vaisseaux profonds et l'exploration « corps entier » sont limitées ; l'échographie est donc un examen de première intention, ou bien elle est réalisée pour préciser l'atteinte d'une zone localisée. Ses avantages cités précédemment en font par exemple un examen adapté au dépistage des anévrismes de l'aorte abdominale.
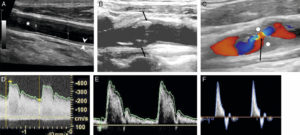
A. Échographie en niveaux de gris d'une artère carotide commune normale montrant la lumière normalement anéchogène (étoile blanche), la paroi (entre les deux têtes de flèche) avec la ligne hyperéchogène côté lumière correspondant à l'intima et la bande hypoéchogène à la média ; ici a été mesurée l'épaisseur intima-média, marqueur d'athérosclérose (valeur normale < 1 mm). B. Présence d'une plaque athéromateuse du bulbe carotidien avec une composante calcifiée (flèche blanche ; cône d'ombre acoustique postérieur) et une composante hypoéchogène (flèche grise). C. Sténose serrée d'une artère carotide interne par une plaque hypoéchogène (rond blanc) avec étude en Doppler couleur montrant un phénomène d'aliasing (flèche noire). D. Spectre Doppler correspondant avec mesure de la vitesse maximale à 4,1 m/s (sténose significative si > 2 m/s). E. Spectre Doppler normal d'une artère à faible résistivité, type carotide commune (vitesse maximale systolique autour de 1 m/s ici). F. Spectre Doppler normal d'une artère à haute résistivité, musculaire.
En mode bidimensionnel, le vaisseau se présente comme une structure à contenu anéchogène, avec une paroi fine hyperéchogène. Avec des sondes à très haute fréquence permettant une très bonne résolution spatiale, il est même possible de distinguer les différentes couches de la paroi artérielle de vaisseaux superficiels comme les carotides et de mesurer l'épaisseur intima-média, qui traduit une atteinte athéromateuse lorsqu'elle est augmentée. Les plaques d'athérome apparaissent, quant à elles, comme des épaississements focaux de la paroi ; selon leur composition, elles seront hypoéchogènes (plaques « molles » et thrombus), ou hyperéchogènes avec cône d'ombre acoustique postérieur en cas de calcifications (voir figure 26.5B, C). Les modes Doppler couleur et pulsé permettent de mesurer les vitesses circulatoires localement.
Les modes utilisés sont le bidimensionnel – pour une analyse morphologique d'un vaisseau, d'une sténose artérielle ou d'un anévrisme par exemple, de varices veineuses – et le Doppler, en mode couleur et/ou en mode pulsé – pour une analyse fonctionnelle avec par exemple la mesure de la vitesse de circulation au sein d'un vaisseau.
TDM
Les explorations de l'appareil cardiovasculaire par TDM nécessitent quasi systématiquement une injection intraveineuse de produit de contraste iodé. Pour une opacification satisfaisante, le débit d'injection doit être assez élevé (4 à 6 mL/s en général), et l'acquisition des images réalisée après un délai adapté au vaisseau à explorer (figures 26.6 et 26.7). Les acquisitions en contraste spontané (sans injection) sont rarement utiles en pathologie cardiovasculaire, en dehors des contextes d'urgence pour chercher du sang frais spontanément hyperdense – exemple du syndrome aortique aigu avec possiblement un hématome intramural de l'aorte, ou des accidents de la voie publique. Une exception est la mesure du « score calcique » qui permet de quantifier la charge calcique, c'est-à-dire la quantité de calcifications dans les parois des artères coronaires d'un patient, qui est un facteur pronostique du risque cardiovasculaire d'un sujet (voir figure 26.3B, C).
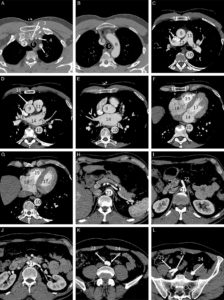
A-L. Anatomie normale en angio-TDM thoraco-abdominale (coupes axiales) au temps artériel.
1. Veine brachiocéphalique gauche ; 2. Veine brachiocéphalique droite ; 3. tronc artériel brachiocéphalique ; 4. artère carotide commune gauche ; 5. artère subclavière gauche ; 6. trachée ; 7. veine cave supérieure ; 8. crosse de l'aorte ; 9. aorte ascendante (segment 1) ; 10. aorte thoracique descendante (segment 3) ; 11. tronc de l'artère pulmonaire ; 12. branche droite de l'artère pulmonaire ; 13. branche gauche de l'artère pulmonaire ; 14. atrium gauche ; 15. auricule gauche ; 16. veines pulmonaires ; 17. ventricule gauche ; 18. atrium droit ; 19. ventricule droit ; 20. sinus coronaire ; 21. aorte abdominale ; 22. artère mésentérique supérieure ; 23. artère iliaque commune droite ; 24. artère iliaque commune gauche ; 25. artère iliaque externe droite ; 26. artère iliaque interne droite.
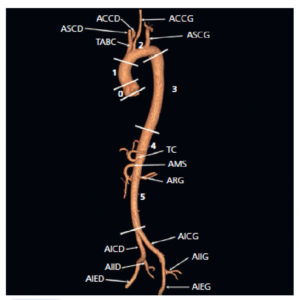
Aorte normale en angio-TDM au temps artériel avec reconstruction tridimensionnelle de type rendu volumique.
Segment 0 : racine de l'aorte, de l'anneau à la jonction sinotubulaire ; segment 1 : aorte ascendante ; segment 2 : crosse de l'aorte ou arc aortique ; segment 3 : aorte thoracique descendante ; segment 4 : aorte abdominale suprarénale ; segment 5 : aorte abdominale intrarénale. ACCD : artère carotide commune droite ; ACCG : artère carotide commune gauche ; AICD : artère iliaque commune droite ; AICG : artère iliaque commune gauche ; AIED : artère iliaque externe droite ; AIEG : artère iliaque externe gauche ; AIID : artère iliaque interne droite ; AIIG : artère iliaque interne gauche ; AMS : artère mésentérique supérieure ; ARG : artère rénale gauche (sous cette incidence, l'artère rénale droite n'est pas visible) ; ASCD : artère subclavière droite ; ASCG : artère subclavière gauche ; TABC : tronc artériel brachiocéphalique ; TC : tronc cœliaque.
Pour les explorations cardiaques, et également de l'aorte ascendante, il faut recourir à la synchronisation à l'ECG. L'acquisition est alors réalisée en systole pour l'anneau aortique, par exemple avant remplacement valvulaire (transcatheter aortic valve implantation [TAVI]), en diastole pour l'exploration des autres segments de l'aorte thoracique, l'imagerie des coronaires notamment, ou sur tout le cycle cardiaque pour l'analyse des valves par exemple. L'acquisition reste relativement longue par rapport au cycle cardiaque et donc au déplacement des artères coronaires, et la résolution spatiale est actuellement limitée pour les vaisseaux de moins de 1 mm. Aussi, cet examen peut requérir une préparation du patient pour réduire ou simplement stabiliser sa fréquence cardiaque (utilisation de bêta-bloquants) et dilater ses vaisseaux (dérivés nitrés par voie sublinguale par exemple).
L'analyse des images sur une console de post-traitement adaptée est une étape cruciale de l'examen. En particulier, pour mesurer correctement le calibre d'un vaisseau, il est impératif de procéder à une reconstruction de l'image perpendiculairement à son axe.
Parmi les techniques d'imagerie en coupes, la TDM est l'examen de référence pour l'exploration non invasive des vaisseaux de gros (voir figure 26.7) et moyen calibres (y compris les coronaires) (voir figure 26.3).
En pathologie cardiovasculaire, les principaux examens scanographiques sont :
- l'angio-TDM pulmonaire (suspicion d'embolie pulmonaire, ou de bilan malformatif) ;
- l'angio-TDM de l'aorte (recherche et suivi d'anévrisme, de coarctation, de dissection) ;
- l'angio-TDM des artères coronaires (diagnostic non invasif de la maladie coronaire).
Techniques scintigraphiques
Comme toutes les techniques de médecine nucléaire, les techniques scintigraphiques dédiées aux explorations cardiaques nécessitent l'administration d'un
MRP, dont les propriétés biologiques détermineront l'information qui sera obtenue sur les images. Comme la plupart des MRP, leur administration est contre-indiquée chez la femme enceinte.
Ventriculographie isotopique
La ventriculographie isotopique consiste en l'administration d'un MRP se distribuant uniquement mais de manière homogène dans l'espace vasculaire. On utilise généralement des globules rouges autologues marqués au 99mTc.
L'étude des variations temporelles de la radioactivité du sang contenu dans les cavités cardiaques permet d'obtenir des informations qualitatives et quantitatives sur la fonction ventriculaire gauche et droite, et surtout de manière fiable et reproductible la mesure des FEV.
Les images peuvent être acquises en mode bidimensionnel, en position oblique antérieure gauche afin d'être perpendiculaire à l'axe du septum interventriculaire et ainsi de bien séparer les deux ventricules (figure 26.8), ou en mode tomographique (tridimensionnel). La synchronisation à l'ECG permet d'obtenir une série d'images (16 voire 32) tout au long du cycle cardiaque.
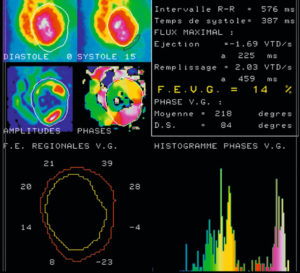
Ventriculographie isotopique.
Traceurs de la perfusion myocardique
Pour évaluer la perfusion myocardique, les MRP les plus utilisés sont des cations lipophiles marqués au 99mTc, le sestamibi et la tétrofosmine. Ils traversent la membrane cellulaire passivement dans le sens du gradient de potentiel électrique transmembranaire et vont s'accumuler préférentiellement dans les cardiomyocytes proportionnellement aux débits coronaires locaux. Cette captation est rapide, dès la première minute suivant l'injection.
Tous ces traceurs sont émetteurs monophotoniques et les images sont donc obtenues en scintigraphie conventionnelle, les acquisitions étant réalisées en mode tomographique, avec orientation des coupes selon les trois plans principaux du cœur.
Il est généralement réalisé une synchronisation à l'ECG pour améliorer la qualité de l'image et obtenir des informations fonctionnelles du VG (évaluation de la FEVG et de la contractilité des différentes parois du VG).
Le 201Tl, un cation monovalent dont le comportement est proche de celui du potassium, est plus irradiant et donc moins utilisé.
D'autres MRP aux caractéristiques biologiques proches ont également été développés pour la TEP (en particulier le rubidium-82 et le 18F-Flurpiridaz) avec un avantage en termes de qualité d'image, mais ces MRP ne sont pas encore employés en routine en France.
Autres traceurs
Le métabolisme glucidique du myocarde peut être exploré grâce au 18F-FDG, traceur TEP largement disponible. Dans ce cas, les territoires myocardiques non viables ne présenteront pas de fixation du 18F-FDG, tandis qu'au contraire les territoires ischémiques présenteront une hyperfixation relative, la glycolyse anaérobie étant dans ce cas la source d'énergie privilégiée du fait du manque d'O2.
Le 18F-FDG peut également être utile pour la détection de foyers infectieux cardiaques (endocardite infectieuse) ou vasculaires (anévrisme mycotique) ou encore pour le diagnostic de certaines pathologies inflammatoires pouvant atteindre le myocarde (sarcoïdose).
La scintigraphie à la MIBG marquée à l'123I (123I-MIBG), un analogue de la noradrénaline, permet d'évaluer et de quantifier l'innervation sympathique du myocarde, qui est altérée dans de nombreuses affections cardiaques, mais la place de cet examen en routine clinique reste encore à préciser.
IRM
Pour les explorations du cœur et des gros vaisseaux en IRM, la synchronisation à l'ECG est indispensable, et il est nécessaire également de tenir compte des mouvements respiratoires (réaliser une synchronisation aux mouvements respiratoires ou bien, le plus souvent, procéder à l'acquisition des images en apnée).
Cette synchronisation est généralement combinée avec des séquences d'acquisition très rapides ; de nombreuses sont disponibles qui permettent une exploration très complète du cœur et des gros vaisseaux.
Séquences ciné
La cinétique cardiaque peut être explorée avec une assez grande précision en IRM, en répétant l'acquisition du même plan de coupe à différents moments du cycle cardiaque. Les séquences utilisées sont des séquences d'écho de gradient segmentées rapides présentant un contraste très particulier avec une pondération T2/T1 (figure 26.9). Cette pondération se révèle intéressante en imagerie cardiaque car elle montre un fort contraste entre le myocarde (hyposignal) d'une part, et les espaces liquidiens et la graisse (hypersignal) d'autre part, de sorte que les contours endocardiques et épicardiques des ventricules sont nets.
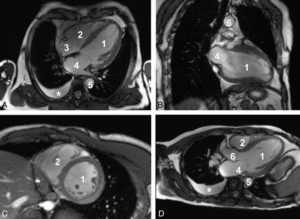
Séquences ciné-IRM dans les plans grand axe horizontal (A), grand axe vertical (B), petit axe (C) et un plan passant par la chambre de chasse du VG (D).
1. VG ; 2. VD ; 3. atrium droit ; 4. atrium gauche ; 5. aorte descendante ; 6. aorte ascendante. À noter qu'il existe un épanchement pleural droit liquidien, apparaissant en hypersignal sur ces images pondérées en T2/T1 (astérisque).
Ces séquences sont à la base des mesures fonctionnelles des VG et VD. L'excellente résolution spatiale et la bonne résolution temporelle de ces séquences, l'absence de zone muette font de l'IRM une technique de référence pour la mesure de la fraction d'éjection des deux ventricules, de la masse myocardique et des volumes télédiastolique et télésystolique. La masse et les volumes sont généralement indexés à la surface corporelle du patient.
Séquences d'imagerie morphologique « sang noir »
L'IRM permet également de caractériser les composantes tissulaires autour ou au sein du myocarde et des parois des gros vaisseaux. On utilise pour cela des séquences morphologiques dérivées de l'écho de spin, pondérées en T1 ou T2, pour lesquelles le signal du sang circulant apparaît en noir (figure 26.10).
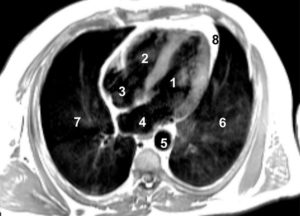
Séquence d'IRM morphologique « sang noir » pondérée en T1, dans le plan grand axe horizontal.
Le myocarde apparaît en isosignal, la graisse en hypersignal. Le sang circulant ayant quitté le plan de coupe entre l'impulsion préparatoire de 90° et l'impulsion refocalisatrice de 180°, les cavités cardiaques apparaissent en noir (vide de signal). 1. VG ; 2. VD ; 3. atrium droit ; 4. atrium gauche ; 5. aorte descendante ; 6. poumon gauche ; 7. poumon droit ; 8. graisse péricardique.
Les acquisitions sont réalisées lorsque le myocarde a un mouvement minimal, c'est-à-dire durant la mésodiastole ventriculaire.
Séquences d'imagerie de phase (cartographie des flux)
La cartographie des flux est possible avec l'IRM tout comme avec le Doppler en échographie. En contraste de phase, le signal mesuré est proportionnel à la vitesse des protons qui traversent le plan de coupe. Quand on pondère cette mesure par la surface de la zone d'intérêt (coupe du vaisseau selon son petit axe), on peut obtenir une mesure des débits (antéro- et rétrograde). Le contraste de phase permet donc une approche quantitative des flux vasculaires ou valvulaires. Le codage tridimensionnel des flux permet de visualiser ceux-ci au sein des gros vaisseaux et d'analyser les shunts, les fuites et les turbulences (technique dite « de flux 4D ») (figure 26.11).

Imagerie de cartographie des flux dans un plan axial passant par l'aorte ascendante (en blanc) et l'aorte descendante (en noir).
Le niveau de gris de chaque point représente une vitesse et une direction (blanc et noir correspondent aux vitesses maximales, gris correspond à une vitesse nulle). 1. Aorte ascendante ; 2. aorte descendante ; 3. artère pulmonaire ; 4. poumon gauche ; 5. poumon droit.
Séquences de perfusion et de rehaussement tardif
L'imagerie de la perfusion myocardique en IRM repose essentiellement sur l'utilisation de séquences rapides fortement pondérées en T1, associées à l'injection d'un produit de contraste à base de gadolinium qui augmente le contraste T1 dans son volume de distribution.
Dans des conditions normales, le signal du myocarde augmente rapidement au moment du passage du produit de contraste dans la circulation coronaire, puis dans le milieu extravasculaire du myocarde, pour ensuite diminuer progressivement au fur et à mesure que le produit de contraste quitte le secteur extravasculaire pour retourner dans le secteur vasculaire et être progressivement éliminé par voie rénale. Cependant, une altération locale de la perfusion se traduit par un rehaussement moindre et/ou un retard dans ce territoire lors de la phase initiale (figure 26.12). Cette analyse de la perfusion myocardique est notamment utilisée avec des agents pharmacologiques vasodilatateurs pour diagnostiquer une ischémie myocardique.
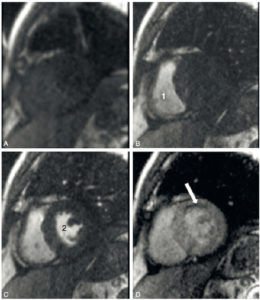
Images IRM successives d'un même plan de coupe petit axe au cours du premier passage d'un agent de contraste à base de gadolinium (séquence turbo FLASH précédée d'une impulsion saturation-récupération).
A. Avant le passage de l'agent de contraste. Les seules zones en hypersignal (blanc) correspondent à la graisse sur cette séquence fortement pondérée en T1. B. Arrivée de l'agent de contraste dans la cavité ventriculaire droite (1). C. Passage de l'agent de contraste dans la cavité ventriculaire gauche (2). D. Passage de l'agent de contraste dans le myocarde dont le signal augmente, sauf dans la région antérieure (flèche). L'hyposignal correspond à un déficit de perfusion du myocarde.
Plus tardivement, dans les minutes qui suivent l'injection, certaines régions du myocarde peuvent présenter un ralentissement de la phase d'évacuation du produit de contraste, voire une stagnation, et donc un hypersignal T1 par rapport au myocarde normal (figure 26.13). Ces mécanismes d'accumulation sont probablement liés à l'altération de la membrane capillaire, à l'augmentation du volume du liquide interstitiel, voire à la rupture des membranes cellulaires, qui augmente le volume de distribution du produit de contraste. Cela concerne donc toutes les situations pathologiques qui entraînent une destruction des cardiomyocytes (nécrose), une augmentation du volume interstitiel (maladies infiltratives de type amylose) et/ou la présence d'œdème (maladies inflammatoires de type myocardite).
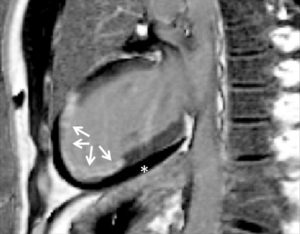
Séquence IRM de rehaussement tardif, 10 minutes après injection d'un agent de contraste à base de gadolinium.
Orientation grand axe vertical. On observe un hypersignal dans le tiers distal du VG, transmural, correspondant à une rétention du traceur du fait d'une large séquelle d'infarctus myocardique (flèches). Il existe également un épanchement péricardique liquidien, apparaissant en noir sur cette séquence fortement pondérée en T1 (astérisque).
Il est donc possible de réaliser des acquisitions dynamiques précoces, immédiatement après injection, permettant d'évaluer la perfusion myocardique (voir figure 26.12), et des acquisitions plus tardives (généralement 5 à 10 minutes après injection), appelées de « rehaussement tardif » pour dépister des anomalies structurelles du myocarde (voir figure 26.13).
Séquences de caractérisation tissulaire : T1 et T2 mapping
Toujours pour la caractérisation des anomalies structurelles myocardiques, ont été développées récemment des séquences produisant des images paramétriques fondées sur les temps de relaxation (T1, T2, T2⁎), appelées par exemple T1 mapping ou cartographie T1. De nombreux processus pathologiques peuvent entraîner des modifications des temps de relaxation : la présence d'œdème ou de fibrose entraîne une augmentation du T1 et du T2, tandis que l'infiltration lipidique ou la surcharge en fer entraînent leur diminution. Ces processus affectent également le volume extracellulaire myocardique, qui peut être calculé en comparant les valeurs de T1 avant et après injection d'un produit de contraste à base de gadolinium. Ces séquences complètent et précisent ainsi l'analyse tissulaire myocardique par IRM.
Angiographie par résonance magnétique (ARM)
Les séquences d'ARM peuvent utiliser un produit de contraste (chélate de gadolinium) ou le signal spontané du sang (séquence sang blanc). Dans le premier cas, on réalise une acquisition 3D millimétrique ou submillimétrique centrée sur le passage artériel du produit de contraste. Cette technique est excellente pour les vaisseaux peu mobiles, plus délicate pour les segments mobiles comme l'aorte ascendante qui produisent des artefacts de mouvement. La technique sang blanc sans injection est de plus en plus utilisée ; elle permet une acquisition en mode ciné et des mesures très précises en systole ou en diastole.
Compte tenu de ses capacités, l'IRM est devenue un examen de référence pour l'analyse des maladies du myocarde, des atteintes péricardiques et des cardiopathies congénitales opérées.
Grands syndromes et leurs moyens d'exploration
Pathologie des vaisseaux
Sténose artérielle
Une sténose, synonyme de rétrécissement localisé, est une diminution permanente du calibre d'un conduit anatomique, comme un vaisseau ou une valve cardiaque ; cela exclut donc les diminutions transitoires comme dans un spasme artériel. La cause principale des sténoses artérielles est l'athérosclérose.
L'imagerie (échographie et/ou TDM) permet de caractériser les sténoses en mesurant le degré de sténose (voir figure 26.3), souvent exprimé en pourcentage d'un calibre de référence (diamètre du vaisseau ou surface), et leur longueur. Une sténose d'au moins 70 % en diamètre est généralement à l'origine d'une diminution du débit d'aval, et est un seuil opératoire dans les sténoses de l'artère carotide interne par exemple, y compris chez les patients asymptomatiques.
Une autre approche est fondée sur les modifications hémodynamiques induites par la sténose, avec une accélération du flux sanguin à la zone de sténose maximale, mesurable en échographie-Doppler (voir figure 26.5).
Le degré ultime de sténose est la thrombose, ou occlusion de la lumière vasculaire, qui peut se constituer progressivement ou survenir brutalement en raison d'une rupture de plaque.
Un thrombus est un caillot sanguin qui se forme dans le cœur ou dans un vaisseau (figure 26.14) ; il peut ne pas être obstructif. Un des risques principaux de ces thrombus est leur migration dans la circulation sanguine, avec occlusion d'un vaisseau en aval ; on parle alors d'embolie – par exemple, un AVC ischémique secondaire à l'embolie d'un thrombus auriculaire gauche, classique dans la fibrillation atriale et justifiant le traitement anticoagulant au long cours. À noter que l'on parle également d'embolie avec d'autres « corps étrangers » migrés : embolie graisseuse, embolie gazeuse, embolie de cristaux de cholestérol, embolie de tout ou partie d'une tumeur, etc.
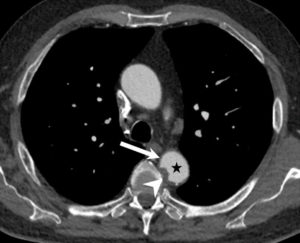
Angio-TDM aortique dans le plan axial.
Dans la lumière circulante de l'aorte thoracique descendante (étoile), il existe une hypodensité correspondant à un thrombus (tête de flèche). Noter également la paroi aortique (flèche) visible sur cet examen, modérément épaissie.
Anévrisme
Un anévrisme (figure 26.15) se définit comme une augmentation localisée et permanente du calibre d'un vaisseau d'au moins 50 %, ce qui engendre une perte de parallélisme des bords. Il est exploré en TDM. Il se distingue des méga-artères dont le calibre est augmenté de façon généralisée.
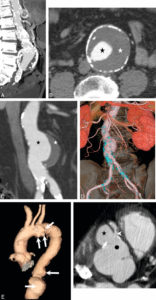
Anévrismes.
A. Reconstruction en MIP épaisse en sagittal oblique d'une angio-TDM de l'aorte abdominale, montrant un anévrisme fusiforme de celle-ci. Noter les calcifications pariétales diffuses (athérome), la lumière et le thrombus. B. Coupe axiale du même patient, à environ mi-hauteur de cet anévrisme ; lumière circulante (étoile noire) et thrombus (étoile blanche). C, D. Anévrisme sacciforme de l'aorte abdominale en angioTDM en reformation (C) et rendu volumique 3D (D). Noter le développement unilatéral à gauche de cet anévrisme (étoile noire : lumière circulante ; étoile blanche : thrombus). E. Rendu volumique 3D d'un angioTDM de l'aorte chez un patient présentant de multiples anévrismes sacciformes (flèches blanches). F. Coupe axiale au niveau de la racine de l'aorte montrant un de ces anévrismes (étoile noire) développé aux dépens du sinus antérieur droit (rond noir), et situé à côté de l'ostium de la coronaire droite (tête de flèche).
Un anévrisme se caractérise par : sa localisation (vaisseau et partie du vaisseau atteints), sa forme (sacciforme, en sac, ou fusiforme, en fuseau), son diamètre maximal et sa longueur.
La zone de communication entre la lumière vasculaire normale et l'anévrisme s'appelle le collet ; il y en a un seul en cas d'anévrisme sacciforme et deux en cas de fusiforme.
Les anévrismes peuvent être uniques ou multiples, et toucher les vaisseaux de tout calibre ainsi que les cavités cardiaques, mais concernent principalement les artères. Il est important de considérer l'état du vaisseau atteint, ainsi que celui des autres vaisseaux, pour guider la prise en charge thérapeutique.
Il existe également des faux anévrismes (ou pseudo-anévrismes) qui se distinguent des anévrismes car leur paroi est constituée par un autre tissu que celui de la paroi artérielle (par exemple par du péricarde en cas de rupture ventriculaire gauche après un infarctus du myocarde).
Dissection
Une dissection (figure 26.16) est un clivage dans la paroi artérielle (entre l'intima et la média), avec création d'un hématome, spontanément hyperdense en TDM, voire d'un faux chenal qui peut être circulant ou thrombosé. Elle peut survenir sur toutes les artères, mais le cas le plus emblématique est la dissection de l'aorte. La classification de Stanford distingue les dissections de l'aorte de type A lorsque l'aorte ascendante est atteinte, et celles de type B lorsque l'atteinte débute au-delà de l'artère subclavière gauche. La dissection aortique est une urgence diagnostique, et s'intègre dans le syndrome aortique aigu avec l'hématome intramural de l'aorte et l'ulcère athéromateux pénétrant. Une dissection de type A, avec atteinte de l'aorte ascendante donc, est aussi une urgence chirurgicale (risque de rupture et de tamponnade).
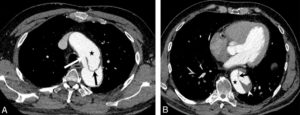
Dissection.
Coupes axiales d'angio-TDM au temps artériel passant par la crosse aortique (A) et l'aorte thoracique descendante distale (B). Brèche intimale (flèche blanche) située ici au niveau de la crosse aortique, au pied de l'artère subclavière gauche (dissection de type B selon Stanford), se présentant comme une discontinuité dans la paroi aortique ; il peut exister une ou plusieurs réentrées, qui se présentent de la même façon et situées plus en distalité sur l'aorte ou ses collatérales. Existence d'un vrai chenal (étoiles noires) et d'un faux, séparés par le flap intimal (flèches noires et blanche) ; noter le thrombus (tête de flèche blanche) qui obstrue partiellement la lumière du faux chenal de l'aorte thoracique descendante distale dans ce cas.
Dans un contexte d'urgence, pour l'étude de l'aorte et des gros vaisseaux, l'examen de première intention est la TDM en raison de sa disponibilité, de sa rapidité de réalisation, de la couverture corps entier possible et de sa résolution spatiale. Elle permet de visualiser le voile intimal, la porte d'entrée et celles de réentrée, l'état du faux chenal (perméable ou thrombosé), l'extension aux collatérales, les signes de rupture et les éventuels retentissements parenchymateux (ischémie).
En cas d'instabilité hémodynamique majeure, une échocardiographie transthoracique, voire transœsophagienne, permet souvent de confirmer ou d'infirmer le diagnostic de dissection de type A, sans toutefois permettre un bilan d'extension et de retentissement aussi exhaustif.
Pour le suivi des atteintes connues (anévrisme, dissection au stade chronique), l'IRM peut être choisie en raison de l'absence d'exposition du patient aux radiations ionisantes ; le choix peut également s'orienter vers la TDM, pour la reproductibilité des mesures et une couverture anatomique plus large actuellement (des troncs supra-aortiques aux iliaques en quelques secondes par exemple).
Thrombose veineuse profonde
La thrombose veineuse profonde des membres inférieurs (phlébite) est explorée en échographie en première intention. Les signes directs sont l'absence de flux en Doppler et la visibilité d'un caillot complètement ou partiellement occlusif dans la lumière du vaisseau. Les signes indirects sont l'absence de compressibilité de la veine sous la sonde et la présence de voies de suppléance.
Une embolie pulmonaire est une complication classique d'une thrombose veineuse profonde des membres inférieurs et est explorée préférentiellement en angio-TDM (en scintigraphie plus rarement) (voir chapitre 25).
Pathologies des coronaires : ischémie myocardique et infarctus
Rappels physiopathologiques
L'ischémie myocardique est liée à une inadéquation entre besoins et apports en oxygène au myocarde. Elle est généralement provoquée par une diminution de la perfusion myocardique, secondaire à une occlusion partielle ou totale d'une artère coronaire ou d'une de ses branches.
Si cette ischémie se prolonge, elle évoluera soit vers une ischémie chronique (on parle d'hibernation myocardique), soit vers une nécrose cellulaire, irréversible.
Le myocarde ischémique présente une dysfonction contractile, qui est généralement réversible si le débit sanguin est restauré, après un passage par une phase de sidération myocardique (dysfonction contractile transitoire malgré la restauration de la perfusion). On parle de myocarde viable. En revanche, en cas de nécrose, la dysfonction contractile est irréversible (tableau 26.1).
Tableau 26.1 - Tableau comparatif des caractéristiques des différents états du myocarde
|
Perfusion |
Fonction contractile |
Métabolisme glucidique |
Viabilité |
|
|
Myocarde normal |
Normale |
Normale |
Normal |
Oui |
|
Ischémie |
Diminuée |
Altérée |
Augmenté |
Oui |
|
Nécrose |
Diminuée ou stoppée |
Altérée |
Stoppé |
Non |
|
Hibernation (ischémie chronique) |
Diminuée |
Altérée |
Augmenté |
Oui |
|
Sidération |
Normalisée |
Altérée |
Normal ou augmenté |
Oui |
La vascularisation coronaire présente plusieurs caractéristiques qui sont importantes à rappeler pour comprendre la physiopathologie de l'ischémie myocardique :
- dans des conditions normales, le réseau coronaire est terminal, c'est-à-dire qu'en situation normale il n'y a pas de suppléance entre les territoires coronaires ;
- la distribution du flux coronaire dans l'épaisseur du muscle cardiaque n'est pas homogène : les artères coronaires et leurs branches cheminent à la surface épicardique du muscle cardiaque et donnent naissance à des artères perforantes qui pénètrent dans l'épaisseur du myocarde et qui sont, elles, terminales. Le myocarde sous-endocardique est donc moins bien perfusé que le myocarde sous-épicardique, et est plus sensible à l'ischémie. Ainsi, la nécrose cellulaire résultant de l'infarctus apparaît au niveau de l'endocarde pour s'étendre progressivement en front de vague vers l'épicarde ;
- dans des conditions normales, le débit sanguin coronaire peut s'adapter de manière quasi linéaire aux besoins en oxygène et nutriments du myocarde et, ainsi, lors d'un effort important, être multiplié par un facteur 3 à 5 par rapport au repos. Cette adaptation se fait essentiellement grâce aux capacités vasomotrices des artérioles (propriété de se dilater ou de se contracter et ainsi de moduler leur rayon). Le rapport entre le débit coronaire au repos et à l'effort est appelé « réserve de débit coronaire », ou « réserve coronaire ».
L'atteinte des artères coronaires est le plus souvent la conséquence de l'athérosclérose, avec constitution de plaques d'athérome dans les parois des artères.
Ces plaques évoluent de deux manières :
- soit elles se développent lentement et entraînent une sténose d'aggravation progressive de la lumière coronaire. Cette sténose est dans un premier temps compensée par une vasodilatation des artérioles coronaires en aval, voire la constitution d'un réseau collatéral d'importance variable. Ce type de lésion entraîne alors une ischémie qui n'apparaît initialement qu'à l'effort, du fait de la diminution de la réserve coronaire. L'expression clinique est un angor stable d'effort. Lorsque la sténose devient trop importante, l'ischémie survient même au repos ; l'expression clinique évoluera vers un angor de repos ;
- soit elles se fracturent ou se fissurent, ce qui entraîne la formation d'un thrombus intracoronaire au contact, une réduction brutale du diamètre artériel, voire une occlusion complète aboutissant à une ischémie ou une nécrose. L'expression clinique est la survenue d'un syndrome coronarien aigu (SCA) : angor instable ou infarctus du myocarde. La nécrose résultant de l'infarctus apparaît au niveau de l'endocarde pour s'étendre progressivement vers l'épicarde. La plaque d'athérome instable est donc plus à risque qu'une simple sténose progressive.
Indications de l'imagerie
Les examens complémentaires viennent en complément de l'analyse clinique, qui doit toujours se situer en amont de leur prescription.
Le choix des examens complémentaires d'imagerie varie donc en fonction de la situation et de la question posée. De manière schématique, il peut s'agir de détecter une pathologie des coronaires (et d'en apprécier l'importance), d'évaluer la présence de viabilité myocardique (généralement chez un patient coronarien connu) ou, enfin, de réaliser un diagnostic différentiel.
Test d'ischémie et imagerie des coronaires
Il existe deux approches possibles, qui peuvent être complémentaires : la réalisation d'un test d'ischémie couplé à une imagerie (échographie, IRM ou scintigraphie), ou l'imagerie des coronaires pour détecter directement une lésion coronarienne.
Test d'ischémie couplé à l'imagerie
Trois techniques d'imagerie peuvent être utilisées : l'échographie, l'IRM et la scintigraphie myocardique, permettant d'évaluer la contractilité et/ou la perfusion myocardique (tableau 26.2). Ces examens sont très fréquemment utilisés pour confirmer ou non le diagnostic de maladie coronaire, pour établir un pronostic de cette maladie et pour orienter les indications thérapeutiques.
Tableau 26.2 - Tableau comparatif des performances des différentes techniques d'imagerie couplées à un test d'ischémie
|
Paramètre myocardique explorable |
Test d'ischémie associé |
|||
|
Contractilité |
Perfusion |
Viabilité |
||
|
IRM |
++ |
++ |
+++ |
Vasodilatateur, dobutamine |
|
Scintigraphie au 201Tl |
+ |
++ |
++ |
Épreuve d'effort, vasodilatateur, dobutamine |
|
Scintigraphie au 99mTc-MIBI |
+ |
++ |
– |
Épreuve d'effort, vasodilatateur, dobutamine |
|
Échographie |
++ |
– |
– |
Épreuve d'effort, dobutamine |
Ces examens sont réalisés non seulement au repos, mais également au cours d'un test d'ischémie, dont l'objectif est de reproduire ou simuler les conditions d'un stress myocardique. Cela permet ainsi de comparer la contractilité et/ou la perfusion myocardique au repos et au cours d'un stress.
Les principales anomalies recherchées sont donc :
- l'existence de zones d'ischémie ou de nécrose myocardique et leur étendue (pourcentage de myocarde concerné) ;
- les paramètres de fonction ventriculaire gauche segmentaire et globale, notamment la FEVG et les volumes ventriculaires gauches.
L'absence d'anomalie (de contraction ou de perfusion) en post-stress comme au repos est en faveur de l'absence d'ischémie ou de nécrose.
La présence d'une anomalie uniquement après stress, réversible au repos, est en faveur d'une ischémie (figure 26.17).
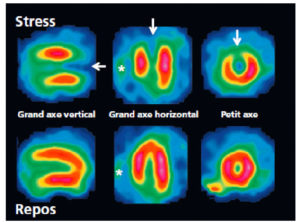
Scintigraphie myocardique au 99mTc-MIBI : ischémie.
L'injection du traceur et l'acquisition des images sont réalisées au décours d'un effort (stress) et quelques heures plus tard au repos, après réinjection. On constate une absence de perfusion dans le territoire apical et antérieur distal en post-stress (flèches), qui se rétablit au repos. Il s'agit d'un aspect d'ischémie myocardique dans ce territoire. À noter que le myocarde du VD (astérisque) n'est pas explorable en scintigraphie myocardique, sa perfusion étant beaucoup plus faible que celle du myocarde du VG et sa paroi beaucoup plus mince.
La présence d'anomalies en post-stress et non réversibles au repos est en faveur d'une nécrose ou d'une ischémie chronique (hibernation), sans pouvoir toujours faire la distinction entre les deux (figure 26.18).
Scintigraphie myocardique au 99mTc-MIBI : nécrose.
L'injection du traceur et l'acquisition des images sont réalisées au décours d'un effort (stress) et quelques heures plus tard au repos, après réinjection. On constate une absence de perfusion dans le territoire inférieur en post-stress (flèches), non réversible au repos. Il s'agit d'un aspect évocateur de nécrose myocardique dans ce territoire. Cependant, une ischémie « chronique » non réversible au repos (hibernation) ne peut pas être exclue.
En pratique, aucune de ces techniques n'est clairement supérieure aux autres. Le choix se fait en fonction de la situation. L'échographie et la scintigraphie ont l'avantage de pouvoir être couplées à une épreuve d'effort, contrairement à l'IRM (il est effectivement difficile de faire réaliser un effort au patient lorsqu'il est confiné dans l'aimant). En revanche, l'IRM est une technique très complète permettant d'obtenir des informations fonctionnelles (contractilité, perfusion), mais également anatomiques et structurelles (voir tableau 26.2).
Il existe trois types de test d'ischémie, qui sont tous réalisés sous la responsabilité d'un cardiologue et couplés à un enregistrement de l'ECG en continu :
- l'épreuve d'effort, qui est la technique qui se rapproche le plus des conditions physiologiques ; elle permet à elle seule d'apporter des éléments diagnostiques en faveur d'une atteinte ischémique. L'effort entraîne des effets inotropes et chronotropes positifs, qui augmentent les besoins du myocarde et, en conséquence, la perfusion partout où c'est possible. En aval d'une sténose, les capacités vasodilatatrices sont déjà mobilisées et une ischémie apparaît. L'épreuve d'effort doit être dans la mesure du possible « maximale », c'est-à-dire conduire à une augmentation de la fréquence cardiaque jusqu'à obtention de la fréquence maximale théorique (FMT) qui est égale à 220 moins l'âge du patient ;
- perfusion de dobutamine à dose croissante dont les effets chronotrope et inotrope stimulent les conditions d'un effort ;
- l'injection d'un vasodilatateur coronaire (dipyridamole ou régadénoson), qui va augmenter le débit de perfusion en aval des coronaires saines, alors qu'en aval d'une sténose, les artérioles sont déjà dilatées pour compenser la diminution du débit coronaire. Le vasodilatateur ne pourra donc pas augmenter autant la perfusion que dans les autres territoires, d'où la visualisation d'une diminution relative de la perfusion myocardique en aval d'une sténose hémodynamiquement significative.
Imagerie des coronaires : TDM et coronarographie
Il s'agit dans ce cas de mettre en évidence directement une éventuelle sténose ou occlusion sur le réseau coronaire soit de manière non invasive (TDM), soit de manière invasive (coronarographie).
La TDM des coronaires (coro-TDM ou « coroscanner ») est un examen qui bénéficie d'une excellente valeur prédictive négative, c'est-à-dire qu'un examen normal permet d'éliminer avec une quasi-certitude la présence d'une lésion. Elle permet de préciser l'anatomie, notamment en cas d'anomalie de connexion (« de naissance ») ou de trajet des artères coronaires, de localiser et de quantifier de manière non invasive d'éventuelles lésions coronariennes sténosantes. Une de ses limites principales reste la résolution spatiale, en particulier en cas de calcifications coronaires ou de stent, avec une quantification alors souvent imprécise de la lumière. Mais les progrès technologiques repoussent régulièrement cette limite.
La coronarographie n'est réalisée en première intention que dans un contexte d'urgence (tableau de syndrome coronarien aigu), sinon pour confirmer les résultats d'un examen non invasif. Elle permet surtout de réaliser, si c'est possible, un traitement endoluminal (angioplastie) de la ou des lésions.
Une autre limite de cette approche morphologique est que l'on ne connaît pas l'impact fonctionnel réel d'une lésion : certaines sténoses en apparence importantes n'auront que peu d'impact du fait d'un bon réseau collatéral ; d'autres sténoses plus modérées auront au contraire un impact significatif, avec apparition d'une ischémie d'effort en aval. C'est tout l'intérêt des mesures complémentaires (pression intra-artérielle pour mesure de la réserve coronaire, directe ou simulée, et des approches fonctionnelles).
Évaluation de la viabilité myocardique
Il s'agit dans ce cas d'une maladie coronarienne connue : lésion coronaire occlusive ou pré-occlusive, et anomalies de la contractilité du myocarde en aval de cette lésion. L'objectif est de savoir si le myocarde atteint est viable ou non viable (nécrosé) et donc si une reperfusion de l'artère en cause permettrait d'obtenir un rétablissement fonctionnel.
Trois techniques d'imagerie permettent de différencier myocarde viable et myocarde nécrosé : l'IRM avec injection de chélates de gadolinium et séquences de rehaussement tardif, la scintigraphie myocardique au 201Tl, et enfin la TEP au FDG.
Parmi ces trois techniques, l'IRM est à considérer en priorité car c'est une technique sans exposition aux radiations ionisantes permettant une exploration complète du cœur (fonctionnelle et morphologique). De plus, son excellente résolution spatiale permet de faire la distinction entre séquelle de nécrose sous-endocardique et transmurale. Les techniques scintigraphiques sont à considérer en fonction de leur disponibilité.
Diagnostic différentiel
Certaines maladies non ischémiques peuvent se présenter cliniquement comme un syndrome coronarien. Le tableau 26.3 résume les principaux diagnostics différentiels et leurs techniques privilégiées d'exploration en imagerie.
Tableau 26.3 - Principaux diagnostics différentiels des syndromes coronariens aigus, et leurs moyens d'exploration en imagerie
|
Échographie |
IRM |
TDM |
Scintigraphie |
|
|
Péricardite |
++ |
++ |
+ |
– |
|
Myocardite |
– |
++ |
– |
– |
|
Dissection aortique |
++ (ETO) |
++ |
++ |
– |
|
Embolie pulmonaire |
±⁎ |
± |
++ |
++⁎⁎ |
ETO : échographie transœsophagienne.
⁎ L'échographie peut mettre en évidence des thrombus très proximaux au niveau des artères pulmonaires.
⁎⁎ Scintigraphie pulmonaire de ventilation/perfusion (voir chapitre 25).
Insuffisance cardiaque
L'insuffisance cardiaque est un syndrome clinique caractérisé par des symptômes typiques qui peut s'accompagner de signes localisateurs (augmentation de la pression jugulaire, crépitants pulmonaires et œdèmes périphériques), et qui est causé par une anomalie cardiaque structurelle ou fonctionnelle.
Rappels physiopathologiques
L'insuffisance cardiaque correspond à une réduction du débit cardiaque et/ou des pressions intracardiaques élevées au repos ou au cours d'un stress (définition 2016 de la Société européenne de cardiologie). Ses causes principales sont l'athérosclérose coronaire (insuffisance cardiaque post-infarctus ou au cours de l'ischémie) et l'HTA. D'autres causes plus rares sont possibles (pathologie valvulaire, cardiomyopathies primitives, cardiomyopathies infectieuses, inflammatoires ou infiltratives, etc.).
Indication des examens d'imagerie
Le diagnostic de l'insuffisance cardiaque repose sur l'examen clinique. L'imagerie a pour but :
- de confirmer le diagnostic de l'insuffisance cardiaque et d'établir la surveillance ;
- de rechercher des signes de complication dont l'œdème aigu du poumon ;
- de faire un diagnostic étiologique.
Estimation de la fraction d'éjection ventriculaire gauche (FEVG)
L'un des meilleurs paramètres pour évaluer l'insuffisance cardiaque est la FEVG, qui témoigne de l'efficacité de la contraction cardiaque. Dans la plupart des cas, l'insuffisance cardiaque entraîne une baisse de la FEVG proportionnelle à la gravité de l'atteinte. L'IRM et la ventriculographie isotopique constituent les techniques les plus robustes pour évaluer la FEVG, mais l'échographie est souvent privilégiée du fait de sa disponibilité et de sa portabilité. L'évaluation de la FEVG est également importante pour apprécier la gravité de l'atteinte, et assurer le suivi sous traitement. D'autres paramètres (VTD et VTS, débit cardiaque) peuvent aussi être utiles pour le suivi.
Évaluation de l'œdème aigu du poumon
La radiographie thoracique peut jouer un rôle pour diagnostiquer une décompensation aiguë de l'insuffisance cardiaque. Souvent, les cavités cardiaques, notamment gauches, sont dilatées, ce qui se traduit sur la radiographie thoracique par un élargissement de la silhouette médiastinale, objectivé par un index cardiothoracique supérieur à 0,5 (figure 26.19). L'œdème pulmonaire cardiogénique, présentation aiguë de l'insuffisance cardiaque, se présente sur la radiographie thoracique par des opacités floconneuses bilatérales, des lignes de Kerley de type B, qui sont de fines lignes (2 à 3 mm) d'environ 1 cm de longueur, perpendiculaires à la plèvre et qui prédominent aux bases, et/ou de type C (lignes B vues de face) et par un épanchement pleural le plus souvent bilatéral. En TDM, les éléments sémiologiques s'expliquent par la physiopathologie de cet œdème pulmonaire : épaississement des septums interlobulaires à prédominance apicale lié à la dilatation veineuse pulmonaire, verre dépoli par engorgement alvéolaire et épanchement pleural (figure 26.20).
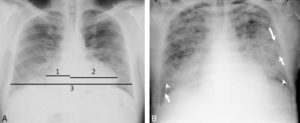
Insuffisance cardiaque.
A. L'index cardiothoracique se mesure sur une radiographie thoracique de face, rayon incident postéro-antérieur, bien inspirée. Il correspond au rapport de la somme des deux diamètres des arcs médiastinaux inférieurs droit et gauche depuis la ligne médiane (ligne des processus épineux) par le plus grand diamètre interne du thorax : (1 + 2)/3. Dans ce cas, il a été mesuré à 0,58 (valeur normale < 0,50). Cette augmentation traduit la cardiomégalie. Les culs-de-sac latéraux sont libres. B. Œdème pulmonaire cardiogénique : élargissement médiastinal ; opacités floconneuses bilatérales par comblement alvéolaire ; quelques lignes de Kerley B (flèches) et C (têtes de flèche)
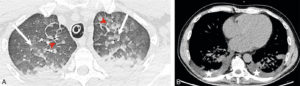
Insuffisance cardiaque.
A. Coupe axiale de TDM thoracique en fenêtre parenchymateuse pulmonaire. Épaississement des septums interlobulaires par dilatation veineuse pulmonaire (têtes de flèche) et verre dépoli intralobulaire (flèches) traduisant l'engorgement alvéolaire. Condensations parenchymateuses pulmonaires postérieures. B. Coupe axiale de TDM thoracique en fenêtre médiastinale. Épanchement pleural bilatéral (étoiles), hypodense, avec concavité vers l'avant (déclivité).
Bilan étiologique
L'insuffisance cardiaque survient le plus souvent dans un contexte étiologique connu (par exemple un patient développant une insuffisance cardiaque dans les suites d'un infarctus). Cependant, il est parfois nécessaire de faire un diagnostic étiologique. Dans ce contexte, l'échographie et surtout l'IRM jouent un rôle prépondérant. L'IRM permet de rechercher des anomalies myocardiques structurelles (présence de fibrose, de nécrose) dont l'importance et la topographie permettent d'orienter le diagnostic étiologique.
Enfin, dans le cas particulier de l'insuffisance cardiaque à FEVG préservée, l'imagerie est utile pour évaluer la fonction diastolique (capacités de remplissage du VG durant la diastole) qui est altérée. L'échographie est l'examen de choix, et à un moindre degré la ventriculographie isotopique et l'IRM.
Essentiel à retenir
- L'échographie Doppler permet d'explorer les structures vasculaires des membres et du cou en prodiguant des informations morphologiques et fonctionnelles hémodynamiques (vitesses circulatoires locales). Elle est plus limitée pour l'exploration des structures vasculaires abdominales, thoraciques et intracérébrales.
- L'échographie cardiaque transthoracique, disponible, non invasive et facile d'utilisation, constitue l'examen d'imagerie de première intention pour l'exploration du cœur. Sa bonne résolution temporelle, associée à l'étude de l'effet Doppler, permet d'analyser très finement les mouvements du myocarde et des valves.
- L'angiographie est une technique d'exploration des vaisseaux par leur opacification directe. Il s'agit d'une technique invasive mais qui présente le grand avantage de pouvoir être associée à un geste thérapeutique (angioplastie pour traitement d'une sténose, embolisation pour stopper une hémorragie, etc.).
- En imagerie en coupes (TDM et IRM), il est le plus souvent nécessaire de synchroniser l'acquisition des images avec l'ECG du patient, afin de tenir compte des mouvements cycliques du cœur, pour s'en affranchir ou au contraire les étudier.
- La TDM, du fait de son excellente résolution spatiale, est surtout utilisée pour l'exploration morphologique des artères de gros calibre (aorte et ses branches, notamment les artères coronaires), après injection d'un agent de contraste à base d'iode pour rehausser le contenu des vaisseaux. Elle est souvent l'examen de première intention dans un contexte d'urgence avec atteinte des grosses artères (aorte et branches), sauf dans l'infarctus du myocarde (coronarographie première pour traitement simultané par désobstruction de l'artère responsable).
- En médecine nucléaire, il existe de multiples MRP permettant d'explorer au choix la contractilité des ventricules, la perfusion et la viabilité myocardique, le métabolisme des cardiomyocytes ou l'innervation sympathique du cœur.
- L'IRM permet une analyse de la contractilité myocardique, de la perfusion myocardique sous couvert de l'injection d'un chélate de gadolinium, mais également de la morphologie et de la structure du myocarde (détection de la nécrose ou de la fibrose myocardique), ainsi qu'une exploration morphologique et fonctionnelle de l'aorte.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 25 - Imagerie thoracique
M. Ohana , G. Ferretti , M. Montaudon et P.-Y. Le Roux
Plan du chapitre
- Radiographie du thorax
- Tomodensitométrie thoracique
- Scintigraphie pulmonaire de ventilation-perfusion
- TEP-TDM au 18F-FDG
Objectifs
Connaissances
- Connaître les critères de qualité d'une radiographie thoracique de face.
- Connaître les différences entre une radiographie de face debout et au lit.
- Connaître la séméiologie élémentaire de la radiographie thoracique :
- pouvoir différencier une opacité d'une clarté pulmonaire et d'une image mixte ;
- savoir localiser une anomalie parenchymateuse au sein des différents lobes ;
- identifier les contours de la silhouette médiastinale ;
- connaître la morphologie normale des culs-de-sac pleuraux.
- Connaître les non-indications de la radiographie thoracique selon la Haute autorité de santé (HAS).
- Connaître la séméiologie de base de la tomodensitométrie (TDM) thoracique :
- reconnaître les fenêtres médiastinale, parenchymateuse et osseuse ;
- pouvoir déterminer si la TDM est injectée ;
- si elle est injectée, savoir déterminer s'il s'agit d'un temps artériel pulmonaire, artériel aortique ou veineux ;
- reconnaître des modifications basiques de la densité du parenchyme pulmonaire : augmentation de densité (condensation alvéolaire, verre dépoli, nodules et masses) ; réduction de densité (emphysème, excavation) ; images mixtes.
- Connaître les indications principales pour lesquelles une TDM thoracique doit être injectée, et celles pour lesquelles ce n'est pas nécessaire.
- Connaître un ordre de grandeur relatif de l'exposition aux rayonnements ionisants entre radiographie et TDM thoraciques.
Compétences
- Sur une radiographie thoracique de face, reconnaître :
- un pneumothorax de forte abondance ;
- une cardiomégalie ;
- un foyer de condensation alvéolaire lobaire ;
- un nodule/une masse parenchymateuse.
- Sur une TDM thoracique, identifier :
- une condensation alvéolaire ;
- un nodule/une masse parenchymateuse ;
- une masse médiastinale ;
- un nœud lymphatique médiastinal normal/pathologique ;
- un défaut de rehaussement au sein des artères pulmonaires ;
- une hyperclarté anormale (pleurale/parenchymateuse).
Communication
- Savoir expliquer à un patient le déroulement d'une angio-TDM thoracique pour recherche d'embolie pulmonaire.
Radiographie du thorax
La radiographie du thorax reste, en 2022, l'examen radiologique le plus pratiqué en France avec environ 13 millions de clichés annuels, concernant dans 60 % des cas des patients hospitalisés. Le coût CCAM (classification commune des actes médicaux) d'une radiographie thoracique de face (réalisation + interprétation) est d'environ 26 euros.
Ce chapitre a pour objectifs de présenter les critères de qualité d'une radiographie thoracique, les éléments essentiels de sa sémiologie et ses indications résiduelles.
Critères de qualité d'une radiographie du thorax
La radiographie thoracique de face est un examen qui doit être acquis dans la mesure du possible en incidence postéro-antérieure, patient debout, de face stricte, en inspiration profonde et correctement contrasté, afin d'être interprétable (figure 25.1).
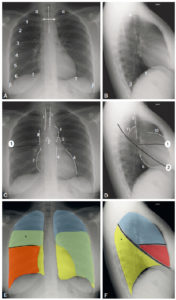
Radiographies normales du thorax, de face et de profil.
A, B. Critères de qualité et éléments anatomiques. Visibilité des apex (α) et des culs-de-sac pleuraux (β), d'au moins six arcs costaux antérieurs au-dessus des coupoles diaphragmatiques (γ) et projection symétrique des articulations sternoclaviculaires (double flèche blanche) par rapport à la ligne des processus épineux (ligne en pointillés). C, D. Structures médiastinales et scissures principales. Structures médiastinales (lignes blanches en pointillés). 1. Trachée ; 2. Carène ; 3. crosse aortique ; 4. bord gauche de l'aorte descendante ; 5. artère pulmonaire ; 6. ventricule gauche ; 7. atrium droit ; 8. veine cave supérieure ; 9. bord postérieur de la trachée ; 10. infundibulum du ventricule droit ; 11. bord supérieur et postérieur de la crosse aortique. Scissures (lignes noires). 1. Petite scissure ; 2. grande scissure (droite et gauche sont représentées superposées). E, F. Représentation des lobes pulmonaires et de leurs superpositions. En bleu : lobe supérieur ; en jaune : lobe inférieur ; en rouge : lobe moyen. Sur la radiographie de thorax de face, les lobes se superposent : la partie la plus apicale du lobe inférieur avec le lobe supérieur (*, vert) et le lobe moyen avec le lobe inférieur droit (orange). Sur le cliché de profil, seule la segmentation du poumon droit est représentée.
L'incidence postéro-antérieure répond à des critères de réalisation stricts : le patient est debout, en inspiration profonde, face contre le capteur de rayons X, dos au tube qui est situé à 1,8 mètre afin de limiter au maximum les déformations géométriques et de ne pas augmenter artificiellement la taille du cœur, situé dans le compartiment antérieur du médiastin. À l'opposé, les radiographies réalisées au lit sont acquises en incidence antéropostérieure, entraînant une majoration de taille du cœur rendant peu fiable l'appréciation du rapport cardiothoracique.
L'acquisition en position debout permet de dégager les culs-de-sac pleuraux latéraux et autorise une inspiration maximale. Les radiographies acquises en position assise ou au lit sont systématiquement de moins bonne qualité. La présence d'un niveau hydroaérique dans l'estomac, sous la coupole diaphragmatique gauche, est un bon indicateur de cliché acquis en position debout ; de même, la position couchée est généralement spécifiée sur le cliché.
L'obtention d'une face stricte est assurée par un centrage précis du patient, qui se vérifie sur le cliché de radiographie thoracique par :
- la visualisation de l'ensemble des parenchymes pulmonaires, des apex jusqu'aux culs-de-sac pleuraux ;
- le caractère médian du sternum et symétrique des articulations sternoclaviculaires par rapport à la ligne des processus épineux.
L'inspiration maximale se vérifie par la visualisation d'un nombre suffisant d'arcs costaux antérieurs ; il faut pouvoir compter au moins six arcs costaux antérieurs au-dessus de la coupole diaphragmatique droite.
Le réglage du contraste, qui peut être affiné a posteriori si l'examen est lu sur support informatique, doit permettre de visualiser la silhouette des corps vertébraux thoraciques en arrière du médiastin.
À retenir
Check-list avant de pouvoir interpréter une radiographie thoracique de face
- Vérification de l'identité du patient et de la date du cliché.
- Acquisition debout : niveau hydroaérique gastrique ; étiquetage.
- Cadrage : des apex jusqu'aux culs-de-sac pleuraux latéraux et inférieurs.
- Centrage : symétrie des clavicules par rapport à la ligne des épineuses.
- Inspiration : compter au moins 6 arcs costaux antérieurs au-dessus de la coupole diaphragmatique droite.
- Contraste : distinguer le rachis thoracique en arrière du médiastin.
Ce n'est qu'après s'être assuré de la qualité du cliché de radiographie thoracique que l'on peut passer à son interprétation. Inversement, tout cliché ne respectant pas ces critères de qualité ne doit être interprété qu'avec la plus extrême précaution ; en particulier, les radiographies thoraciques réalisées au lit sont souvent mal inspirées et mal centrées, ce qui peut très facilement créer de fausses images (syndrome interstitiel, foyer de condensation, cardiomégalie, masse médiastinale) ou, au contraire, en masquer (figure 25.2). Il ne faut pas hésiter à refaire un cliché jugé techniquement insuffisant.
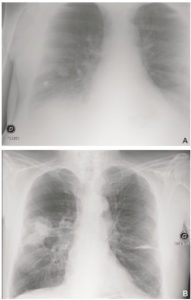
Patient de 68 ans, admis aux urgences pour altération de l'état général avec dyspnée.
Un premier cliché de radiographie du thorax (A) est réalisé à l'admission, à 23 heures. Il est techniquement insuffisant, mal cadré (il manque l'apex droit et le cul-de-sac gauche), n'est pas de face et est mal inspiré (position assise, on ne voit pas assez d'espaces intercostaux). B. Un cliché est réalisé le lendemain matin, en position debout, avec une inspiration suffisante, et démasque deux masses spiculées lobaires supérieures droites en rapport avec une néoplasie primitive.
Rappelons que le cliché radiographique montre par convention le patient vu de face ; sa droite est ainsi à la gauche du cliché.
Afin de vous aider à ne pas « oublier » de regarder un des compartiments anatomiques du thorax et à ne pas négliger une anomalie, nous vous proposons de suivre le plan de lecture systématique et organisé de la radiographie thoracique suivant :
- identification du patient ;
- qualité : centrage, position, noircissement ;
- parties molles extrathoraciques, seins ;
- cadre osseux : rachis thoracique, côtes, clavicules, scapulas ;
- médiastin : trachée, cœur, vaisseaux, lignes médiastinales ;
- hiles : taille, position, densité ;
- plèvre : diaphragmatique, costale, médiastinale ;
- champs pulmonaires : taille, situation, symétrie de transparence ;
- zones cachées : apex pulmonaires, hiles, rétrocardiaque, rétrodiaphragmatique ;
- sous le diaphragme : niveau hydroaérique gastrique.
Les acquisitions complémentaires de la radiographie thoracique standard sont :
- le profil (figure 25.1B), dont l'acquisition ne doit pas être systématique car plus irradiant que la face. Il est acquis systématiquement en profil gauche afin de minorer la taille du cœur. Il est utile pour localiser une anomalie vue sur le cliché de face (nodule, masse, condensation alvéolaire, atélectasie), explorer les espaces clairs rétrosternal et rétrocardiaque, et objectiver un épanchement pleural de faible abondance de localisation postérieure ou scissural enkysté ;
- l'acquisition de face en expiration profonde, qui peut être utile pour majorer un petit pneumothorax difficilement visible en inspiration, ou pour confirmer indirectement la présence d'un corps étranger endobronchique obstructif, entraînant l'absence de collapsus pulmonaire expiratoire du poumon d'aval (appelé également piégeage expiratoire : le poumon piégé est de grande taille et reste « noir » en expiration).
Sémiologie élémentaire de la radiographie du thorax
La radiographie standard est une imagerie de transmission et de projection (voir chapitre 3) :
- de transmission car tout ce qui atténue le faisceau de rayons X entraîne une opacité plus ou moins marquée, tandis que toute transmission anormalement facile du faisceau de rayons X (air) aboutit à une clarté ;
- de projection car la structure 3D traversée est projetée (« aplatie ») sur une image 2D.
Ces deux critères permettent de différencier et de localiser les anomalies.
Une opacité pulmonaire se traduit par une augmentation de la densité, comparativement au parenchyme pulmonaire adjacent, c'est-à-dire par une image plus « blanche ». Cette augmentation peut être plus ou moins marquée selon la composition et la taille de l'anomalie : une lésion calcifiée est plus opaque (« blanche ») qu'une lésion tissulaire, qui est elle-même plus opaque qu'une lésion graisseuse.
Une clarté est une diminution de la densité, c'est-à-dire une image plus « noire ». La clarté est due à un remplacement du parenchyme pulmonaire normal par de l'air qui n'atténue plus la transmission des rayons X (tableau 25.1).
Tableau 25.1 - Effets de l'atténuation des rayons X sur l'image radiologique
|
Absorption des RX |
Structure |
Traduction radiographique |
|
+ |
Air |
Image noire |
|
++ |
Graisse |
Image gris foncé |
|
+++ |
Tissu mou – eau |
Image gris clair |
|
++++ |
Calcification – os |
Image blanche |
|
+++++ |
Métal |
Image blanche brillante |
Une fois ces anomalies repérées, il faut déterminer leur localisation :
- médiastinale : sur le cliché de face, on définit les localisations supérieure (au-dessus de la crosse de l'aorte), moyenne et inférieure (en-dessous de la carène). Sur le cliché de profil, on détermine les positions antérieure (en avant de l'aorte ascendante et du cœur), moyenne et postérieure (derrière une ligne passant 1 cm en arrière du bord antérieur des corps vertébraux). Une opacité médiastinale se manifeste par une augmentation de densité et/ou de taille du médiastin. La clarté médiastinale, ou pneumomédiastin, se manifeste par la présence anormale d'air moulant les structures médiastinales normales ;
- parenchymateuse. Il faut préciser la position lobaire :
- à droite, il y a trois lobes : la limite entre le lobe supérieur et le lobe moyen est la petite scissure (fissure horizontale), qui du fait de sa position horizontale à mi-champ pulmonaire est souvent bien visualisée sur les clichés de face et de profil ; la grande scissure (fissure oblique) sépare le lobe inférieur, en bas et en arrière, des lobes supérieur et moyen en haut et en avant (car, en l'occurrence, un bout du lobe inférieur est au-dessus du lobe moyen). Elle n'est pas visualisée sur le cliché de face mais visible sur le profil. Le signe de la silhouette (figure 25.3) aide à localiser une anomalie. Lorsqu'une opacité anormale, ayant une densité proche des tissus, est en contact avec une structure normale de même densité (médiastin ou diaphragme) leurs contours respectifs ne sont plus visibles sur toute l'étendue du contact. Ce signe correspond à celui de la silhouette. Ce signe permet de localiser une opacité par rapport à une structure connue et parfois de la démasquer. Il n'en précise pas l'origine ;
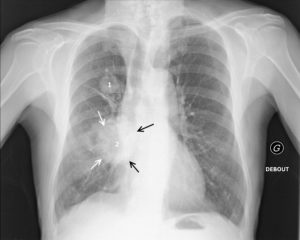
Patient de 54 ans, fumeur, avec un double cancer pulmonaire droit.
La radiographie du thorax objective un nodule du lobe supérieur droit (1) de contours spiculés, et une masse à contours spiculés (flèches blanches) en projection de la base pulmonaire droite (2). La masse 2 est soit dans le lobe moyen, soit dans le lobe inférieur. Si une opacité de tonalité hydrique se trouve dans le lobe moyen, son bord interne se confond avec le bord droit du cœur. Or, ici, la masse est silhouettée par de l'air sur son bord interne (flèches noires), ce qui signifie qu'elle n'est pas dans le plan du cœur, mais plus postérieure ; c'est le signe de la silhouette. La masse 2 se situe donc dans le lobe inférieur droit.
- à gauche, il y a deux lobes, séparés par la grande scissure. Elle est habituellement visible sur un cliché de profil et invisible sur le cliché de face.
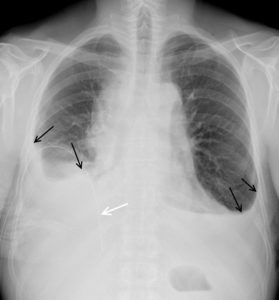
- pleurale : il faut rechercher une opacité déclive comblant le cul-de-sac pleural (= épanchement – figure 25.4), une clarté plutôt apicale (= pneumothorax – figure 25.5) ou une opacité avec des angles de raccordement doux (= lésion d'origine pleurale – figure 25.6) ;
Patient de 46 ans, admis aux urgences pour dyspnée et douleur thoracique.
Comblement des culs-de-sac pleuraux latéraux par une opacité concave vers le haut, bien délimitée, à angle de raccordement pleural doux, correspondant à un épanchement pleural bilatéral. La limite de cet épanchement (flèches noires) est appelée ligne de « Damoiseau ». À droite, un drain pleural a été posé (flèche blanche). Noter la disparition des contours normaux des coupoles diaphragmatiques en raison d'un signe de la silhouette.
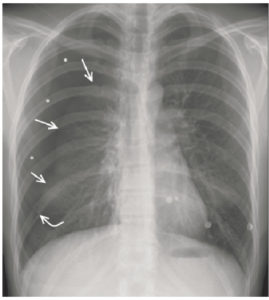
Patient de 18 ans, admis aux urgences pour douleur thoracique droite secondaire à une chute d'un arbre.
On visualise une hyperclarté hémithoracique périphérique droite (astérisques), avec une absence de trame alvéolo-interstitielle et une ligne pleurale (flèches) délimitant de manière nette le poumon droit tassé : pneumothorax droit secondaire à une fracture costale (flèche courbe).
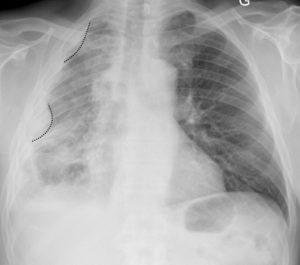
Patient de 57 ans exposé professionnellement à l'amiante.
Multiples opacités pleurales droites, à angle de raccordement doux, réalisant un aspect festonné de la plèvre. Il s'agit d'un aspect évocateur d'une tumeur primitive de la plèvre, le mésothéliome. Il s'accompagne d'une perte de volume du poumon droit.
- pariétale : les clartés pariétales témoignent de la présence anormale d'air dans la paroi. La cause la plus fréquente est l'emphysème pariétal accompagnant un pneumothorax (figure 25.7).
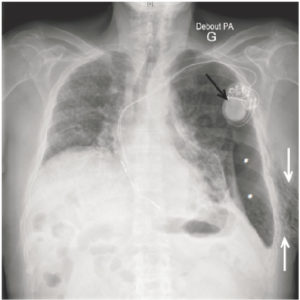
Patient de 87 ans porteur d'une fibrose pulmonaire idiopathique.
Pneumothorax gauche (astérisque) avec emphysème sous-cutané pariétal axillaire gauche (flèches blanches), se manifestant sous la forme de clartés linéaires d'extension limitée. Noter l'aspect pathologique du parenchyme pulmonaire droit en rapport avec la fibrose. Présence par ailleurs d'un pace-maker (flèche noire).
Une fois la lésion localisée, il faut étudier ses caractéristiques :
- contours : sont-ils nets (= limite claire entre la lésion et les structures saines adjacentes) ou flous ? S'ils sont nets, sont-ils réguliers ou irréguliers ? S'ils sont irréguliers, sont-ils macrolobulés, microlobulés ou spiculés ?
- forme : ronde, ovalaire, segmentaire, etc. ;
- densité : homogène ou mixte (= mélange d'opacités et/ou de clartés différentes) ?
- taille : pour les lésions du parenchyme, on parle de micronodule lorsqu'une lésion fait moins de 5 mm, de nodule jusqu'à 3 cm et de masse au-delà de 3 cm.
Indications
La radiographie est un examen très souvent demandé pour de nombreuses pathologies thoraciques.
Afin de limiter son utilisation, la HAS a établi en 2009 une liste des principales non-indications de la radiographie thoracique :
- dans les maladies respiratoires non tumorales, la radiographie thoracique n'est pas indiquée dans les infections des voies aériennes hautes, la bronchite aiguë, la bronchiolite non compliquée de l'enfant ou la douleur thoracique non spécifique en dehors de l'urgence ;
- dans les maladies cardiovasculaires, la radiographie thoracique n'est pas indiquée en cas d'hypertension artérielle (HTA) ou pour le suivi de l'insuffisance cardiaque ;
- dans les maladies tumorales, la radiographie thoracique n'est pas indiquée pour le dépistage et ne garde que de rares indications pour le suivi, entre deux examens tomodensitométriques ;
- dans le bilan pré-anesthésie, la radiographie thoracique n'est pas indiquée chez les sujets de moins de 60 ans sans comorbidités cardiopulmonaires ;
- dans les services de réanimation, la radiographie thoracique n'est pas indiquée de manière systématique chez un patient stable non ventilé ;
- dans les services d'urgences, la radiographie thoracique n'est pas indiquée systématiquement, et ne doit pas être réalisée lorsque l'on suspecte une perforation œsophagienne, une dissection aortique ou une rupture d'anévrisme.
Tomodensitométrie thoracique
Le thorax, y compris en imagerie cardiaque, est un domaine où la tomodensitométrie (TDM) excelle, du fait de sa haute résolution spatiale et du contraste naturel élevé des structures (voir chapitre 4).
Technique
L'interprétation d'une TDM thoracique doit absolument se faire sur une console informatique, qui permet une adaptation en temps réel du contraste, des zooms, des reconstructions multiplanaires dans les trois plans de l'espace, des reconstructions obliques selon le plan des vaisseaux et un défilement facilitant le repérage d'anomalies.
Il est plus simple d'analyser une TDM thoracique en trois étapes successives (figure 25.8) :
- l'étude du médiastin : elle se fait en « fenêtre médiastinale » (niveau 30 unités Hounsfield [UH]) ; largeur 350 UH), avec un filtre qui favorise le contraste et permet de bien analyser les structures tissulaires et vasculaires du médiastin ;
- l'étude du parenchyme : elle se fait en « fenêtre parenchymateuse » (niveau –400 UH ; largeur 1600 UH), avec un filtre qui favorise la résolution spatiale et fait bien ressortir les structures interstitielles fines.
- l'étude de la paroi : elle se fait en « fenêtre osseuse » (niveau 500 UH ; largeur 1500 UH), avec un filtre qui favorise la résolution spatiale et des reconstructions 2D et 3D.
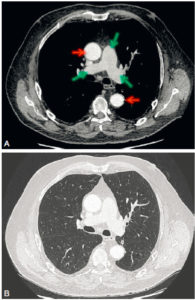
Coupes axiales d'une TDM thoracique, en fenêtre médiastinale (A) et en fenêtre parenchymateuse (B).
Le caractère injecté ou non de l'examen se détermine sur la fenêtre médiastinale. Ici, cette TDM est injectée, car il existe un rehaussement des vaisseaux (aorte, flèches rouges ; et artères pulmonaires, flèches vertes).
Pour l'analyse du médiastin, il est possible de mieux faire ressortir les structures vasculaires et tissulaires en injectant un produit de contraste iodé en intraveineux.
Les structures vasculaires et tissulaires médiastinales sont analysées après injection d'un produit de contraste iodé en intraveineux, avec possibilité de réaliser des acquisitions à différents temps (figure 25.9) :
- un temps sans injection, dit en « contraste spontané » : il est reconnu par l'aspect gris homogène des vaisseaux médiastinaux ;
- un temps artériel pulmonaire : il est reconnu par une opacification des artères pulmonaires qui apparaissent rehaussées et donc très blanches. C'est une angioTDM des artères pulmonaires, sur laquelle l'aorte n'est parfois pas encore opacifiée ;
- un temps artériel aortique : il est acquis un peu après le temps artériel pulmonaire, et est reconnu par une opacification très marquée de l'aorte thoracique. C'est une angioTDM aortique, sur laquelle les artères pulmonaires ne sont parfois déjà plus opacifiées ;
- un temps veineux : il est acquis entre 70 et 90 secondes après injection. Il sert à l'étude des lésions tissulaires comme les adénopathies, les tumeurs médiastinales, les collections pleurales, etc.
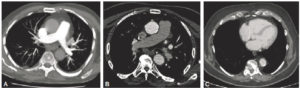
TDM thoraciques injectés, en coupe axiale et en fenêtre médiastinale.
A. L'artère pulmonaire et ses branches sont bien opacifiées (« blanches ») et l'aorte est encore grise ; il s'agit donc d'un temps artériel pulmonaire. B. L'aorte est bien opacifiée (« blanche ») et les artères pulmonaires ne sont plus aussi « blanches » qu'en (A) ; il s'agit d'un temps artériel aortique. C. Les cavités cardiaques droite et gauche sont opacifiées de manière homogène ; il s'agit d'un temps veineux (dit d'équilibre).
L'injection se réalise habituellement par une veine du membre supérieur, avec administration de 50 à 120 mL de produit de contraste iodé à un débit compris entre 1,5 et 5 mL/s. Pour le temps artériel, le déclenchement de l'acquisition se fait par méthode de suivi de l'embole (« bolus-tracking »), avec réalisation d'une coupe test au niveau de l'artère pulmonaire ou de l'aorte, permettant de déclencher l'acquisition au moment exact où ces vaisseaux sont parfaitement opacifiés.
Sémiologie élémentaire
Étude du médiastin
L'analyse des gros vaisseaux du médiastin nécessite une injection de produit de contraste.
On s'intéresse principalement à l'aorte thoracique (aorte ascendante, crosse aortique avec l'origine des troncs supra-aortiques et aorte thoracique descendante) et aux artères pulmonaires.
Pour chaque vaisseau, on analyse (voir figure 25.9) :
- la taille :
- aorte ascendante :
- normale < 45 mm de diamètre,
- si > 45 mm : anévrisme,
- artère pulmonaire :
- normale < 29 mm,
- si > 29 mm, forte suspicion d'hypertension pulmonaire.
- le contenu (figure 25.10) :
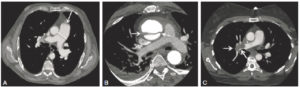
TDM thoraciques en coupe axiale et en fenêtre médiastinale, montrant différentes pathologies visibles grâce à l'injection de produit de contraste.
A. Artère pulmonaire augmentée de taille (flèche), avec un tronc mesurant 37 mm de diamètre, ce qui est un signe d'hypertension pulmonaire. B. Image hypodense linéaire au sein de l'aorte ascendante, correspondant à un flap intimal (flèches) : dissection aortique ascendante. Il existe un épanchement péricardique et pleural associé. C. Image hypodense de type défect endoluminal au sein de l'artère pulmonaire droite : une embolie pulmonaire aiguë (flèches).
- le contenu normal des vaisseaux opacifiés est homogène mais la densité est variable en fonction du temps d'injection, de la concentration et du débit d'injection du produit de contraste ;
- une image linéaire hypodense (gris sombre) au sein de l'aorte traduit un flap intimal (intima + média) de dissection aortique ;
- une image hypodense centrale au sein des artères pulmonaires est en rapport avec une embolie pulmonaire aigue.
La recherche de nœuds lymphatiques médiastinaux anormaux est facilitée par l'injection de produit de contraste, qui permet de mieux les différencier des vaisseaux. Ils sont principalement recherchés au niveau des hiles, autour de la trachée et à gauche de la crosse aortique (figure 25.11). La TDM thoracique peut aussi révéler des nœuds lymphatiques axillaires, supraclaviculaires ou jugulocarotidiens bas.
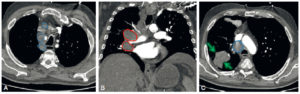
Patient de 56 ans suivi pour adénocarcinome pulmonaire.
TDM thoracique injectée en coupes axiales (A, C) et coronale (B), mettant en évidence de multiples adénomégalies médiastinales en latérotrachéal droit (A, C, ronds bleus) et en hilaire droit (B, ronds rouges) secondaires au cancer lobaire inférieur droit (C, flèches vertes).
Pour chaque nœud lymphatique décelé, on étudie :
- la taille : il est normal de voir des nœuds lymphatiques inférieurs à 10 mm de petit axe dans le médiastin et les hiles. Un nœud lymphatique dont le petit axe est supérieur à 10 mm est suspect : on parle d'adénomégalie. Plus le nœud lymphatique est de grande taille, plus le caractère pathologique est fort ;
- la morphologie : un nœud lymphatique rond, se rehaussant de manière importante ou contenant des plages hypodenses de nécrose est suspect ;
- la densité : la présence de calcifications est fréquente, témoignant soit de séquelles infectieuses (tuberculose), soit de maladies chroniques granulomateuses (sarcoïdose, silicose). Un centre graisseux est en faveur d'un nœud lymphatique bénin.
Un épanchement pleural ou péricardique se visualise facilement en TDM (figure 25.12).
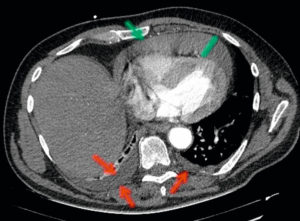
Patient de 74 ans avec syndrome inflammatoire.
TDM thoracique injectée en coupe axiale et en fenêtre médiastinale montrant un épanchement pleural bilatéral (flèches rouges) et un épanchement péricardique (flèche verte) de plus de 1 cm d'épaisseur, de forte abondance. Tous ces épanchements ont une densité faible (ils sont « gris foncé ») qui correspond à une densité liquidienne.
Son abondance peut être évaluée par la mesure de son épaisseur dans un plan horizontal ; un épanchement pleural de plus de 4 cm et un épanchement péricardique de plus de 1 cm peuvent être considérés comme abondants.
Devant tout épanchement pleural, il faut rechercher des nodules tissulaires accolés aux parois, reconnus à leur densité différente du liquide d'épanchement (figure 25.13). La constatation de tels nodules signe l'origine néoplasique de l'épanchement (soit lésion pleurale primitive type mésothéliome, soit métastase pleurale).
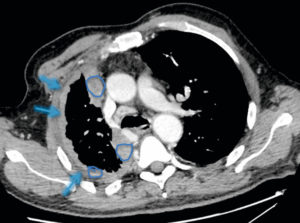
TDM thoracique injectée en coupe axiale du patient de la figure 25.6, montrant un épaississement pleural droit (flèches) dense constitué de plusieurs nodules tissulaires (ronds bleus) (a contrario des anomalies de densité liquidienne de la figure 25.12), différents d'un simple épanchement liquidien, en rapport avec un mésothéliome.
Étude du parenchyme
La condensation alvéolaire (figure 25.14) correspond à une plage de parenchyme pulmonaire dense (« blanche ») au sein de laquelle on parvient encore à distinguer des bronches normalement aérées, donc encore noires (signe du bronchogramme aérique).
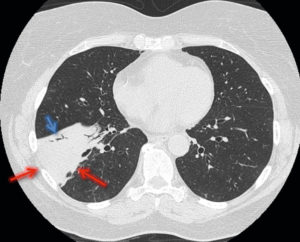
TDM thoracique en coupe axiale et en fenêtre parenchymateuse chez une patiente de 61 ans admise aux urgences pour dyspnée fébrile.
Mise en évidence d'une condensation alvéolaire bien systématisée lobaire inférieure droite (flèches rouges) avec bronchogramme aérique (flèche bleue), correspondant à une pneumopathie franche lobaire aiguë.
La condensation alvéolaire, lorsqu'elle est systématisée à un segment pulmonaire et associée à un syndrome infectieux clinique et biologique, correspond généralement à une pneumopathie infectieuse (bactérie, virus ou champignon). Mais de nombreuses autres causes sont responsables de condensations alvéolaires d'évolution aiguë : œdème pulmonaire cardiogénique ou non, pneumonie d'aspiration par fausse route, hémorragie pulmonaire, infarctus parenchymateux compliquant une embolie pulmonaire, pneumonie médicamenteuse. En présence d'une condensation alvéolaire d'évolution chronique, il faut éliminer un adénocarcinome pulmonaire à forme pneumonique ou un lymphome.
Un nodule pulmonaire correspond à une lésion tissulaire plus ou moins arrondie située au sein du parenchyme pulmonaire.
Devant un nodule pulmonaire, il faut analyser (figure 25.15) :
- sa taille : comme en radiographie, un nodule de moins de 5 mm est un micronodule ; un nodule de plus de 30 mm est appelé masse pulmonaire et est hautement suspect de lésion tumorale ;
- ses contours : réguliers ou spiculés ; l'aspect spiculé « en étoile » est également très suspect de tumeur ;
- sa densité, étudiée en fenêtre médiastinale : le nodule peut être de densité tissulaire, donc gris, prenant plus ou moins le contraste, ou être de densité graisseuse (donc noir), ou calcique (très blanc) ;
- le nombre et la localisation.
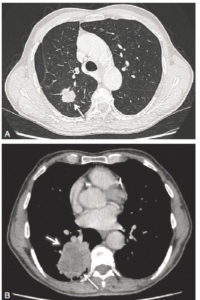
A. Patient de 69 ans, fumeur. TDM thoracique en coupe axiale et en fenêtre parenchymateuse montrant un nodule spiculé du lobe supérieur droit (flèche). Le caractère spiculé et la taille de ce nodule sont très évocateurs d'un cancer pulmonaire primitif. B. Patient de 79 ans, fumeur. TDM thoracique injectée en coupe axiale et en fenêtre médiastinale démontrant une masse de 7 cm du lobe inférieur droit, avec des contours irréguliers spiculés et un centre hypodense correspondant à de la nécrose (flèches). L'association d'une lésion de plus de 3 cm (masse), de contours irréguliers et d'un centre nécrotique est très évocatrice d'une néoplasie pulmonaire primitive. Cependant, cet aspect peut également être trouvé en présence d'un abcès pulmonaire.
Indications
La TDM thoracique utilise des rayons X, avec des doses qui sont nettement plus élevées que celles d'une radiographie du thorax : habituellement entre 5 et 100 fois plus qu'une radiographie thoracique selon le morphotype du patient. Ainsi, ses indications se doivent d'être parfaitement justifiées afin de limiter l'exposition des patients
Dans la recherche et/ou l'analyse d'anomalies parenchymateuses (pneumopathies infectieuses compliquées, nodules parenchymateux, pneumopathies interstitielles, recherche d'un pneumothorax, etc.), une TDM thoracique sans injection est suffisante.
Dans le bilan d'anomalies médiastinales, qu'elles soient tissulaires (recherche d'adénopathies médiastino-hilaires, bilan de tumeurs médiastinales, analyse d'épanchements chroniques ou cloisonnés) ou vasculaires (analyse des artères pulmonaires, analyse de l'aorte, bilan d'hémoptysies, etc.), une injection est nécessaire, avec un temps d'acquisition (artériel pulmonaire, artériel aortique ou veineux) adapté à la pathologie recherchée.
Scintigraphie pulmonaire de ventilation-perfusion
Technique
La scintigraphie pulmonaire permet de visualiser la distribution régionale des deux grands systèmes nécessaires à l'hématose : la perfusion et la ventilation pulmonaire.
L'étude de la perfusion se fait après injection dans une veine périphérique de macro-agrégats de sérum albumine marqués au 99mTc. Ces particules ont un diamètre de l'ordre de quelques dizaines de microns, supérieur au diamètre des capillaires pulmonaires. La fixation du traceur est donc mécanique, par blocage (embolisation) au niveau des précapillaires pulmonaires. Environ 1 capillaire sur 10 000 est obstrué ; l'examen ne présente donc pas de risque pour le patient.
L'étude de la ventilation se fait après inhalation d'un gaz radioactif (krypton 81mKr) ou d'aérosols (particules de carbone ou phytates) marqués avec du 99mTc, qui vont se déposer au niveau des parois bronchiques selon la ventilation régionale.
L'examen est réalisé à l'aide d'une gamma-caméra. Deux modes d'acquisition sont possibles : planaire (six incidences sont classiquement réalisées : antérieure, postérieure, deux incidences obliques postérieures et deux profils) ou tomographique, qui permet, comme pour une TDM, la reconstruction multiplanaire des images dans les trois plans de l'espace.
Sémiologie élémentaire
Dans une scintigraphie de perfusion normale, la distribution du radiotraceur est homogène sur l'ensemble du parenchyme pulmonaire. Les hiles et le médiastin ne sont pas hyperfixants (les macro-agrégats sont bloqués au niveau des précapillaires pulmonaires ; ils ne circulent plus). L'acquisition étant réalisée en décubitus dorsal, il existe fréquemment un gradient de fixation antéropostérieur du fait de la gravité.
Quand le flux sanguin est interrompu ou significativement altéré dans une région du poumon, celle-ci apparaît comme une zone hypofixante ou non fixante.
Ainsi, la scintigraphie de perfusion permet de visualiser la distribution régionale du flux sanguin artériel pulmonaire.
Dans une scintigraphie de ventilation normale, la distribution du radiotraceur est également homogène. Si un gaz radioactif est utilisé (81mKr), la trachée et les bronches proximales sont visualisées. Avec les aérosols, des foyers très hyperfixants sont parfois visualisés, correspondant à des impactions focales du radiotraceur au niveau des bifurcations bronchiques.
Comme pour les images de ventilation, une diminution ou l'absence de ventilation dans un territoire apparaît comme une zone hypofixante ou non fixante.
L'interprétation d'une scintigraphie pulmonaire de ventilation-perfusion repose sur une analyse comparative des images de ventilation et de perfusion.
Pour chaque hypofixation décelée, on précise :
- sa topographie (lobe, segment) ;
- sa taille : typiquement segmentaire ou sous-segmentaire ;
- l'intensité de l'hypofixation ;
- son aspect systématisé ou non. Pour qu'un défaut de perfusion soit évocateur d'une embolie pulmonaire, il doit être systématisé, c'est-à-dire triangulaire à base pleurale, correspondant anatomiquement à un territoire vasculaire (lobe, segment ou sous-segment) ;
- la concordance des anomalies perfusionnelles et ventilatoires.
Indications
L'indication principale de la scintigraphie pulmonaire de ventilation-perfusion est la recherche d'embolie pulmonaire (figure 25.16). L'embolie pulmonaire correspond à l'obstruction d'un ou de plusieurs vaisseaux artériels pulmonaires par un caillot de sang (thrombus). Celui-ci a le plus souvent migré depuis une veine des membres inférieurs atteinte par une phlébite, appelée aussi thrombose veineuse. Selon le niveau de l'obstruction et le diamètre du caillot, tout ou une partie du poumon est privé de sang. Cette obstruction se traduit en scintigraphie pulmonaire par une hypofixation systématisée sur les images de perfusion (absence de vascularisation en aval de l'embole), non retrouvée sur les images de ventilation (absence de conséquence sur la ventilation à la phase aiguë de l'embolie pulmonaire).
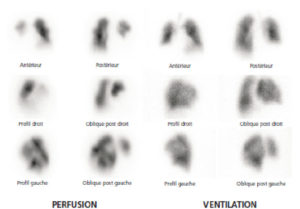
Patient de 68 ans adressé aux urgences pour dyspnée et douleur thoracique.
La scintigraphie de perfusion met en évidence de multiples hypofixations segmentaires et sous-segmentaires systématisées, bilatérales, non retrouvées sur les images de ventilation. L'examen est donc très évocateur d'une embolie pulmonaire récente.
L'examen peut également être utilisé pour évaluer la distribution régionale de la perfusion et de la ventilation pulmonaire, par exemple dans le cadre du bilan préopératoire d'un cancer pulmonaire.
TEP-TDM au 18F-FDG
Sémiologie élémentaire
De façon physiologique, les poumons, remplis d'air, apparaissent hypofixants. Le médiastin présente une hyperfixation modérée correspondant au FDG présent dans la circulation sanguine. Une hyperfixation du myocarde est fréquente et physiologique.
Lors de l'interprétation, on recherche des hyperfixations pathologiques sur les images TEP, les images TDM couplées permettant de préciser leur correspondance anatomique. Pour chaque hyperfixation, on précise son intensité, son caractère focal ou diffus, sa correspondance anatomique.
Indications
La TEP-TDM pulmonaire est indiquée pour caractériser les nodules pulmonaires de taille supérieure à 1 cm. Un nodule ne fixant pas le FDG (non hypermétabolique) peut être surveillé en tomodensitométrie. En revanche, un nodule hypermétabolique doit faire l'objet d'un contrôle histologique.
La TEP-TDM est également indiquée lors du bilan d'extension des cancers pulmonaires pour évaluer l'extension lymphatique et métastatique à distance de la maladie (figure 25.17). Elle permet de plus d'apprécier la réponse aux traitements antitumoraux et de détecter les récidives.
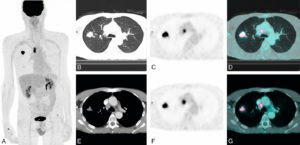
Patient de 65 ans, fumeur, adressé pour caractérisation et bilan d'extension d'une masse pulmonaire droite.
Images TDM (B et E), TEP-FDG (A, C et F) et TEP-FDG fusionnées à la TDM (D et G) montrant une hyperfixation très intense de la masse pulmonaire droite, confirmant son caractère très suspect. Il s'y associe une hyperfixation très intense d'une adénopathie latérotrachéale droite, faisant fortement suspecter une extension ganglionnaire médiastinale homolatérale. En revanche, absence d'hyperfixations évocatrices d'une atteinte ganglionnaire médiastinale controlatérale, viscérale ou osseuse.
La TEP-TDM au 18F-FDG présente aussi un intérêt pour le bilan de maladies inflammatoires (sarcoïdose par exemple) ou en pathologie infectieuse (infection de prothèse) (voir chapitre 19).
Essentiel à retenir
- La radiographie thoracique de face reste l'examen princeps en imagerie thoracique, même si ses performances en termes de sensibilité et de spécificité sont modestes. Elle doit répondre à des critères de qualité strictes afin d'être interprétable. Elle s'analyse de manière systématique.
- La TDM thoracique est l'examen de référence pour l'analyse du parenchyme (injection de produit de contraste non obligatoire) et du médiastin (injection de produit de contraste nécessaire). Elle s'analyse sur console de travail, de manière dynamique, en exploitant les possibilités de reconstructions et de modification du contraste. Elle est entre 5 et 100 fois plus exposante aux rayonnements ionisants qu'une radiographie thoracique de face.
- La scintigraphie pulmonaire permet la visualisation de la distribution régionale de la ventilation et de la perfusion pulmonaires. Sa principale indication est la suspicion d'embolie pulmonaire.
- La TEP-TDM au 18FDG est un examen essentiel en oncologie thoracique, notamment pour la caractérisation des nodules pulmonaires et le bilan d'extension des cancers pulmonaires.
Pour en savoir plus
- Lacey G, Morley S, Berman L. La radiographie thoracique. Manuel pratique. Traduction L. Arrivé. Paris: Elsevier Masson ; 2009.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 24 - Imagerie oto-rhino-laryngologique
S. Molière , S. Cahen-Riehm et R. Abgral
Plan du chapitre
- Introduction
- Imagerie de l'oreille et de l'os temporal
- Imagerie cervicofaciale non oncologique
- Imagerie morphologique des cancers des VADS
- Imagerie moléculaire des cancers des VADS : TEP au 18F-FDG
Objectifs
- Connaître les différentes modalités radiologiques utilisées en imagerie ORL.
- Savoir quelles modalités radiologiques utiliser pour explorer les différentes régions de la sphère ORL (os temporal, massif facial, cou).
- Connaître quelques éléments d'anatomie et de séméiologie normales en imagerie ORL.
- Connaître quelques éléments séméiologiques pathologiques en imagerie ORL.
- Connaître les principales indications de l'imagerie ORL.
Introduction
La sphère ORL correspond à trois régions anatomiques de l'extrémité céphalique :
- l'os temporal et son contenu auquel on associe les angles pontocérébelleux ;
- les sinus de la face et l'étage antérieur (os frontal et ethmoïde) et moyen (sphénoïde) de la base du crâne ;
- la filière oro-pharyngo-laryngée qui s'étend du nasopharynx (rhinopharynx) jusqu'à la traversée cervicothoracique et inclut l'ensemble des espaces cervicaux.
L'imagerie de la sphère ORL fait appel à différentes modalités d'imagerie, dont les indications et les performances varient selon la région et les pathologies explorées (échographie, TDM, cone beam computed tomography [CBCT], IRM, TEP au 18F-FDG).
Imagerie de l'oreille et de l'os temporal
Technique
L'étude de l'os temporal et de la base du crâne repose sur deux techniques complémentaires d'imagerie en coupes : la TDM et l'IRM.
La TDM du rocher, réalisée sans injection de produit de contraste, en filtre osseux avec des coupes très fines (épaisseur < 0,6 mm), permet une analyse fine de l'os temporal, de ses cavités et des osselets. Elle permet des reconstructions dans les trois plans de l'espace (figures 24.1 et 24.2) – le plan du canal semi-circulaire latéral est le plan axial de référence –, des reconstructions dans le plan des différents osselets et selon le V ossiculaire, formé par la branche longue de l'incus (enclume) et le stapes (étrier).
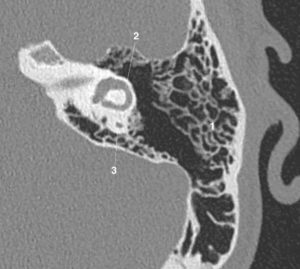
TDM d'un rocher normal en coupe axiale dans le plan de référence (plan du canal semi-circulaire latéral).
1. Cellules mastoïdiennes ; 2. labyrinthe osseux : canal semi-circulaire latéral ; 3. labyrinthe osseux : canal semi-circulaire postérieur.
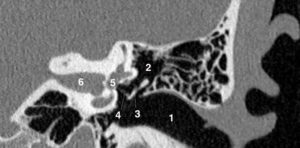
TDM d'un rocher normal en coupe coronale.
1. Méat acoustique externe ; 2. récessus épitympanique de la cavité tympanique ; 3. incus ; 4. incus (incus et stapes formant le « V ossiculaire ») ; 5. labyrinthe osseux : vestibule ; 6. méat acoustique interne.
L'IRM du rocher permet l'étude des cavités du rocher (asignal de la cavité tympanique normalement aérée, signal liquidien des cavités de l'oreille interne, signal variable de la mastoïde et de la pointe du rocher en fonction du degré de pneumatisation), du méat acoustique interne et des angles pontocérébelleux (figure 24.3). Elle inclut des séquences en pondération T1 avant et surtout après injection de gadolinium, des séquences tridimensionnelles à forte pondération T2 (dites « liquidiennes ») en haute résolution (épaisseur de coupe < 0,8 mm) et une séquence de diffusion.
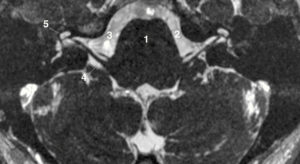
IRM de l'angle pontocérébelleux en séquence « liquidienne » haute résolution.
1. Pont ; 2. LCS de la citerne prépontique ; 3. nerf facial (VII) ; 4. nerf vestibulocochléaire (VIII) ; 5. liquide périlymphatique du tour basal de la cochlée.
Indications et éléments de séméiologie
Oreille externe et oreille moyenne
Ce sont des cavités aérées, dont les structures physiologiques (osselets) et pathologiques (comblements liquidien ou tissulaire) bénéficient d'un bon contraste spontané en TDM.
La TDM permet également l'étude des parois osseuses et des osselets grâce à une excellente résolution spatiale.
Les affections de l'oreille externe et de l'oreille moyenne sont généralement responsables d'une surdité de transmission. Nous distinguerons les pathologies aiguës et chroniques.
Pathologie aiguë
Une otite externe ou une otite moyenne aiguë ne justifient pas d'imagerie dans leur forme simple. En revanche, lorsqu'une complication endocrânienne d'une otite moyenne et/ou d'une mastoïdite est suspectée, la TDM ou, mieux, l'IRM permet de rechercher un abcès intracrânien, une thrombophlébite cérébrale, voire, sur l'IRM, des signes de méningite ou de labyrinthite (figure 24.4).
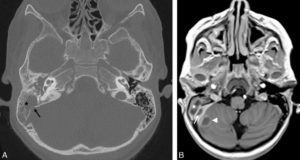
Céphalées fébriles chez un enfant de 5 ans : mastoïdite droite compliquée de thrombose du sinus latéral et d'abcès cérébelleux.
A. La TDM du rocher montre un comblement des cellules mastoïdiennes droites (étoile) et de la cavité tympanique associée à une lyse osseuse de la corticale postérieure du rocher (flèche). B. L'IRM en séquence pondérée T1 après injection de gadolinium montre le comblement des cellules mastoïdiennes (étoile) et les complications endocrâniennes : thrombus au sein du sinus veineux latéral droit sous forme d'un défaut de rehaussement au sein du sinus (flèche) et abcès cérébelleux droit sous forme d'une collection intra-axiale avec prise de contraste périphérique (tête de flèche).
La TDM et l'IRM permettent également de rechercher des signes d'ostéite dans le cadre d'une otite externe nécrosante (otite maligne externe), forme particulièrement grave d'otite externe survenant sur un terrain fragilisé (diabète, immunodépression, etc.).
La TEP au 18F-FDG peut apporter des informations complémentaires à l'imagerie morphologique pour le diagnostic d'ostéite (imagerie du métabolisme cellulaire).
Pathologie chronique
Devant une surdité de transmission associée ou non à un écoulement persistant, la TDM est l'examen d'imagerie de première intention. Cependant, elle n'est réalisée qu'après un examen ORL complet comprenant otoscopie et audiogramme ; l'aspect du tympan n'est pas correctement évaluable en TDM. L'examen clinique permet de différencier une surdité de transmission à tympan altéré (rétracté, perforé) d'une surdité de transmission à tympan normal.
Si, cliniquement, le tympan est anormal, on s'oriente le plus souvent vers une otite chronique, cholestéatomateuse (le tympan est le siège d'une perforation marginale et la cavité est colonisée par une masse de nature épidermique) ou non cholestéatomateuse (pas de perforation tympanique ou perforation non marginale, calcifications, etc.). La TDM permet de confirmer le diagnostic d'otite cholestéatomateuse ou d'otite non cholestéatomateuse (otite séromuqueuse, otite fibro-adhésive, tympanosclérose, etc.), et fait le bilan des destructions osseuses et ossiculaires avant un éventuel traitement chirurgical.
Si, cliniquement, le tympan est normal, la TDM permettra de rechercher une éventuelle malformation, des anomalies de la chaîne ossiculaire (malformations, traumatismes, etc.) ou une déminéralisation de l'os labyrinthique en avant de la platine du stapes dans le cadre d'une otospongiose.
L'IRM a des indications plus limitées dans l'exploration des cavités de l'oreille externe et moyenne (notamment bilan d'extension des processus tumoraux de voisinage). Elle est utile pour rechercher une récidive de cholestéatome après une chirurgie.
Oreille interne
L'oreille interne est incluse dans le labyrinthe osseux, dont les contours sont analysables à la TDM (voir figures 24.1 et 24.2).
La TDM est principalement indiquée pour analyser la morphologie du labyrinthe osseux : malformations, extension locale d'une tumeur, déminéralisation dans le cadre d'une otospongiose.
L'IRM permet d'analyser le contenu liquidien du labyrinthe (périlymphe et endolymphe), qui est en hypersignal en pondération T2, comme le LCS. Baignant dans ces milieux liquidiens, certaines structures neurosensorielles labyrinthiques et les nerfs du méat acoustique interne sont visibles en IRM (voir figure 24.3). Les voies auditives et vestibulaires du tronc cérébral et du cervelet sont également explorées en IRM.
L'IRM est l'examen de choix pour explorer des symptômes cochléovestibulaires (surdité de perception, acouphènes, vertiges) afin d'éliminer un neurinome du nerf vestibulocochléaire (VIII) (figure 24.5) et pour vérifier le signal des liquides de l'oreille interne (modifié en cas de labyrinthite). D'autres affections des voies auditives et vestibulaires, dans le cadre par exemple de maladies démyélinisantes, sont également recherchées.
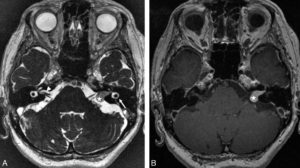
Surdité gauche révélant un schwannome (ou neurinome) du nerf vestibulocochléaire.
A. L'IRM des méats acoustiques internes en séquence pondérée T2 haute résolution permet de visualiser le « paquet » acousticofacial droit cheminant dans le méat acoustique interne et moulé par le LCS (tête de flèche), alors qu'à gauche le méat acoustique interne est comblé par une masse (étoile). Cette séquence permet aussi la visualisation des liquides de l'oreille interne, dont le signal est abaissé (plus gris) à gauche par le neurinome obstructif (flèche). B. Après injection de gadolinium sur une séquence pondérée T1, le schwannome se rehausse fortement (étoile).
Traumatismes du rocher
Les traits de fracture peuvent atteindre toutes les cavités de l'oreille.
La TDM des rochers est réalisée en complément de la TDM cérébrale en présence de signes d'alerte (otorragie, surdité, paralysie faciale) après un traumatisme crânien sévère. Elle permet de localiser le trait de fracture et de classifier les fractures selon leur trajet et les régions atteintes (une atteinte de l'oreille interne est de moins bon pronostic). Elle permet aussi de rechercher une luxation ossiculaire, une atteinte du ganglion géniculé du nerf facial ; en cas de paralysie faciale, une incarcération du nerf facial nécessite une décompression chirurgicale en urgence (figure 24.6).
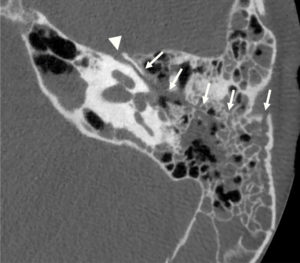
Fracture longitudinale du rocher gauche passant par la loge du ganglion géniculé avec paralysie faciale immédiate post-traumatique.
CBCT en coupes axiale du rocher gauche : trait de fracture (flèches) de l'écaille du temporal passant par le ganglion géniculé (tête de flèche).
La TDM est également indiquée devant un accès vertigineux survenant après un traumatisme, même mineur (gifle, effort de mouchage), pour rechercher une fistule périlymphatique.
Pathologie du nerf facial dans son trajet intrapétreux
Le trajet du nerf facial dans l'os temporal est composé de trois segments (labyrinthique, tympanique et mastoïdien). Il est analysable en TDM (qui visualise la paroi osseuse du canal facial) et en IRM. La paralysie faciale périphérique est le plus souvent idiopathique (a frigore) ; elle apparaît rapidement (en moins de 72 heures) et régresse spontanément dans les 3 mois. L'imagerie est indiquée si la paralysie faciale survient après un traumatisme ou si la présentation clinique est atypique (installation progressive ou association avec d'autres atteintes de nerfs crâniens, évolution défavorable), à la recherche d'une cause tumorale ou infectieuse.
Imagerie cervicofaciale non oncologique
Fosses nasales et sinus paranasaux
Les cavités sinusiennes de la face sont étudiées en première intention en CBCT avec un filtre osseux, incluant les apex des dents maxillaires (figure 24.7 et 24.8). Une sinusite aiguë simple ne nécessite pas d'imagerie : l'imagerie est envisagée en cas de dysfonctionnement nasonosinusien chronique (persistant plus de 3 mois) ou de complication d'une sinusite aiguë, parmi lesquelles notamment les complications orbitaires ou encéphaliques d'une ethmoïdite (figure 24.9).
TDM d'un massif facial normal en coupe coronale et en fenêtre osseuse.
1. Sinus maxillaire ; 2. méat moyen ; 3. cornet moyen ; 4. cornet inférieur ; 5. cellule ethmoïdale ; 6. orbite ; 7. gouttière olfactive (dans laquelle est localisé le bulbe olfactif).
TDM d'un massif facial normal en coupe axiale.
1. Cellule ethmoïdale ; 2. sinus sphénoïdal ; 3. lame papyracée ; 4. orbite.
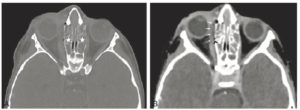
Ethmoïdite droite compliquée d'un abcès sous-périosté extraconal de l'orbite chez un enfant de 12 ans.
A. La TDM du massif facial en fenêtre osseuse met en évidence le comblement bilatéral des cellules ethmoïdales (étoiles). B. La TDM après injection en fenêtre tissus mous révèle une collection abcédée sous-périostée intra-orbitaire, mais extraconale (flèches) – c'est-à-dire située en dehors du cône musculaire de l'orbite – contenant une bulle de gaz (tête de flèche). À noter que la graisse orbitaire intraconale est légèrement infiltrée (plus blanche).
En cas d'obstruction nasale et/ou de sinusite chronique résistante à un traitement médical bien conduit (antibiotiques et corticoïdes) et après consultation ORL et endoscopie nasale, un CBCT est indiqué. Les principales causes sont la polypose nasosinusienne et la sinusite maxillaire « plus » avec obstruction du méat moyen par une pyocèle, un polype solitaire, un papillome inversé ou un aspergillome (moyen mnémotechnique « PPPA » pour Pyocèle, Polype solitaire, Papillome inversé, Aspergillome).
L'infection d'origine dentaire est la cause la plus fréquente de la sinusite antérieure ; elle doit être recherchée par CBCT dentosinusien (cone beam ou tomographie X à faisceau conique) en première intention (imagerie 7 fois moins irradiante et avec une meilleure définition que la TDM conventionnelle).
L'IRM de la face est un examen de seconde intention (pathologie infectieuse compliquée, mycotique ou tumorale des sinus de la face) dans le cadre des bilans d'extension et de la surveillance post-thérapeutique, en complément du CBCT ou de la TDM.
Traumatismes du massif facial
Les radiographies standard du massif facial ont une faible sensibilité et ne doivent plus être réalisées en cas de traumatisme, exception faite d'un traumatisme nasal isolé.
La TDM de l'ensemble du massif facial couvrant la mandibule permet une analyse fine, complète et en trois dimensions des fractures du massif facial.
Elle permet de classer les fractures selon la classification de Lefort et conforte le diagnostic de certaines urgences thérapeutiques : fracture du canal optique, du plancher de l'orbite avec incarcération musculaire (figure 24.10), complications endocrâniennes, brèche ostéoméningée.
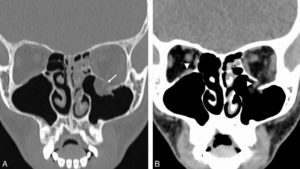
Traumatisme contondant de l'orbite avec déficit de l'élévation du regard : fracture du plancher de l'orbite gauche par enfoncement (blow-in), avec incarcération du muscle droit inférieur au sein du foyer fracturaire.
A. La TDM du massif facial en fenêtre osseuse met en évidence le trait de fracture du plancher de l'orbite (flèche). B. La fenêtre tissus mous met en évidence le muscle droit inférieur incarcéré dans le foyer de fracture à gauche, à comparer au côté droit normal (têtes de flèche).
Elle peut objectiver une fracture de la mandibule (les fractures ouvertes des portions dentées de la mandibule doivent être traitées en urgence) et/ou de l'articulation temporomandibulaire.
Des reconstructions dans les trois plans de l'espace et en rendu volumique permettent la planification chirurgicale.
Glandes salivaires
Les glandes salivaires sont explorées en échographie en première intention. En cas de tuméfaction d'une glande salivaire, l'échographie permet d'identifier s'il existe un calcul bloquant l'écoulement de la salive. Si l'obstacle n'est pas certain en échographie ou si une tumeur des glandes salivaires est suspectée, une IRM est réalisée. La séquence de sialo-IRM est une séquence à fort contraste liquidien, en haute résolution, montrant les canaux intraglandulaires normaux ou dilatés. Cette séquence est indiquée dans la pathologie obstructive ou inflammatoire comme une excellente alternative non invasive à la sialographie (opacification par cathétérisme des canaux salivaires). Les séquences morphologiques classiques (écho de spin T1, T2, post-gadolinium) et fonctionnelles (imagerie de perfusion et de diffusion) sont utiles au diagnostic de nature et d'extension des lésions tumorales salivaires.
La scintigraphie des glandes salivaires peut conforter le diagnostic d'hyposialie par analyse dynamique de sécrétion du médicament radiopharmaceutique (MRP).
Pathologie non tumorale des voies aérodigestives supérieures (VADS)
La filière viscérale pharyngolaryngée ainsi que les vaisseaux et nœuds lymphatiques du cou sont étudiés en TDM avec un filtre adapté aux parties molles.
Une TDM avec injection de produit de contraste est utile en cas de suspicion d'abcès cervical profond ou devant des signes de cellulite extensive. L'imagerie permet de rechercher le site de l'infection et ses limites anatomiques pour guider le drainage chirurgical.
En cas de cellulite cervicale extensive, une TDM thoracique complémentaire est indiquée pour rechercher une médiastinite associée (en raison d'une communication anatomique entre les espaces cervicaux rétropharyngés et le médiastin).
Thyroïde
La thyroïde est explorée par échographie en première intention, pour caractériser un nodule ou rechercher des signes de thyroïdite (voir chapitre 30).
Imagerie morphologique des cancers des VADS
Techniques
L'imagerie oncologique des VADS repose en première intention sur la TDM avec injection de produit de contraste. Certaines manœuvres sont utilisées pour sensibiliser l'examen, comme la phonation (étude de l'étage glottique, figure 24.11) ou la manœuvre de Valsalva, qui consiste à prendre une grande inspiration tout en se bouchant le nez et en fermant la bouche pour empêcher l'air de sortir et obtenir une augmentation de la pression dans les VADS (étude du laryngopharynx, figure 24.12).
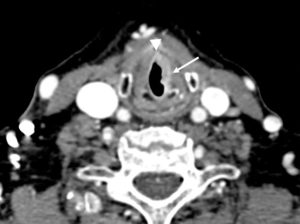
Carcinome de la corde vocale gauche.
TDM injectée en coupe axiale centrée sur l'étage glottique. Épaississement tumoral irrégulier rehaussé par le contraste de l'ensemble de la corde vocale gauche (flèche) avec extension à la commissure antérieure (tête de flèche).
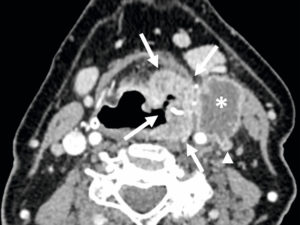
Carcinome épidermoïde du sinus piriforme gauche.
TDM injectée en coupe axiale centrée sur les sinus piriformes. Formation tumorale des parois du sinus piriforme gauche (flèches) rehaussée par le produit de contraste ; volumineuse adénopathie jugulocarotidienne homolatérale nécrotique en rupture capsulaire (étoile) englobant la veine jugulaire gauche thrombosée (tête de flèche).
L'étude de certaines régions anatomiques (cavité orale, oropharynx, nasopharynx) bénéficie particulièrement de l'excellente résolution en contraste de l'IRM (figure 24.13).
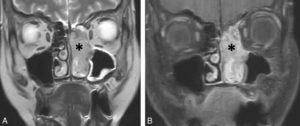
Adénocarcinome de l'ethmoïde gauche.
IRM en séquence coronales T2 (A) et T1 avec suppression de graisse après injection intraveineuse de gadolinium. B. Masse tumorale ethmoïdale gauche de signal tissulaire (étoiles) (hypo-intense T2 (A), globalement rehaussée après injection de gadolinium (B).
Indications
L'imagerie cervicofaciale par TDM et, éventuellement, par IRM permet de préciser l'extension locale d'une tumeur ORL (stade « T » de la classification tumour, node, metastasis [TNM]), de rechercher des contre-indications opératoires (envahissement circonférentiel de l'axe carotidien, envahissement osseux de la base du crâne ou intracrânien), d'évaluer l'extension lymphatique cervicale (figure 24.14).
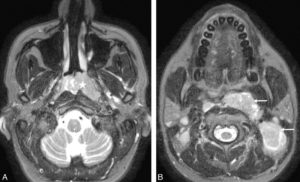
Bilan d'extension d'une tumeur du nasopharynx.
A. L'IRM à l'étage des fosses nasales montre une masse du nasopharynx (étoile) infiltrant à gauche les espaces parapharyngés et les muscles prévertébraux. B. À l'étage oropharyngé, on met en évidence de volumineuses adénopathies latérocervicales et rétropharyngées (flèches).
L'imagerie post-thérapeutique, réalisée entre 3 et 6 mois, permet la recherche d'un reliquat tumoral et sert de référence pour le suivi ultérieur. En cas de suspicion clinique de récidive, une TDM et/ou une IRM sont réalisées.
L'IRM de l'oropharynx et du nasopharynx est également indiquée, en complément de la TDM, dans le bilan d'une adénopathie cervicale sans primitif connu, à la recherche d'une petite lésion nasopharyngée, amygdalienne ou basilinguale. Dans le cadre des tumeurs du nasopharynx et des espaces profonds de la face, la TDM et l'IRM sont complémentaires. La fixité de ces régions, non soumises aux artefacts respiratoires, et l'excellente résolution en contraste et spatiale de l'IRM en font l'examen le plus adapté pour rechercher les extensions profondes et à la base du crâne.
Imagerie moléculaire des cancers des VADS : TEP au 18F-FDG
Généralités
La cellule de carcinome épidermoïde (95 % des cancers des VADS) est particulièrement hypermétabolique, ce qui fait de la TEP au 18F-FDG un examen de choix pour la caractérisation de ces tumeurs.
Une hyperfixation du traceur est pathologique lorsqu'elle est visuellement d'intensité supérieure à celle du bruit de fond physiologique et qu'elle n'est pas en rapport avec une cause de faux positif (inflammation post-thérapeutique, infection active intercurrente, etc.).
Sa localisation anatomique (étage des VADS, aire lymphatique, etc.), sa latéralité (gauche/droite), son caractère focal ou diffus doivent être spécifiés.
La quantification de l'intensité de fixation tumorale par la SUV (standard uptake value) peut être utile pour évaluer le pronostic initial de la maladie et sert de référence pour l'évaluation de la réponse au traitement.
Indications
Les indications actuelles de la TEP au 18F-FDG en pathologie cancéreuse sont consultables dans les « Recommandations de bonne pratique clinique pour l'utilisation de la TEP en cancérologie » proposées par la Société française de médecine nucléaire (SFMN) en 2018 sous le label HAS-INCa, disponibles en ligne (https://www.sfmn.org/).
Quelle que soit l'indication, les performances diagnostiques de l'examen sont améliorées en cas d'injection de produit de contraste iodé de l'examen TDM couplé.
Bilan d'extension
La TEP au 18F-FDG est recommandée dans le bilan d'extension des carcinomes épidermoïdes de stades avancés III, IV (T3-4, N1-3) pour rechercher des métastases à distance et peut être proposée, quel que soit le stade, pour la recherche d'une localisation synchrone (figure 24.15), en particulier pulmonaire et œsophagienne (facteurs de risque communs).
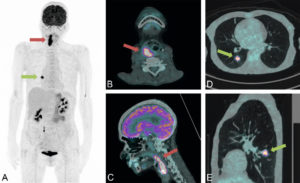
Bilan d'extension d'un carcinome épidermoïde du laryngopharynx droit.
Images TEP au 18F-FDG en reconstruction MIP (A) et fusionnées au TDM en coupes axiales (B en fenêtre tissus mous et D en fenêtre pulmonaire) et sagittales (C en fenêtre tissus mous et E en fenêtre pulmonaire). Hyperfixation très intense (SUVmax = 12,6) d'une lésion comblant le laryngopharynx droit et s'étendant localement à l'oropharynx sur 7 cm de hauteur (flèches rouges). Absence d'adénomégalies hyperfixantes associées suspectes. Hyperfixation intense (SUVmax = 9,4) d'un nodule pulmonaire centimétrique unique du segment apical du lobe inférieur droit (flèches vertes) sans adénopathie médiastino-hilaire associée. Conclusion : hypermétabolisme pathologique de la tumeur laryngopharyngée droite localement avancée. Absence d'arguments scintigraphiques en faveur d'une extension lymphatique cervicale. Foyer hypermétabolique significatif d'une opacité pulmonaire isolée du segment apical du lobe inférieur droit suggérant en premier lieu une tumeur synchrone.
Adénopathie métastatique sans porte d'entrée
La TEP au 18F-FDG est recommandée dans la recherche de tumeur primitive en cas d'adénopathie métastatique cervicale carcinomateuse sans cancer primitif connu (carcinoma of unknown primary [CUP]). Elle doit être réalisée de préférence avant les biopsies pharyngées exploratrices pour éviter le risque de faux positifs par inflammation et permet de détecter la tumeur primitive dans 30 à 50 % des cas selon les études.
Recherche de récidive et évaluation thérapeutique
La TEP au 18F-FDG est recommandée en cas de suspicion clinique de récidive et pour le bilan de stadification d'une récidive avérée.
Elle peut être proposée en fin de traitement pour l'évaluation thérapeutique à la recherche d'une maladie résiduelle avec un délai minimal de 3 mois à respecter.
Elle peut également être proposée dans la surveillance systématique pour la mise en évidence d'une récidive occulte, notamment dans un contexte de mauvais pronostic initial.
La valeur prédictive négative de l'examen est excellente (proche de 100 %) dans toutes ces indications.
Essentiel à retenir
- La modalité d'imagerie dépend de la structure anatomique étudiée : TDM en première intention pour l'oreille moyenne, TDM et IRM pour l'oreille interne, TDM ou cone beam en première intention pour le massif facial, TDM et, éventuellement, IRM pour les espaces viscéraux du cou.
- La majorité des atteintes inflammatoires aiguës de la sphère ORL ne requièrent pas d'imagerie, sauf devant une suspicion de complications (abcès, cellulite, complications neuro-ophtalmologiques), notamment dans les localisations anatomiques à risque (ethmoïdite, mastoïdite).
- La TDM est la modalité de choix en cas de traumatisme du massif facial ou du rocher.
- En oncologie ORL, l'imagerie morphologique repose en première intention sur la TDM cervicofaciale injectée, complétée par une TDM thoracique. L'IRM est utile dans certaines localisations anatomiques (oropharynx, nasopharynx) ou dans le cadre d'une adénopathie cervicale sans primitif.
- La TEP au 18F-FDG est recommandée dans le bilan d'extension des carcinomes des VADS pour rechercher des métastases à distance ou une localisation synchrone, dans le cadre d'une adénopathie cervicale métastatique sans porte d'entrée pour la recherche du site primitif ou en cas de récidive tumorale. Elle peut être proposée pour l'évaluation de fin de traitement ou dans la surveillance systématique.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 23 - Imagerie du système nerveux central
A. Chammas , S. Kremer et F. Le Jeune
Plan du chapitre
- Radioanatomie
- Techniques d'exploration neurologique en radiologie et en médecine nucléaire
- Sémiologie normale et éléments de sémiologie pathologique
- Séméiologie pathologique élémentaire en fonction des principaux syndromes
Objectifs
- Connaître les principales techniques d'imagerie utilisées dans l'exploration du système nerveux central.
- Savoir reconnaître les éléments d'anatomie radiologique cérébrale et médullaire.
- Connaître les éléments séméiologiques normaux en TDM et en IRM.
- Connaître les éléments séméiologiques pathologiques élémentaires (sang, œdème vasogénique autour d'une lésion tumorale, œdème cytotoxique en cas d'ischémie) en TDM et IRM.
- Connaître les mécanismes physiopathologiques explorés par la TEP et la scintigraphie dans les pathologies neurologiques.
- Connaître les principaux MRP et le déroulement des examens.
Radioanatomie
Les méthodes d'exploration du système nerveux central (SNC) en radiologie et en médecine nucléaire sont abordées dans ce chapitre. Elles sont morphologiques, mais également fonctionnelles et moléculaires. Les principales structures anatomiques à connaître en imagerie du SNC sont présentées dans les figures 23.1 à figure 23.11. Elles font l'objet d'une séméiologie spécifique dont les principes sont expliqués dans le chapitre.
Coupe sagittale médiane pondérée en T1 de l'encéphale.
Cerveau : 1. lobe frontal ; 2. lobe pariétal ; 3. lobe occipital ; 4. corps calleux. Tronc cérébral : 5. pédoncules cérébraux ; 6. pont ; 7. moelle allongée ; 8. moelle spinale ; 9. vermis cérébelleux ; 10. 3e ventricule ; 11. 4e ventricule ; 12. hypophyse. Tirets : extrémité du sillon central à la face interne du cerveau séparant le lobe frontal du lobe pariétal. La figure de gauche permet de repérer la position de la coupe sagittale sur une coupe axiale T2.
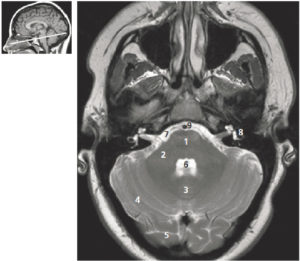
Coupe axiale pondérée en T2 de la fosse postérieure.
1. Pont ; 2. pédoncule cérébelleux ; 3. vermis cérébelleux ; 4. hémisphère cérébelleux ; 5. lobe occipital ; 6. 4e ventricule ; 7. espace sous-arachnoïdien de la base du crâne (ou citernes de la base) ; 8. oreille interne ; 9. artère basilaire. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T1.
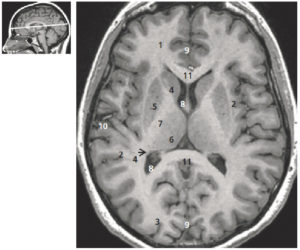
Coupe axiale du cerveau pondérée en T1 avec injection de gadolinium (coupe de Flechsig).
1. Lobe frontal ; 2. lobe pariétal ; 3. lobe occipital. Ganglions de la base du crâne (noyaux gris centraux) : 4. noyau caudé ; 5. noyau lenticulaire ; 6. thalamus ; 7. capsule interne ; 8. ventricule latéral ; 9. scissure interhémisphérique ; 10. scissure frontopariétale (de Sylvius) ; 11. corps calleux. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T1.
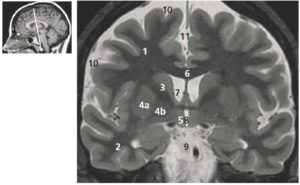
Coupe coronale (ou frontale) pondérée en T2 du cerveau (coupe de Charcot).
1. Lobe frontal ; 2. lobe temporal ; 3. noyau caudé ; 4. noyau lenticulaire (a : putamen, b : pallidum) ; 5. thalamus ; 6. corps calleux ; 7. ventricule latéral ; 8. 3e ventricule ; 9. espace sous-arachnoïdien de la base du crâne (citernes) ; 10. espaces sous-arachnoïdiens péricérébraux ; 11. scissure interhémisphérique. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T1.
Vue latérale de l'hémisphère gauche : le sillon central sépare le lobe frontal en avant du lobe pariétal en arrière.
Le cortex moteur primaire est situé en avant du sillon central (gyrus précentral). Les aires de Broca (gyrus frontal inférieur) et de Wernicke (gyrus temporal supérieur) sont situées dans l'hémisphère gauche.
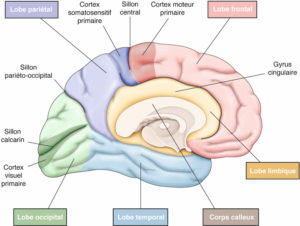
Vue médiale de l'hémisphère gauche.
Dessin : Cyrille Martinet.
Angio-IRM par temps de vol (sans injection de produit de contraste) des artères de l'encéphale, reconstructions par projection des pixels d'intensité maximale.
Vues supérieure (A) et antérieure (B). 1. Artère carotide interne ; 2. artère vertébrale ; 3. artère basilaire ; 4. artère cérébrale moyenne (sylvienne) ; 5. artère cérébrale antérieure ; 6. artère cérébrale postérieure. Les pointillés entourent le cercle artériel du cerveau (polygone de Willis)
Angio-IRM par temps de vol (sans injection de produit de contraste) des veines de l'encéphale, reconstructions par projection des pixels d'intensité maximale.
Vues latérale (A) et supérieure (B). 1. Veine corticale ; 2. sinus sagittal (longitudinal) supérieur ; 3. sinus droit ; 4. sinus transverse (ou latéral) ; 5. sinus sigmoïde ; 6. veine jugulaire interne ; 7. torcular.
Coupes coronale pondérée en T2 (A), sagittale médiane pondérée en T1 (B) et coronale pondérée en T1 après injection de gadolinium (C) de l'hypophyse.
1. Hypophyse (a : lobe antérieur, b : lobe postérieur) ; 2. infundibulum (tige) hypophysaire ; 3. selle turcique ; 4. hypothalamus ; 5. 3e ventricule ; 6. sinus caverneux ; 7. carotide interne ; 8. chiasma optique (II) ; 9. sinus sphénoïdal ; 10. lobe temporal. La figure de gauche permet de repérer la position de la coupe coronale sur une coupe sagittale T1.
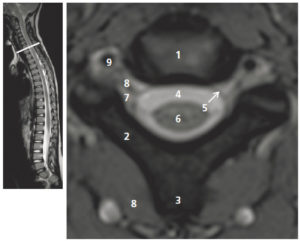
Coupe axiale pondérée en T2 de la colonne cervicale par le disque intervertébral C7-T1.
1. Disque intervertébral C7-T1 ; 2. lame ; 3. processus épineux ; 4. LCS ; 5. dure-mère ; 6. moelle spinale ; 7. foramen intervertébral ; 8. nerf spinal C8 ; 9. artère vertébrale. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T2.
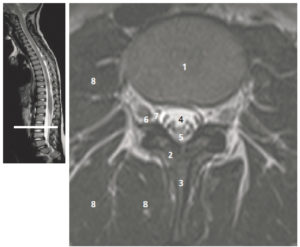
Coupe axiale pondérée en T2 de la colonne lombaire en L3.
1. Corps vertébral de L3 ; 2. lame ; 3. processus épineux ; 4. LCS ; 5. racines de la queue de cheval ; 6. nerf spinal L3 ; 7. foramen intervertébral L3-L4 ; 8. muscles rétrovertébraux. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T2.
Techniques d'exploration neurologique en radiologie et en médecine nucléaire
Explorations neurologiques en radiologie
La neuroradiologie étudie les affections des systèmes nerveux central (SNC) et périphérique (SNP). En fonction des habitudes locales, l'imagerie oto-rhino-laryngologique (ORL) (voir chapitre 24) est réalisée en neuroradiologie, ou en radiologie générale. La neuroradiologie se partage entre la neuroradiologie diagnostique et la neuroradiologie interventionnelle.
Neuroradiologie diagnostique
La neuroradiologie diagnostique est fondée sur l'imagerie en coupes par TDM, ou par IRM.
La TDM est un examen facilement accessible, car de nombreux services d'urgences médicales et chirurgicales sont adossés en France à un service d'imagerie équipé d'une TDM. L'acquisition en TDM est rapide, réalisée en moins de 30 secondes pour l'exploration de l'encéphale ou du rachis. La TDM utilise les rayonnements ionisants et sa résolution en contraste est relativement faible. Son principal avantage est de permettre à la fois l'étude des structures osseuses de la voûte et de la base du crâne, des structures parenchymateuses intracérébrales et des espaces péricérébraux. La TDM a également l'avantage d'étudier les lésions thoraciques et abdominopelviennes dans le même temps d'examen en cas de polytraumatisme.
Ses principales indications sont donc les urgences traumatiques, mais également l'étude des structures osseuses (crâne, rachis).
L'IRM est plus difficile à mettre en œuvre, principalement en raison de son accès limité. En effet, en France, le nombre de machines d'IRM installées est nettement inférieur à celui des TDM. La durée d'examen est plus longue qu'en TDM (environ 20 minutes pour une IRM cérébrale). C'est un examen non irradiant et sa résolution en contraste est élevée.
Ses principales indications sont les affections médicales neurologiques, les suspicions de compression médullaire et les bilans préthérapeutiques des tumeurs cérébrales.
Neuroradiologie interventionnelle
La neuroradiologie interventionnelle (ou thérapeutique) comporte le traitement endovasculaire des malformations vasculaires (malformations artérioveineuses, anévrismes) en angiographie conventionnelle (voir chapitre 15) et le traitement de certaines affections rachidiennes comme les tassements vertébraux sous contrôle TDM ou en radiologie conventionnelle.
L'angiographie par cathétérisme est un examen invasif qui nécessite la ponction d'une artère périphérique (fémorale ou humérale) et expose aux rayonnements ionisants. Les rayons X permettent de suivre la progression du cathéter (radio-opaque) lors de la navigation endovasculaire et de visualiser les lésions vasculaires à traiter. Pour cela, on injecte par le cathéter en intra-artériel un produit de contraste iodé. L'angiographie par cathétérisme n'est pratiquement plus utilisée pour le diagnostic, car elle a été remplacée par les techniques d'imagerie en coupes (angio-TDM, angio-IRM). Elle est donc quasi exclusivement utilisée en neuroradiologie interventionnelle.
La neuroradiologie interventionnelle partage avec la neurochirurgie les indications de traitement des malformations vasculaires, en particulier les anévrismes (figure 23.12).
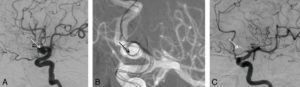
Angiographie conventionnelle par cathétérisme : opacification de l'artère carotide par injection d'iode montrant un anévrisme de l'artère cérébrale antérieure gauche.
A. Mise en évidence de l'anévrisme avant embolisation (flèche blanche). B. Pendant la mise en place par voie endovasculaire des coils au sein de l'anévrisme (flèche noire). C. Après embolisation, seul le paquet de coils est visible, l'anévrisme n'est plus opacifié par l'injection d'iode ; il est donc exclu de la circulation artérielle (flèche blanche).
Explorations neurologiques en médecine nucléaire
L'étude scintigraphique des pathologies neurologiques bénéficie des explorations par tomoscintigraphie (TEMP) ou par TEP ; les deux examens sont couplés à une TDM. Il s'agit d'une imagerie fondée sur des acquisitions volumiques qui permettent d'avoir un reflet de la distribution d'un radiopharmaceutique (MRP) en 3D dans le cerveau et de reconstruire des coupes dans tous les plans de l'espace. Les premières utilisent des MRP émetteurs gamma comme le 99mTc ou l'iode 123, et les secondes des MRP émetteurs de positons comme le 18FDG. Selon le MRP injecté, on obtiendra des informations fonctionnelles (perfusion, métabolisme, etc.) ou moléculaires (expression d'un récepteur ou d'un transporteur, etc.) sur le cerveau. Ces informations sont le plus souvent complémentaires des informations obtenues avec la TDM, et plus encore l'IRM. Dans de nombreuses maladies, l'étude combinée des deux examens est nécessaire au bilan et seule la fusion des images de médecine nucléaire et d'IRM permet d'avancer dans le diagnostic. Cette approche « multimodale » est particulièrement importante pour les explorations neurologiques et elle s'intègre dans le cadre d'un bilan multidisciplinaire.
Mécanismes physiopathologiques explorés par la TEP et la scintigraphie dans les maladies neurologiques
Il existe plusieurs MRP disponibles en routine dans les services de médecine nucléaire qui permettent d'explorer différents mécanismes physiopathologiques au niveau cérébral :
- la perfusion cérébrale globale (débit sanguin cérébral) ;
- le métabolisme glucidique ;
- le versant présynaptique de la synapse dopaminergique ;
- le dépôt des plaques amyloïdes.
Les MRP utilisés pour l'étude de ces mécanismes traversent la barrière hémato-encéphalique normale, contrairement aux produits de contraste dont le passage est le reflet de la rupture de cette barrière.
Principaux MRP et déroulement des examens
Étude de la perfusion et du métabolisme glucidique
Le débit sanguin cérébral et la consommation de glucose sont corrélés à l'activité neuronale. L'imagerie de perfusion ou du métabolisme permet donc de détecter des modifications fonctionnelles locales dues à une perte synaptique ou à un dysfonctionnement synaptique. Le métabolisme neuronal et le débit sanguin sont étroitement couplés dans le temps et dans l'espace dans les maladies neurodégénératives. Le débit sanguin cérébral local est le reflet de la demande énergétique locale et donc de la densité de neurones présents. Il existe ainsi ce qu'on appelle un couplage métabolique-perfusionnel et les deux examens mettent en évidence des anomalies identiques.
La perfusion cérébrale est étudiée après injection intraveineuse d'un MRP marqué au 99mTc comme l'HMPAO, une petite molécule lipophile diffusant facilement à travers la barrière hémato-encéphalique, piégée au niveau cérébral après avoir été transformée en molécule hydrophile. Son avantage majeur est qu'elle reflète la perfusion cérébrale au moment de l'injection puisque sa captation débute 10 à 15 secondes après l'injection. Il n'y a pas de contrainte à la réalisation de cet examen ; le patient ne doit pas être à jeun et peut avoir pris ses médicaments. Un repos neurosensoriel est nécessaire pendant 15 à 30 minutes avant l'injection.
L'acquisition tomoscintigraphique débute environ 20 à 30 minutes après l'injection et dure environ 20 minutes.
L'étude du métabolisme cérébral se fait en TEP après injection de 18F-FDG. La TEP au 18F-FDG permet d'étudier la consommation importante de glucose par le cerveau normal. Après un repos neurosensoriel de 15 minutes, l'injection du traceur se fait par voie intraveineuse et l'acquisition débute environ 30 minutes après l'injection, quand le plateau de fixation est atteint. La durée d'acquisition est de 10 à 20 minutes selon les protocoles.
Étude de la neurotransmission dopaminergique présynaptique
La synapse est constituée de trois parties : un versant présynaptique, la fente synaptique et le versant postsynaptique.
La dopamine est un neurotransmetteur appartenant à la famille des catécholamines. Au niveau cérébral, la dopamine joue un rôle important et complexe, et intervient dans diverses fonctions telles que les fonctions motrices, la cognition, la motivation, les phénomènes de récompense, la mémoire et le sommeil. En imagerie métabolique, c'est surtout sa fonction motrice que l'on va étudier.
La synapse dopaminergique a été très étudiée en médecine nucléaire avec le développement de nombreux MRP au niveau pré- ou postsynaptique dont deux permettent aujourd'hui d'étudier le versant présynaptique : le FP-CIT marqué à l'iode 123 (DatSCAN®) en scintigraphie et la fluorodopa (18F-DOPA) en TEP. Le versant postsynaptique n'est pas étudié en routine.
Le DatSCAN® est un substrat du transporteur présynaptique de la dopamine. L'acquisition débute généralement 3 à 6 heures après l'injection et dure environ 30 minutes. Il n'est pas nécessaire d'arrêter les traitements antiparkinsoniens, agonistes ou antagonistes, puisque ceux-ci agissent au niveau postsynaptique.
La 18F-DOPA est un marqueur de la synthèse de la dopamine et donc également un traceur du versant présynaptique de la synapse dopaminergique. Il est nécessaire d'arrêter les traitements antiparkinsoniens 12 heures avant l'examen. Les acquisitions débutent 90 minutes après l'injection et durent entre 10 et 20 minutes.
Sémiologie normale et éléments de sémiologie pathologique
TDM cérébrale
La substance blanche paraît moins dense (ou plus noire) que la substance grise (cortex et noyaux gris centraux). Le liquide cérébrospinal (LCS) paraît hypodense, alors que les structures osseuses (crâne, rachis) sont hyperdenses (figure 23.13).
TDM cérébrale sans (A, C) et après injection (B, D) : la substance blanche (croix blanche) est moins dense que la substance grise intrathalamique (croix noire).
Le LCS (flèche blanche) est hypodense. Après injection, les vaisseaux et les plexus choroïdes sont plus hyperdenses que sur la TDM sans injection (têtes de flèche noires). La graisse intra-orbitaire est hypodense (triangles blancs). L'air au sein des cellules ethmoïdales est hypodense (têtes de flèche blanches).
L'eau, l'air et la graisse sont hypodenses (figure 23.14) ; les calcifications et le sang frais sont hyperdenses (figure 23.15).
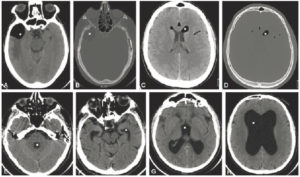
TDM cérébrale sans injection : hypodensités (étoiles).
A, B. Tumeur graisseuse extra-axiale temporale droite (méningiome lipomateux) (graisse). C, D. Pneumencéphalie suite à une fracture de la base du crâne (air). E-H. Hydrocéphalie à pression normale responsable d'une dilatation ventriculaire (liquide).
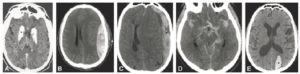
TDM cérébrales sans injection : hyperdensités spontanées intracrâniennes (croix noires).
A. Calcifications des ganglions de la base du crâne. B. Hématome extradural. C. Hématome sous-dural aigu. D. Hémorragie sous-arachnoïdienne. E. Hématome intraparenchymateux.
Après une acquisition sans injection, une injection intraveineuse de produit de contraste iodé peut être réalisée afin de rechercher des anomalies de rehaussement des vaisseaux ou des prises de contraste tissulaires (méninges, tumeur). Lorsqu'une structure est rehaussée, cela se traduit par une augmentation de la densité (ou hyperdensité) par rapport à la TDM réalisée sans injection. En pratique, on reconnaît le caractère injecté de la TDM par l'augmentation de la densité au sein des artères et des veines ainsi que des plexus choroïdes par rapport à la TDM sans injection (voir figure 23.13).
IRM cérébrale
Les séquences pondérées en T1 sont dites anatomiques. La substance blanche apparaît en hypersignal (plus blanche) que la substance grise, alors que la substance grise (cortex et ganglions de la base) apparaît en hyposignal. Le LCS est en hyposignal (figure 23.16).
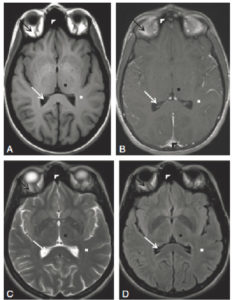
IRM cérébrale en pondération T1 (A), T1 après injection de gadolinium (B), T2 (C), et FLAIR (D).
La substance blanche est en hypersignal T1 en hyposignal T2 et FLAIR (croix blanche). La substance grise thalamique est en hyposignal T1, en hypersignal T2 et FLAIR (croix noire). Le LCS intraventriculaire est en hyposignal T1, en hypersignal T2 et en hyposignal FLAIR (flèche blanche). La graisse intraorbitaire est en hypersignal T1, T2 et FLAIR (flèche noire). L'air est en hyposignal T1, T2 et FLAIR (tête de flèche blanche). Après injection de gadolinium, les structures vasculaires apparaissent plus hyperintenses qu'avant injection (tête de flèche noire).
Si l'on cherche une prise de contraste (au niveau des méninges, d'une tumeur bénigne ou maligne, ou d'une lésion inflammatoire), on réalise une séquence en pondération T1 après injection intraveineuse de gadolinium. Les prises de contraste vont se traduire par une augmentation de l'intensité du signal (plus blanche) par rapport au T1 réalisé sans injection. Comme en TDM, on reconnaît le caractère injecté d'une image pondérée en T1 par l'augmentation du signal au sein des artères et des veines du fait de la présence intraveineuse de gadolinium (voir figure 23.16). Il est important de noter que le tissu cérébral normal n'est pas rehaussé après injection de produit de contraste car ce dernier ne traverse pas la barrière hémato-encéphalique quand celle-ci est normale.
Pour visualiser les vaisseaux, il n'est pas toujours nécessaire d'injecter du produit de contraste, contrairement à la TDM. En effet, les séquences angiographiques sans injection (ou acquisitions par temps de vol ou TOF pour Time Of Flight) permettent de reconstruire les vaisseaux en analysant les flux en leur sein. Elles sont le plus souvent suffisantes pour analyser les artères du cercle artériel du cerveau (ou polygone de Willis) et les sinus veineux cérébraux. Le T2 est presque l'inverse d'un T1 : la substance blanche est en hyposignal par rapport à la substance grise (cortex et ganglions de la base ou noyaux gris centraux) et le LCS est en hypersignal (voir figure 23.16). La graisse est en hypersignal en T1 et de signal variable en T2, et l'air et l'os sont noirs en T1 comme en T2.
La séquence FLAIR est une séquence pondérée en T2 sur laquelle le signal des liquides a été annulé. Comme sur une séquence T2, la substance blanche est toujours en hyposignal par rapport à la grise alors que la substance grise (cortex et noyaux gris centraux) paraît plus en hypersignal que la substance blanche. Le LCS apparaît en hyposignal (voir figure 23.16).
Une structure anormale en IRM est décrite selon la terminologie suivante : une structure en hyposignal ou hypo-intensité est de signal ou d'intensité inférieur(e) au parenchyme cérébral normal. Une structure en hypersignal ou hyperintensité est de signal ou d'intensité supérieur(e) au parenchyme cérébral normal. Une structure en isosignal ou iso-intensité est de signal ou d'intensité similaire au parenchyme cérébral normal.
En cas d'hématome, le signal du sang varie en fonction du degré de dégradation de l'hémoglobine (figure 23.17) (voir chapitre 21).
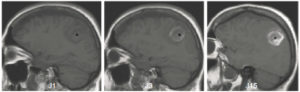
IRM cérébrales en pondération T1 sans injection : évolution du signal au cours du temps d'un hématome intraparenchymateux (croix noire) de l'isosignal vers l'hypersignal de J1 à J15.
IRM hypophysaire
L'hypophyse est explorée uniquement en IRM et par des coupes fines en T1 avant et après injection de gadolinium et en T2 (voir figure 23.9).
L'antéhypophyse est en isosignal T1 et T2 alors que la posthypophyse présente généralement un hypersignal T1 spontané lié au stockage de l'hormone antidiurétique.
Après injection de produit de contraste, l'antéhypophyse saine se rehausse de manière homogène du fait de l'absence de barrière hémato-encéphalique, ce qui permet le passage interstitiel du produit de contraste.
IRM médullaire
La moelle spinale, de petit diamètre, est uniquement explorée en IRM qui offre un meilleur contraste que la TDM (voir figure 23.10). La moelle spinale présente le même signal que le cerveau. En revanche, la substance grise est centrale et prend une forme de H, alors que la substance blanche est périphérique.
Médecine nucléaire
En scintigraphie de perfusion ou en TEP au 18F-FDG, une image normale est caractérisée par une fixation homogène et symétrique du MRP sur l'ensemble du cortex et des ganglions de la base (figure 23.18A). Les images anormales mettent en évidence une hypoperfusion ou un hypométabolisme dans les régions où il existe un dysfonctionnement neuronal ou une perte neuronale (figure 23.18B).
TEP au 18F-FDG.
A. Images normales : la fixation du traceur est intense et homogène, symétrique sur l'ensemble du parenchyme cortical et sous-cortical, apparaissant en rouge uniforme sur cette échelle de couleur communément utilisée. B. Images anormales : la fixation du traceur est diminuée sur l'ensemble du cortex (aspect en jaune) avec des régions cérébrales où l'examen met en évidence un hypométabolisme (aspect en vert) temporopariétal bilatéral et frontal droit. En fonction du contexte, cet aspect peut se rencontrer dans la démence de type Alzheimer. Attention, cet examen rentre dans le cadre d'un bilan spécialisé multidisciplinaire. Il faut toujours interpréter un examen d'imagerie métabolique de façon complémentaire aux données cliniques, neuropsychologiques et d'IRM.
En DatSCAN® ou 18F-DOPA, les images normales montrent une fixation homogène du striatum (noyaux caudés et putamens), sous forme de deux aires symétriques en forme de croissant d'égale intensité (figure 23.19A).
Coupes axiales de TEP à la 18F-DOPA.
A. Image normale : la fixation du traceur s'effectue au niveau des striatum, structures profondes sous-corticales ; la fixation est homogène et symétrique en avant sur les noyaux caudés et en arrière sur les putamens. B. Image anormale : la fixation est diminuée au niveau du putamen gauche avec un aspect aminci et jaune sur l'échelle de couleur utilisée. Le patient présente donc une dénervation dopaminergique présynaptique du putamen gauche en rapport avec un syndrome parkinsonien clinique à droite.
Séméiologie pathologique élémentaire en fonction des principaux syndromes
Tumeurs cérébrales
Une tumeur cérébrale (figure 23.20), du fait de l'augmentation de l'eau libre comme dans les métastases, paraît généralement hypodense en TDM et en hyposignal T1, en hypersignal T2 et FLAIR en IRM. La présence d'une néoangiogenèse et celle d'une rupture de la barrière hémato-encéphalique sont identifiées par une prise de contraste. Les tumeurs très cellulaires (par exemple le lymphome) restreignent la diffusion de l'eau libre ; elles sont en hypersignal en séquence de diffusion et en hyposignal sur la cartographie d'ADC. Les lésions tumorales cérébrales sont souvent entourées d'un œdème vasogénique apparaissant hypodense en TDM, en hyposignal T1, et en hypersignal T2 et FLAIR en IRM. Cet œdème est en plage, mal limité, et atteint préférentiellement la substance blanche, contrairement à l'œdème ischémique, cytotoxique.
TDM cérébrale sans (A) et avec injection (B) ; IRM cérébrale en T1 sans injection (C), en T2 (D), en FLAIR (E) et T1 après injection de gadolinium (F).
Lésion tumorale intraparenchymateuse (croix noire), hypodense en TDM (A), en hyposignal T1 (C), en hypersignal T2 (D) et FLAIR (E), et rehaussée en périphérie après injection en TDM (B) et en IRM (F). La lésion est entourée d'œdème vasogénique (croix blanche) hypodense en TDM, en hyposignal T1 et en hypersignal T2 et FLAIR en IRM.
Comme les tumeurs cérébrales surexpriment généralement les transporteurs du glucose, la TEP au 18F-FDG peut également être utilisée dans certaines indications des bilans de tumeurs cérébrales, en particulier la recherche de récidive d'une tumeur de haut grade. Dans ce cas, il existe en TEP au 18F-FDG un hypermétabolisme intense lié à l'augmentation de la captation du glucose par les cellules tumorales (mécanisme différent de celui des pathologies neurodégénératives) (figure 23.21).
Coupes transversale, sagittale et coronale de TEP au 18F-FDG fusionnée avec l'IRM dans le cadre d'une suspicion de récidive d'un glioblastome occipital gauche, opéré il y a 10 mois.
Foyer hypermétabolique anormal à la partie postéro-inférieure de la prise de contraste en IRM compatible avec une récidive de haut grade comme la tumeur initiale.
La lésion tumorale et l'œdème qui l'entoure occupent de l'espace au sein du parenchyme cérébral, dans le volume non extensible qu'est la boîte crânienne. La lésion et l'œdème sont responsables d'un effet de masse, c'est-à-dire un refoulement des structures anatomiques adjacentes. Cet effet de masse peut aboutir à un engagement (figure 23.22), c'est-à-dire le refoulement de structures cérébrales à travers des orifices intracrâniens physiologiques généralement délimités par la dure-mère. On peut ainsi distinguer l'engagement sous-falcoriel, qui correspond au passage des structures de la ligne médiane sous la faux du cerveau, l'engagement temporal qui correspond à une hernie des structures temporales internes entre la tente du cervelet et le tronc cérébral, et l'engagement amygdalien qui correspond au passage des amygdales cérébelleuses au travers du foramen magnum (figures 23.23 et 23.24).
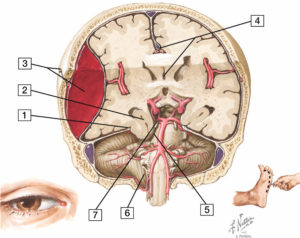
Différents types d'engagement cérébral dans un contexte d'hématome extradural temporo-pariétal droit.
1. Tente du cervelet ; 2. engagement temporal ; 3. fracture temporopariétale droite et hématome extradural droit ; 4. déviation de la faux du cerveau vers la gauche et engagement sous-falcoriel avec déviation du 3e ventricule ; 5. compression du pédoncule cérébral droit se traduisant par une hémiparésie gauche ; 6. engagement de l'amygdale cérébelleuse droite ; 7. compression du 3e nerf crânien se traduisant par un ptosis, un strabisme divergent et une mydriase homolatérale.
Source : Felten DL. Netter's Neuroscience Flash Cards. Fourth Edition. Elsevier ; 2015.
IRM cérébrale en coupe sagittale T1 sans injection (A) et coupe coronale T1 après injection de gadolinium.
Volumineuse lésion kystique cérébelleuse droite avec nodule mural prenant le contraste (astrocytome pilocytique) (croix blanche). Important effet de masse avec engagement bilatéral des amygdales cérébelleuses dans le foramen magnum (flèche blanche).
IRM cérébrale en coupe coronale en T1 (A) et en coupes axiales FLAIR (B, C).
Hématome intraparenchymateux responsable d'un engagement sous-falcoriel (croix blanche) et temporal (flèche).
L'engagement cérébral va induire la compression de certaines structures cérébrales comme la moelle allongée, par exemple en cas d'engagement amygdalien, ce qui peut rapidement aboutir au décès du patient.
Ischémie cérébrale
L'ischémie cérébrale est induite par une occlusion artérielle, le plus souvent du fait de la présence d'un caillot au sein d'une artère (voir chapitre 20). Elle se traduit par un œdème cytotoxique aboutissant à la nécrose du parenchyme cérébral au sein du territoire vascularisé par cette artère occluse. Cet œdème est typiquement bien limité à un territoire artériel et atteint plutôt la substance grise dans les premières heures. En TDM, cela se traduit par une hypodensité très discrète à la phase précoce, puis de plus en plus marquée (figure 23.25).
TDM cérébrale sans injection : hypodensité frontale droite (flèche blanche) correspondant à un AVC ischémique dans le territoire de l'artère cérébrale moyenne (ou sylvien) à 12 et à 48 heures du début des symptômes neurologiques.
L'IRM est plus sensible que la TDM à la phase précoce. Cela est particulièrement important car il existe maintenant des traitements de reperfusion de l'AVC ischémique de moins de 6 heures :
- l'injection intraveineuse d'un fibrinolytique, qui permet de détruire le caillot ;
- la thrombectomie, qui consiste à aspirer le caillot par voie endovasculaire en neuroradiologie interventionnelle.
La séquence IRM essentielle au diagnostic précoce de l'ischémie est la séquence de diffusion (voir chapitre 8) : la zone ischémiée est en hypersignal dès la première demi-heure après l'occlusion artérielle. Sur les autres séquences d'IRM (T2 et FLAIR), l'apparition de l'hypersignal est plus tardive : à partir de 6 heures après le début de l'ischémie (figure 23.26).
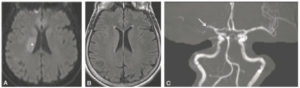
IRM cérébrale en coupes axiales diffusion (A), FLAIR (B) et angio-IRM du cercle artériel du cerveau (C).
Hypersignal en diffusion (croix blanche) correspondant à un AVC ischémique dans le territoire de l'artère cérébrale moyenne droite (ou sylvien droit). Celui-ci n'est pas encore visible en FLAIR, ce qui témoigne du caractère très récent (inférieur à 6 heures). L'angio-IRM montre une occlusion de l'artère cérébrale moyenne droite (flèche).
L'occlusion artérielle peut être mise en évidence par angio-TDM, ou par angio-IRM. Elle se traduit par la non-opacification ou la non-visualisation de l'artère occluse du fait de la présence du caillot (figure 23.26C, figure 23.27).
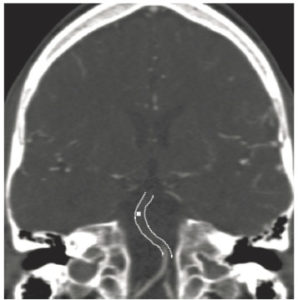
Angio-TDM du cercle artériel du cerveau montrant l'absence de rehaussement de la partie supérieure de l'artère basilaire témoignant d'une occlusion (croix blanche).
Le thrombus est représenté entre les traits en pointillés.
Hémorragie cérébrale
Le sang frais apparaît spontanément hyperdense en TDM, en l'absence de toute injection de produit de contraste (voir figure 23.15 et chapitre 21). Sa densité va ensuite évoluer vers l'hypodensité du fait de la dégradation de l'hémoglobine. Il est important de localiser l'espace dans lequel survient un saignement, en raison de sa valeur étiologique et thérapeutique :
- un hématome extradural est généralement secondaire à un traumatisme crânien avec fracture de la voûte et arrachement d'une structure vasculaire entre la voûte et la dure-mère : il apparaît sous la forme d'une lentille biconvexe hyperdense entre la dure-mère et la voûte osseuse ;
- un hématome sous-dural est généralement secondaire à un traumatisme crânien : il apparaît sous la forme d'un croissant à concavité interne hyperdense entre l'arachnoïde et la dure-mère. Il est généralement plus étendu que l'hématome extradural ;
- une hémorragie sous-arachnoïdienne est généralement secondaire à une rupture d'anévrisme : elle correspond à une hyperdensité entre la pie-mère et l'arachnoïde, dans les citernes de la base du crâne et/ou au fond des sillons corticaux ;
- un hématome intracérébral apparaît sous la forme d'une hyperdensité dans le parenchyme cérébral.
Épilepsie
Lorsqu'un examen d'imagerie est nécessaire, l'IRM est l'examen de référence, car elle permet de rechercher des anomalies responsables de la survenue de crises d'épilepsie : tumeurs, malformations corticales ou vasculaires.
En cas d'épilepsie pharmacorésistante, si un traitement chirurgical est envisagé, on peut réaliser une étude scintigraphique de la perfusion ou du métabolisme.
Celle-ci montre, au niveau de la lésion épileptogène, une hypoperfusion intercritique (en dehors des crises) en TEMP ou en TEP et une hyperperfusion percritique (pendant la crise) en TEMP.
Syndromes démentiels
Dans le cadre de l'évaluation de troubles cognitifs, l'IRM recherche des causes éventuellement curables de démences comme celles décrites ci-dessus (hématome sous-dural, tumeur, AVC), mais permet aussi de montrer les signes directs, mais tardifs, d'une maladie neurodégénérative comme une atrophie des hippocampes dans la maladie d'Alzheimer.
En médecine nucléaire, l'étude de la perfusion cérébrale et du métabolisme glucidique peut mettre en évidence précocement des zones de dysfonctionnement ou de mort neuronale se traduisant par une hypoperfusion ou un hypométabolisme. Les démences ont en général une topographie lésionnelle spécifique selon l'étiologie ; ces examens peuvent donc être utilisés à visée diagnostique et aider au diagnostic différentiel.
Tremblements et mouvements anormaux
L'IRM permet de rechercher des causes aux tremblements et mouvements anormaux (secondaires à des AVC ou lésions tumorales localisés au sein des ganglions de la base). Mais l'IRM, bien que limitée dans la maladie de Parkinson, permet également de rechercher des signes sémiologiques en faveur de certaines maladies neurodégénératives.
Le DatSCAN® et la TEP à la 18F-DOPA peuvent aider au diagnostic différentiel entre syndrome parkinsonien et tremblements essentiels.
Dans un syndrome parkinsonien, il existe une dégénérescence nigrostriée avec atteinte du versant présynaptique de la synapse dopaminergique au niveau striatal. Les images du versant présynaptique sont donc précocement anormales : asymétrie avec hypofixation du traceur du côté controlatéral aux signes cliniques (voir figure 23.19B).
Dans un tremblement essentiel, il n'y a pas d'atteinte neurodégénérative sous-jacente et les images du versant présynaptique de la synapse sont normales (voir figure 23.19A).
Perspectives
Les perspectives sont :
- l'utilisation de champs magnétiques de plus en plus élevés en IRM, qui permet d'augmenter la résolution spatiale mais s'accompagne en contrepartie de nombreuses contraintes ;
- l'utilisation de nouveaux MRP plus spécifiques comme les traceurs de la plaque amyloïde dans la maladie d'Alzheimer ;
- le développement d'appareils hybrides TEP-IRM permettant des acquisitions simultanées.
Essentiel à retenir
- En neuroradiologie, l'IRM est l'examen de première intention dans les affections médicales neurologiques, alors que la TDM est l'examen de première intention en pathologie traumatique.
- La substance blanche apparaît en hypersignal en T1, hyposignal en T2 et FLAIR, alors que la substance grise apparaît en hyposignal en T1 et en hypersignal T2 et FLAIR. Le LCS apparaît en hyposignal T1 et FLAIR et en hypersignal en T2.
- Le sang frais apparaît hyperdense en TDM. Son signal est variable dans le temps en IRM.
- En imagerie métabolique, il existe des MRP spécifiques pour l'exploration de quatre mécanismes physiopathologiques : perfusion cérébrale, métabolisme glucidique, dépôt des plaques amyloïdes, étude de la voie dopaminergique présynaptique.
- En métabolisme cérébral (18F-FDG), la fixation normale est intense, homogène et symétrique sur le parenchyme cortical et sous-cortical. Les régions anormales, où il existe un dysfonctionnement synaptique ou une mort neuronale, sont caractérisées par une fixation diminuée du traceur.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 22 - Imagerie ostéoarticulaire
G. Bierry et E. Rust
Plan du chapitre
- Connaître les principaux avantages, limites et indications des examens d'imagerie
- Reconnaître les principales anomalies en imagerie
Objectifs
- Connaître les avantages, limites et principales indications :
- des radiographies ;
- de la TDM ;
- de l'IRM ;
- de l'échographie ;
- de la scintigraphie et de la tomoscintigraphie ;
- de la TEP.
- Savoir reconnaître :
- une fracture/une luxation ;
- une anomalie de l'interligne/cavité articulaire ;
- un syndrome tumoral ;
- une augmentation/diminution de densité en radiographie/TDM ;
- une anomalie de l'os médullaire.
Connaître les principaux avantages, limites et indications des examens d'imagerie
Radiographies : principales indications, aspects normaux et pathologiques
Indications des radiographies en pathologie ostéoarticulaire
Les radiographies sont indiquées en première intention dans toutes les affections de l'appareil locomoteur. Une exception notable est cependant le patient polytraumatisé pour lequel une TDM sera réalisée en première intention.
Aspects normaux
Les os sont limités par l'os cortical qui apparaît d'un blanc très dense en radiographie (comme en TDM).
La cavité médullaire est remplie par les travées de l'os spongieux (trabéculaire), servant de support à la moelle hématopoïétique : sa densité est inférieure à celle de l'os cortical. Chez le patient non ostéoporotique, les travées sont généralement clairement discernables.
Les tissus musculosquelettiques non calcifiés (muscles, tendons, ligaments, cartilages, ménisques) ne sont pas discernables les uns des autres en radiographie ; ils présentent tous un aspect gris intermédiaire (ou tonalité hydrique) (figure 22.1).
Aspect comparatif d'une articulation (genou) en radiographie (A), coupe frontale TDM (B) et coupe frontale IRM en pondération T1 (C).
L'os cortical (flèche blanche) apparaît blanc en radiographie et TDM mais noir en IRM. La moelle osseuse (astérisque) est analysable en IRM. En radiographie et TDM, c'est l'os spongieux « trabéculaire » qui est analysable. Seule la hauteur de l'interligne articulaire (crochet) est analysable en TDM et en radiographie. En revanche, l'IRM permet d'analyser les ménisques (têtes de flèche), les ligaments (flèches larges) et les cartilages (#).
Anomalies osseuses
Les modifications des os détectables par les radiographies sont de trois types :
- de position : luxation ;
- de forme : fracture (figure 22.2), tumeur ;
Radiographie de face du poignet droit montrant une fracture de l'extrémité distale du radius (flèches).
- de densité : augmentation (ostéocondensation/sclérose) ou diminution (déminéralisation/ostéolyse).
Les radiographies sont parfaitement adaptées pour reconnaître des modifications des formes et contours des os (tumeurs, fractures) ou des modifications de rapport entre les os (luxations), car le contraste entre les os et les tissus adjacents (muscles, tendons, graisse) est suffisant.
Les radiographies sont également très efficaces pour détecter une augmentation de densité osseuse ; par exemple :
- condensation de l'os sous-chondral (c'est-à-dire sous le cartilage articulaire) dans l'arthrose ;
- cal fracturaire ;
- tumeur formant de l'os ;
- dysplasie osseuse condensante.
Les radiographies sont en revanche moins performantes pour détecter une diminution de la densité osseuse ; on estime que les anomalies ne sont visibles que quand 40 % de la charge calcique a disparu.
Anomalies des tissus musculosquelettiques non calcifiés (tendons, ligaments, muscles, ménisques)
Les radiographies ne permettent pas de montrer directement des anomalies des tissus musculosquelettiques non osseux (cartilage, tendons, ligaments, muscles) (voir figure 22.1).
Par exemple, une rupture ligamentaire est impossible à voir directement en radiographie : l'œdème lésionnel ayant la même densité que le tissu lésé (hydrique/hydrique), il n'existe pas de contraste radiologique permettant de les différencier.
Deux anomalies sont en revanche détectables :
- une calcification ou une ossification des parties molles (contraste « calcique » versus « hydrique ») ;
- un épaississement des tissus mous ayant une interface avec de l'air (gonflement d'une articulation après entorse par exemple) (contraste hydrique/aérique) ou la graisse sous-cutanée (contraste hydrique/graisseux).
Cas particulier du cartilage
Le cartilage est un tissu de tonalité hydrique évalué en routine de façon indirecte en radiographie. Le cartilage recouvre les surfaces articulaires des os et est donc responsable de l'épaisseur de l'interligne articulaire (l'espace entre les os).
Quand le cartilage est endommagé, comme dans l'arthrose, il s'amincit, et l'épaisseur de l'interligne diminue (on parle de « pincement » de l'interligne). L'atteinte du cartilage peut ainsi être évaluée indirectement par l'étude de l'épaisseur de l'interligne. Attention, néanmoins, il faut que la destruction du cartilage soit déjà avancée pour voir un pincement significatif, et les radiographies restent donc relativement peu sensibles pour son analyse.
TDM : principales indications et analyse séméiologique
Indications
La TDM peut être indiquée en pathologie ostéoarticulaire, notamment en traumatologie, lorsqu'un bilan plus précis que les radiographies est nécessaire (préopératoire par exemple) (figure 22.3) ; en pathologie infectieuse ou tumorale pour préciser une atteinte de l'os cortical ou trabéculaire.
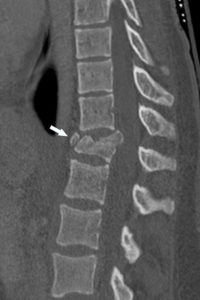
TDM (reconstruction sagittale en fenêtre osseuse) montrant une fracture du corps vertébral de T12 (flèche).
Analyse des tissus
Comme la base physique est la même, la séméiologie en TDM est identique à celle des radiographies : on distingue des anomalies condensantes et des anomalies déminéralisantes ou lytiques.
IRM : principales indications, aspects normaux et pathologiques
Généralités
À l'opposé des radiographies et de la TDM, l'IRM est capable de discriminer des tissus « hydriques » dès lors qu'ils présentent des T1 et T2 suffisamment différents. En raison de ces temps T1 et T2 très différents, l'IRM est l'examen d'imagerie le plus performant pour l'analyse des tissus musculosquelettiques.
Aspects normaux
L'os cortical est pauvre en protons et surtout il est constitué de cristaux ce qui lui confère un temps de relaxation T2 extrêmement court. Il apparaît donc noir en T1 et en T2.
La moelle osseuse est principalement graisseuse ; la médullaire est donc en hypersignal T1 et en iso-/hypersignal en T2. Les travées osseuses (os trabéculaire) sont peu visibles (en hyposignal sur toutes les séquences).
Les tendons, les ligaments et les ménisques sont en hyposignal T1 et T2 ; ils sont clairement analysables car discernables des autres structures environnantes.
Les muscles très hydratés présentent, en revanche, un signal intermédiaire (plus ou moins gris) en T1 et T2. Ils sont ainsi faciles à distinguer des tendons et ligaments.
Le cartilage articulaire, très hydraté lui aussi, se traduit également par une couche de signal gris intermédiaire recouvrant l'épiphyse.
Indications
Les indications de l'IRM en pathologie ostéoarticulaire sont vastes, avec une supériorité par rapport aux autres modalités pour l'analyse :
- de l'os médullaire : recherche d'œdème ou d'infiltration tumorale ;
- des muscles : recherche de traumatisme, de tumeur, d'infection, etc. ;
- des tendons, ménisques, ligaments : recherche de rupture, de fissure.
Analyse
Les processus pathologiques, quelle que soit leur nature (infection, tumeur, traumatisme, dégénératif, ischémique, inflammatoire), s'accompagnent souvent d'un œdème qui modifie le signal IRM des tissus atteints ; ils apparaissent alors en hyposignal T1 et hypersignal T2. Cependant, certaines modifications structurelles de l'os, en particulier cortical, sont analysables uniquement en radiographie, ce qui explique qu'une radiographie reste indispensable avant une IRM.
Échographie
Généralités
L'échographie est fondée sur l'émission et la réception d'ondes ultrasonores. Elle renseigne sur l'échogénicité du tissu étudié. Son application en imagerie ostéoarticulaire est limitée à l'exploration des structures superficielles, et elle est particulièrement efficace pour la détection d'un épanchement intra-articulaire.
Aspects normaux
Les tissus étudiés en échographie sont décrits comme :
- hyperéchogènes (blancs) ;
- hypoéchogènes ou anéchogènes (noirs, équivalents à l'eau) ;
- isoéchogènes (gris).
Les muscles sont globalement isoéchogènes. Les tendons et ligaments sont hyperéchogènes, avec un aspect fibrillaire. Les os ne peuvent être analysés que pour leur surface corticale qui est hyperéchogène avec un cône d'ombre postérieur du fait du caractère très réfléchissant de l'interface os-tissus mous. Les liquides, notamment articulaires, sont anéchogènes.
Indications
Les principales indications de l'échographie pour l'appareil locomoteur sont la recherche :
- d'épanchements intra-articulaires ;
- de lésions ligamentaires ou tendineuses ;
- de lésions musculaires ;
- de tumeurs des tissus mous.
Analyse
Un épanchement intra-articulaire est relativement facile à détecter par la mise en évidence du liquide anéchogène (donc noir) dans la cavité articulaire.
Les lésions musculaires, tendineuses ou ligamentaires peuvent se manifester comme des interruptions de la continuité des fibres et/ou des zones hypoéchogènes ou hétérogènes correspondant à des zones hémorragiques ou d'œdème (donc d'eau) locales.
Scintigraphie osseuse : avantages, limites et principales indications
Généralités, avantages et limites
Le squelette est un tissu vivant en remodelage permanent avec un équilibre entre activité ostéoblastique (accrétion) et ostéoclastique (résorption). En cas d'agression (fracture, métastase, infection, etc.), l'os réagit de manière univoque en augmentant sa perfusion (pour multiplier les échanges) et son remodelage osseux.
Grâce à l'injection au patient par voie veineuse d'un médicament radiopharmaceutique (MRP) à tropisme osseux (bisphosphonates marqués au 99mTc émetteurs de rayons γ et intégrés à l'os lors du processus d'accrétion), la scintigraphie permet la réalisation d'une cartographie fonctionnelle de l'activité ostéoblastique du corps entier.
Les images sont généralement acquises sur une gamma-caméra 2 à 4 heures après injection du MRP, délai nécessaire pour que celui-ci se fixe au squelette. Des images précoces sont parfois également réalisées ; le MRP est alors encore dans les compartiments vasculaire et interstitiel, ce qui permet de donner une information inflammatoire. Le MRP non fixé à l'os est éliminé par les urines.
Désormais, les gamma-caméras sont couplées à la TDM (gamma-caméras hybrides) et réalisent non seulement des images de scintigraphie planaires, mais également des acquisitions volumiques tridimensionnelles (tomographie d'émission monophotonique [TEMP]) et qui sont couplées à une TDM de repérage (figure 22.4). Ces images TEMP-TDM (SPECT-CT en anglais) permettent de s'affranchir des contraintes de superposition en permettant de localiser très précisément les hyperfixations osseuses. De plus, les anomalies de fixation peuvent être confrontées au contexte anatomique et aux données TDM, afin d'augmenter la spécificité. Il est ainsi possible, par exemple, de différencier, au sein d'une scintigraphie osseuse, les hyperfixations articulaires liées à des processus arthrosiques bénins actifs de processus pathologiques.
Scintigraphie et tomoscintigraphie osseuse fusionnée avec une TDM en 3D montrant des fissures multifocales (flèches) du pied gauche chez une patiente ostéoporotique.
La reconstruction 3D (B) permet une meilleure évaluation anatomique que le cliché planaire (A). L'acquisition hybride avec TDM permet de plus la recherche d'anomalies morphologiques associées aux hyperfixations.
Le principal avantage de la scintigraphie est sa sensibilité très élevée : presque toute agression augmente l'activité ostéoblastique et induit une hyperfixation. On fait l'image de la réaction et non pas de la lésion. Cette hyperfixation peut être focale (par exemple fissure), régionale (par exemple algodystrophie, infection), multifocale (par exemple métastases), ou générale (par exemple ostéopathie métabolique).
En outre, la scintigraphie montre parfois des processus osseux sans traduction radiographique (par exemple fissure, métastase infraradiologique) ; elle est aussi très utile quand l'évaluation radiologique est délicate (par exemple prothèses articulaires, arthrodèse rachidienne).
La principale limite de la scintigraphie est sa spécificité limitée. L'évaluation du remodelage osseux fourni par la scintigraphie est une information en tant que telle peu spécifique. De nombreux processus osseux sont susceptibles d'augmenter l'activité ostéoblastique et peuvent donc se manifester par une hyperfixation à la scintigraphie. Cette limite est toutefois fortement réduite par le couplage à la TDM dans le cadre de la TEMP-TDM.
L'augmentation de l'activité ostéoblastique ne permet intrinsèquement pas de distinguer un processus tumoral malin d'une atteinte bénigne (par exemple un tassement vertébral récent équivaut à une fracture et apparaîtra intensément hyperfixant en scintigraphie osseuse, qu'il soit de nature bénigne ostéoporotique ou maligne métastatique).
Certaines affections osseuses pourtant agressives n'induisent pas d'activité ostéoblastique et donc pas d'hyperfixation scintigraphique. Il s'agit par exemple de certaines métastases osseuses strictement ostéolytiques et rapidement progressives, ou des localisations de myélome.
On retiendra également comme limite de la scintigraphie la dose délivrée au patient, supérieure à celle des radiographies.
Aspect normal
La fixation du MRP sur le squelette doit être homogène et symétrique. L'interprétation doit cependant prendre en compte des altérations banales liées à l'âge (foyers arthrosiques hyperfixants chez le sujet âgé). Il existe une visualisation normale des reins, de la vessie et parfois même des uretères compte tenu de l'élimination urinaire du MRP. Chez l'enfant, il existe une hyperfixation physiologique des cartilages de conjugaison (régions métaphysaires), car ils sont hypervascularisés et surtout possèdent une activité ostéoblastique intense du fait de la croissance (voir chapitre 31).
Indications
Les indications sont les suivantes :
- exploration d'un syndrome douloureux local, généralement après un premier bilan d'imagerie incomplètement conclusif (par exemple mise en évidence d'une atteinte microtraumatique, d'une ostéonécrose, d'une algodystrophie) ;
- exploration d'un syndrome douloureux général inexpliqué (par exemple atteinte rhumatismale inflammatoire) ;
- évaluation du squelette appareillé (par exemple prothèse articulaire douloureuse, arthrodèse rachidienne douloureuse – figure 22.5) ;
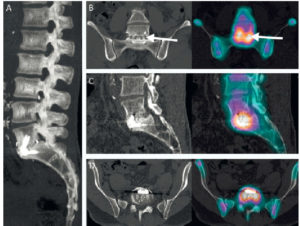
TEMP-TDM explorant une arthrodèse intersomatique L5-S1 implantée 2 ans auparavant chez un patient de 54 ans décrivant une lombalgie progressivement récurrente.
A. TDM couplée en vue sagittale MIP. B, C, D. Vues TDM et TEMP-TDM en coupes frontales, sagittales, axiales. L'examen retrouve des solutions de continuité intensément hyperfixantes (flèches) des trabéculations intersomatiques (greffes) situées au sein de la cage, en faveur d'une pseudarthrodèse.
- bilan d'extension initial et suivi d'un cancer ostéophile condensant où la scintigraphie osseuse est souvent réalisée en première intention en raison de sa sensibilité élevée ;
- recherche d'un processus septique (par exemple ostéomyélite) ;
- recherche et évaluation de tumeurs osseuses bénignes (par exemple ostéome ostéoïde, dysplasie fibreuse) et de tumeurs malignes de lignée osseuse (ostéosarcome) ;
- exploration de désordres métaboliques osseux (par exemple ostéopathie métabolique, maladie de Paget).
La scintigraphie osseuse permet également l'évaluation d'une anomalie osseuse déjà connue :
- détermination du caractère ancien ou récent d'une lésion osseuse (par exemple identification de l'atteinte la plus récente chez un patient algique présentant des tassements vertébraux étagés) ;
- détermination du caractère métaboliquement actif ou non d'une lésion osseuse (par exemple découverte d'une ostéocondensation chez un patient aux antécédents oncologiques, doute sur un ostéome ostéoïde).
Principes d'interprétation de la tomoscintigraphie couplée à la TDM
L'interprétation repose sur l'identification de toutes les anomalies de fixation qu'il convient alors d'expliciter en fonction de la topographie (par exemple articulaire, en pleine pièce osseuse, trajet linéaire fracturaire ?, etc.) et des données de la TDM de repérage (par exemple anomalie de la trame osseuse congruente aux anomalies de fixation ? Diagnostic alternatif à celui de métastase débutante ?)
TEP au 18F-FDG
La TEP au 18F-FDG, qui explore le métabolisme glucidique, permet de mettre en évidence des processus osseux pathologiques, notamment en oncologie : contingents tumoraux hypermétaboliques infiltrant le squelette tels que les métastases osseuses de type ostéolytique ou mixte, et les infiltrations ostéomédullaires (comme le myélome).
Elle est par ailleurs plus performante que la scintigraphie osseuse dans l'évaluation de certaines tumeurs osseuses non ostéoïdes, notamment le sarcome d'Ewing.
Autres tomographies par émission de positons (TEP-TDM)
Il est également possible de déceler des métastases osseuses en TEP-TDM avec des radiotraceurs spécifiques de certains phénotypes tumoraux. On mentionnera notamment les carcinomes prostatiques avec les TEP-TDM à la fluorocholine et au PSMA, et les tumeurs endocrines avec les TEP-TDM à la FDOPA et aux récepteurs à la somatostatine.
Reconnaître les principales anomalies en imagerie
Fractures et luxations
Les fractures sont des interruptions de la continuité (« solutions de continuité ») de l'os. Elles concernent généralement l'os cortical et l'os spongieux (trabéculaire), mais peuvent également n'atteindre que l'os trabéculaire.
Une fracture se traduit par une interruption du contour de l'os, avec un déplacement possible des fragments l'un par rapport à l'autre. Si la fracture est uniquement trabéculaire, le contour n'est pas modifié.
Les radiographies sont généralement suffisantes pour mettre en évidence les fractures, avec la réalisation systématique de deux clichés orthogonaux (par exemple face et profil) pour limiter les superpositions. Néanmoins, dans certains cas, une TDM complémentaire peut être indiquée (fractures difficiles à analyser sur les radiographies, fractures complexes, etc.).
Les fractures n'atteignant que l'os spongieux ne sont en général détectables qu'en IRM ou en scintigraphie.
Les luxations sont des pertes permanentes de la relation normale des os dans une articulation ; les radiographies sont en général suffisantes pour le diagnostic initial (figure 22.6).
Radiographies de face de l'épaule gauche.
A. Épaule normale : les rapports de l'articulation gléno-humérale sont normaux. B. Luxation scapulo-humérale avec perte des rapports anatomiques normaux (flèche).
Cavité et interligne articulaires
Une articulation réunit des surfaces articulaires osseuses par une capsule et délimite ainsi une cavité articulaire.
La distance entre les os dans une articulation s'appelle l'interligne articulaire correspondant dans l'immense majorité des cas à l'épaisseur du cartilage recouvrant les épiphyses (surfaces articulaires osseuses).
Cet interligne peut s'amincir en cas de lésion cartilagineuse comme dans l'arthrose ; on parle alors de pincement articulaire (figure 22.7).
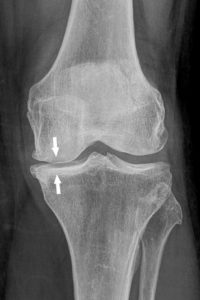
Radiographie de face du genou gauche montrant un pincement de l'interligne fémorotibial médial (flèches) dans le cadre d'une arthrose.
Noter la condensation sous-chondrale associée.
Le volume de la cavité articulaire peut augmenter en cas d'épanchement intra-articulaire, bien visible en échographie (liquide noir anéchogène) (figure 22.8), en TDM (liquide hypo- ou isodense), ou IRM (liquide hyperintense en T2). Il est parfois plus difficile à mettre en évidence en radiographie.
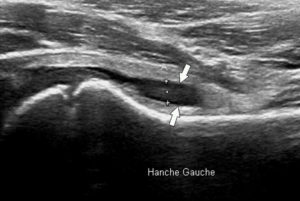
Échographie de la hanche d'un enfant en coupe longitudinale présentant une boiterie montrant un épanchement anéchogène (flèches) dans le cadre d'une synovite.
Syndrome tumoral
Une tumeur osseuse peut se développer aussi bien dans l'os cortical que dans l'os médullaire, voire dans le périoste. Elle peut ainsi naître dans une de ces parties et envahir les autres.
Si la tumeur reste dans l'os médullaire, aucune modification de taille et de contour (défini par l'os cortical) ne sera visible en radiographie. Une tumeur osseuse suffisamment grande déforme les contours de l'os, réalisant un syndrome tumoral. Les modifications de contours peuvent être soit une expansion osseuse, soit une destruction (ou ostéolyse) (figure 22.9). Les tumeurs intramédullaires sont explorées par IRM.
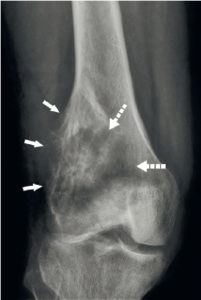
Radiographie de face du genou montrant un processus tumoral (ostéosarcome) déformant les contours du fémur (flèches) et avec une plage d'ostéolyse (flèches pointillées).
Augmentation de densité radiologique
La densité radiologique peut être augmentée dans les os (ostéocondensation), ou dans les tissus non ossifiés (muscles, tendons, ligaments, etc.).
Dans les os, l'augmentation de la densité est soit :
- un mécanisme de défense de l'os face à un processus peu agressif :
- arthrose avec condensation des surfaces articulaires (figure 22.10),
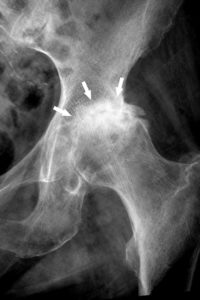
Radiographie de hanche gauche de face montrant une condensation de l'os sous-chondral (flèches) de part et d'autre de l'interligne coxofémoral pincé dans le cadre d'une arthrose coxofémorale.
- tumeur bénigne à croissance lente avec réaction condensante de l'os adjacent ;
- une production osseuse par une tumeur de lignée osseuse (ostéosarcome par exemple) ;
- une anomalie développementale ;
- une intoxication (fluor par exemple).
Toute augmentation de la densité osseuse est liée à une activité ostéoblastique dont la scintigraphie osseuse peut déterminer le caractère actif ou non.
Dans les tissus mous, une augmentation de densité est généralement :
- une calcification dans la majorité des cas : dépôts de cristaux (figure 22.11) ;
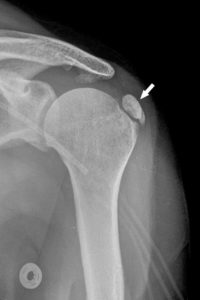
Radiographie de face de l'épaule gauche montrant une grande calcification dans un tendon de la coiffe des rotateurs dans le cadre d'un rhumatisme à cristaux de phosphate de calcium basique (PCB).
- un corps étranger.
Diminution de la densité radiologique
Une diminution de la densité radiologique d'un os est de deux types :
- soit focale : il s'agit d'une ostéolyse ;
- soit diffuse : il s'agit d'une déminéralisation (figures 22.12 et 22.13).
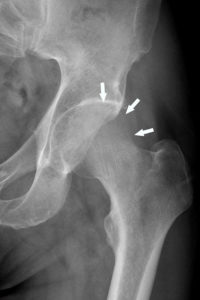
Radiographie de la hanche gauche montrant une déminéralisation de la tête fémorale qui apparaît moins dense que le grand trochanter, avec une perte de visibilité de la corticale supérieure (flèches) dans le cadre d'une algodystrophie.
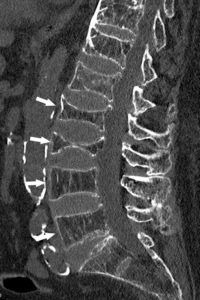
TDM (reconstruction sagittale en fenêtre osseuse) montrant une déminéralisation diffuse des corps vertébraux (flèches) qui apparaissent moins denses que les disques intervertébraux et aplatis, traduisant des tassements vertébraux dans le cadre d'une ostéoporose.
Les ostéolyses sont des zones limitées où la densité osseuse diminue, avec fréquemment une destruction associée de la trame osseuse.
Les principales causes d'ostéolyse sont :
- les tumeurs osseuses primitives ou secondaires (figure 22.14) ;
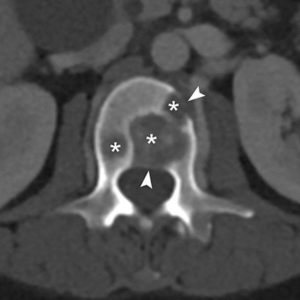
TDM (coupe axiale) passant par L2 montrant des ostéolyses multiples (métastases) (astérisques) dont certaines interrompent la corticale (têtes de flèche).
- les infections osseuses.
La déminéralisation peut être secondaire à une affection générale du tissu osseux comme l'ostéoporose ; elle atteint alors l'ensemble des os du corps.
La déminéralisation peut également rester régionale (un membre, une articulation). Les principales causes sont alors :
- une infection (arthrite septique débutante) ou un rhumatisme inflammatoire chronique (polyarthrite rhumatoïde par exemple) ;
- une immobilisation prolongée ;
- une algodystrophie (voir figure 22.12).
Anomalie de l'os médullaire
L'IRM est très sensible aux modifications de la quantité et de la distribution de l'eau. Tous les processus pathologiques entraînant une inflammation avec augmentation de l'eau extracellulaire vont pouvoir être détectés en IRM. Cette inflammation produit une modification de signal non spécifique dans l'os médullaire se traduisant par un hyposignal en T1 et un hypersignal en T2 (figure 22.15). Il faut noter qu'une infiltration tumorale, quelle que soit la composante inflammatoire associée, va entraîner le même type de modifications.
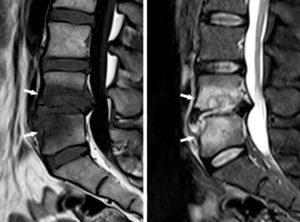
Spondylodiscite infectieuse en IRM.
Coupes IRM (plan sagittal) (T1 à gauche, T2 à droite) montrant un œdème vertébral en hyposignal T1 et hypersignal T2 (flèches).
La scintigraphie osseuse (figure 22.16) et la TEP-TDM sont également en mesure d'identifier des processus pathologiques intramédullaires à des phases très précoces, avant qu'ils ne deviennent visibles en radiographie ou en TDM.
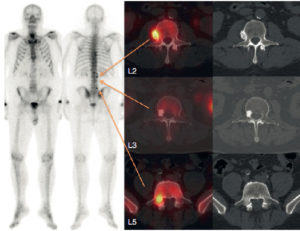
Scintigraphie et tomoscintigraphie osseuses chez un patient de 63 ans aux antécédents d'adénocarcinome prostatique en rechute biologique.
Le balayage corps entier (images planaires, à gauche) retrouve de multiples hyperfixations vertébrales. La tomoscintigraphie (à droite, coupes axiales fusionnées avec la coupe TDM) permet d'identifier une hyperfixation intense bénigne en regard d'un processus ostéophytique en L2 (arthrose), une absence d'hyperfixation en regard d'une lésion condensante non métastatique du corps vertébral de L3 (îlot condensant bénin), et une hyperfixation intense du pédicule droit de L5 correspondant à une métastase débutante.
Essentiel à retenir
- Les radiographies sont l'examen d'imagerie de première intention dans l'exploration des atteintes de l'appareil locomoteur. Elles permettent l'analyse rapide de l'ensemble d'un os ou d'une articulation, mais sont peu sensibles pour l'exploration de l'os médullaire et des tissus non calcifiés (tendons, ligaments, cartilage, muscles).
- La TDM a la même séméiologie que les radiographies. Elle est plus sensible et évite les superpositions, mais est plus irradiante et nécessite la revue de toutes les images pour avoir une analyse complète.
- L'IRM est l'examen de référence pour l'analyse des tissus non calcifiés et de l'os médullaire. Les anomalies apparaissent en IRM le plus souvent en hyposignal T1 et hypersignal T2, témoignant d'un œdème.
- L'échographie est un examen rapide et non irradiant, très performant pour la recherche d'un épanchement articulaire et l'étude des tissus non calcifiés superficiels.
- La scintigraphie osseuse est une imagerie fonctionnelle permettant une analyse « corps entier » pour une irradiation relativement limitée. Elle est très sensible mais assez peu spécifique ; sa spécificité est améliorée par l'acquisition hybride tomoscintigraphique.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 21 - Processus hémorragiques
O. Chevallier et R. Loffroy
Plan du chapitre
- Introduction
- Imagerie des processus hémorragiques
- Conclusion
Objectifs
- Connaître la séméiologie des hématomes selon les différentes modalités d'imagerie : radiographie, échographie, TDM et IRM.
- Connaître le rôle essentiel et croissant des embolisations percutanées sous contrôle radiologique dans la prise en charge des hémorragies.
- Connaître les examens d'imagerie à demander en fonction du siège de l'hématome.
Introduction
Une hémorragie correspond à une issue de sang hors des vaisseaux. Les processus hémorragiques sont fréquemment explorés en imagerie, qu'ils soient extériorisés (épistaxis, hématémèse ou hémoptysie), collectés dans un espace anatomique (hémothorax, hématome sous-dural, hémopéritoine) ou intratissulaires (hématome cutané, ecchymose, purpura).
Cette issue de sang, en fonction de sa quantité et de son siège, se traduit différemment sur le plan clinique, allant du simple hématome superficiel des tissus mous à l'hémorragie cérébrale, voire au choc hypovolémique.
Au sein des hémorragies collectées ou intratissulaires, il existe trois phases évolutives au cours desquelles les produits de dégradation du sang ont des propriétés différentes en imagerie :
- phase aiguë : l'hématome est constitué de globules rouges intacts contenant de la désoxyhémoglobine ;
- phase subaiguë : transformation de la désoxyhémoglobine en méthémoglobine ;
- phase chronique : détersion complète ou incomplète de l'hématome. Dans ce dernier cas, il existe une coque fibreuse tatouée éventuellement de pigments d'hémosidérine, parfois calcifiée, entourant un liquide citrin correspondant à du sang dégradé.
L'imagerie permet de préciser si le saignement collecté ou intratissulaire est à une phase aiguë ou tardive car la séméiologie en imagerie des saignements est différente en fonction de leur ancienneté.
L'exploration en imagerie d'une hémorragie, qu'elle soit extériorisée, collectée ou intratissulaire, a deux objectifs essentiels :
- diagnostique : affirmer le saignement, le localiser, évaluer son importance, son ancienneté, son potentiel évolutif ;
- thérapeutique : prise en charge de l'étiologie vasculaire, avec le rôle croissant des techniques d'embolisation, procédures mini-invasives réalisées par voie percutanée.
Imagerie des processus hémorragiques
Radiographies
Les radiographies sont souvent l'examen de première intention dans l'exploration des traumatismes ostéoarticulaires. Elles ne permettent cependant pas de caractériser, ni de localiser précisément les hématomes. En effet, à la phase aiguë ou subaiguë, les hématomes ont une densité de tonalité hydrique, non spécifique, qui se confond avec celle des structures musculoligamentaires adjacentes. Il existe une exception qui est celle des épanchements dans une articulation à la phase aiguë d'un traumatisme. L'hémarthrose se traduit par un comblement radio-opaque intra-articulaire avec remplacement du contingent graisseux synovial par du liquide (figure 21.1). Si la densité d'un épanchement sanglant n'est pas différente de celle d'un épanchement liquidien citrin ou purulent, on considère que, lorsque l'épanchement survient à la phase aiguë du traumatisme, il s'agit plus probablement d'une hémarthrose.
Traumatisme du genou droit chez une femme de 35 ans lors d'une chute.
La radiographie standard du genou droit de profil montre un comblement radio-opaque du récessus sous-quadricipital (A) (flèches) correspondant à l'hémarthrose. Après traitement (B) (astérisque), cette image a disparu. L'hémarthrose est le signe indirect d'une fracture du plateau tibial latéral, visualisée en TDM (C) (flèche).
À la phase chronique, si les parois de l'hématome sont calcifiées, elles apparaîtront sous la forme de lignes radio-opaques en radiographie.
Échographie
L'échographie joue également un rôle dans la détection des hémorragies ou hématomes.
En échographie, l'aspect d'un hématome évolue dans le temps (figure 21.2) :
- les premiers jours, la composante liquidienne (sang fluide) est majeure : l'absorption des ultrasons est minimale avec peu de réflexion et la quasi-totalité des ultrasons traverse l'hématome. L'hématome est anéchogène, c'est-à-dire noir, avec un renforcement postérieur des ultrasons ;
- après 15 jours d'évolution, en phase subaiguë, l'hématome va coaguler et avoir une composante fibreuse « pseudo-tissulaire » : l'hématome n'est plus de structure homogène, entraînant alors des phénomènes de réflexion et de diffusion des ondes ultrasonores. L'hématome devient échogène.
Aspect échographique à J1 et à J20 d'un hématome musculaire du mollet.
À J1 (A), l'hématome est anéchogène sous la forme d'une bande noire entre les muscles gastrocnémien (GM) et soléaire. À J20 (B), l'hématome est échogène (entre les flèches) avec une atténuation plus importante des ultrasons et une augmentation de leur réflexion.
Il existe trois principales indications de l'échographie dans les processus hémorragiques :
- dans la prise en charge du polytraumatisé avec instabilité hémodynamique : « FAST » écho pour la recherche d'une hémorragie dans une cavité séreuse (hémopéritoine ou hémothorax). Lorsque l'instabilité hémodynamique du patient ne permet pas la réalisation d'un bilan lésionnel précis par TDM (chez les accidentés de la route par exemple), une exploration échographique des cavités thoracique et abdominale à la recherche d'un ou de plusieurs épanchements liquidiens (de nature hémorragique dans ce contexte) est réalisée au lit du malade. La constatation et l'évaluation de l'abondance d'un ou de plusieurs épanchements peuvent alors conditionner un transfert au bloc opératoire pour une exploration chirurgicale en vue d'un geste d'hémostase en urgence extrême ;
- dans la prise en charge des lésions musculaires pour la recherche d'hématome (voir figure 21.2) ;
- dans la détection de certains saignements profonds comme les kystes ovariens hémorragiques.
TDM
La TDM joue un rôle fondamental dans le diagnostic des hématomes profonds, mais aussi pour en déterminer la prise en charge optimale.
L'exploration en TDM d'une hémorragie requiert généralement la réalisation d'un protocole d'acquisition multiphasique, sans, puis avec injection de produit de contraste de façon à objectiver les éléments suivants :
- au temps sans injection, la TDM permet d'affirmer l'hémorragie (hématome constitué, épanchement hématique au sein d'un espace, etc.). Une acquisition sans injection de produit de contraste ne permet cependant pas de préciser le caractère actif ou non actif du processus hémorragique ;
- après injection de produit de contraste iodé, la TDM permet de préciser le caractère actif ou non du processus hémorragique, et d'en rechercher sa cause : une malformation vasculaire (comme un anévrisme), une plaie vasculaire, une lésion tumorale, etc.
TDM sans injection
La TDM fournit une image en niveaux de gris. Cette atténuation, propre à chaque tissu, a permis d'établir une échelle de densité en unités Hounsfield ou UH (figure 21.3). Le coefficient d'atténuation du sang à la phase aiguë est compris entre 50 et 70 UH ; la plupart des tissus (cerveau, foie, rate, tube digestif, muscles) ayant généralement une densité spontanée située entre 20 et 50 UH. Ainsi, la présence de sang frais se traduit en TDM par des collections ou épanchements spontanément denses sur une TDM sans injection, c'est-à-dire de densité supérieure aux tissus voisins. On parle d'« hyperdensité spontanée ». Le terme « spontané » sous-entend que la densité est évaluée à partir d'une acquisition réalisée sans injection de produit de contraste. Sur les seules images TDM obtenues après injection de produit de contraste, il peut en effet parfois être difficile de préciser si l'hyperdensité est due au contenu (ici hématique) de la structure étudiée, ou si elle est due à son rehaussement après injection (structure vascularisée).
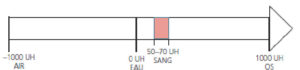
Échelle de densité des tissus selon Hounsfield allant de − 1000 UH à + 1000 UH.
Le sang (caillot, hématomes récents) est compris entre + 50 et + 70 UH.
À titre d'exemple, devant une forte suspicion d'hémorragie sous-arachnoïdienne en cas de céphalées intenses, le temps sans injection de la TDM cérébrale permet de mettre en évidence une hyperdensité spontanée des espaces sous-arachnoïdiens (figure 21.4).
Patient de 28 ans ayant présenté une crise comitiale avec un score de Glasgow à 4 en post-critique. TDM cérébrale sans injection.
A. Hyperdensité spontanée diffuse des espaces sous-arachnoïdiens (flèches) témoignant d'une hémorragie sous-arachnoïdienne. Il existe également une dilatation des ventricules latéraux. B. Hyperdensité spontanée au sein des ventricules (flèche) témoignant d'une hémorragie intraventriculaire. On retrouve également les signes d'hémorragie sous-arachnoïdienne (têtes de flèche). C. Centrée sur la fosse postérieure, la TDM montre une hémorragie au sein du 4e ventricule (flèche) et des citernes de la base.
TDM avec injection
L'hémorragie ou l'hématome ayant été identifié sur le temps sans injection, l'injection de produit de contraste aide à identifier et à localiser la cause de l'hémorragie lorsqu'elle est abondante et, ainsi, à optimiser la prise en charge thérapeutique.
On réalise le plus souvent une seule injection de produit de contraste iodé avec deux acquisitions successives : l'une précoce en phase artérielle et une plus tardive en phase veineuse. D'autres acquisitions peuvent parfois s'avérer nécessaires. Le protocole d'acquisition est prescrit par le radiologue qui l'adapte au contexte clinique. Il est donc absolument nécessaire que les informations cliniques pertinentes lui aient été communiquées (antécédents, histoire de la maladie, signes de gravité, etc.). Un protocole d'acquisition inadapté peut effectivement entraîner un diagnostic erroné ou incomplet et retarder la prise en charge thérapeutique.
Diverses causes peuvent ainsi être mises en évidence ; à titre d'exemples :
- à l'étage cérébral : un anévrisme intracrânien (figure 21.5), une malformation artérioveineuse, une thrombophlébite cérébrale ;
Cas de la figure 21.4 d'hémorragie méningée massive chez un patient de 28 ans.
A. AngioTDM cérébrale après injection en phase artérielle dévoilant la présence d'un anévrisme sacciforme de l'artère communicante antérieure (flèche). B. Reconstruction volumique de l'angio TDM artérielle cérébrale permettant l'analyse tridimensionnelle de l'anévrisme (flèche).
• aux étages thoraciques, abdominopelviens, ou même au niveau d'un membre : un hématome (figure 21.6), une plaie vasculaire (figures 21.7 et 21.8) (traumatique ou chirurgicale).
Femme de 80 ans admise aux urgences pour violentes douleurs abdominales après une chute sur le flanc gauche avec instabilité tensionnelle.
La TDM sans injection (A) montre un volumineux hématome du muscle ilio-psoas gauche (hyperdensité spontanée) (astérisque). Après injection de produit de contraste au temps artériel (B), mise en évidence d'une fuite active de produit de contraste (flèche). Cette fuite active apparaît sous la forme d'une flammèche de produit de contraste hyperdense (de la même densité que l'aorte abdominale). La patiente a été prise en charge immédiatement en radiologie interventionnelle pour embolisation.
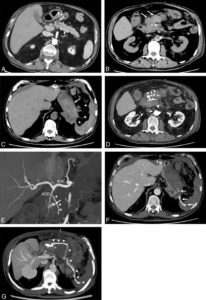
Patient présentant un choc hémorragique 3 jours après la prise en charge chirurgicale par pancréatectomie caudale et splénectomie (+ cholécystectomie) d'une tumeur intracanalaire papillaire et mucineuse du pancréas (TIPMP) des canaux secondaires dégénérée.
A. TDM préopératoire après injection en phase artérielle différée montrant la lésion de TIPMP des canaux secondaire (flèche). Le patient présente un choc hémorragique 3 jours après la chirurgie. Une TDM est réalisée. B. TDM sans injection montrant une collection spontanément hyperdense (flèches) au contact et en avant du moignon pancréatique correspondant à un hématome frais. La structure spontanément très hyperdense désignée par la flèche en pointillés correspond à la ligne de suture chirurgicale. C. TDM sans injection montrant l'extension de l'hématome au contact et en avant de l'estomac (flèche) et au sein de la loge de splénectomie (têtes de flèche). D. TDM après injection en phase artérielle dévoilant une structure de forme nodulaire très dense au contact de la ligne de suture et de l'artère gastroduodénale correspondant à un faux anévrisme (flèche), accompagné d'une importante fuite de produit de contraste en avant (têtes de flèche). Il s'agit donc vraisemblablement d'un faux anévrisme rompu. E. Cette reconstruction coronale oblique et en maximum intensity projection (MIP) de l'acquisition en phase artérielle montre que le faux anévrisme (flèche) provient vraisemblablement d'une petite branche de l'artère gastroduodénale (AGD). AHC : artère hépatique commune. Les têtes de flèche désignent la ligne de suture chirurgicale, spontanément hyperdense. F. Nouvelle acquisition en phase veineuse montrant que la fuite de produit de contraste s'étend jusqu'à la loge de splénectomie (flèches), expliquant donc l'hématome à distance du site de résection pancréatique. G. Reconstruction axiale oblique en MIP de l'acquisition en phase veineuse montrant le trajet de la fuite vers la loge de splénectomie (têtes de flèche).
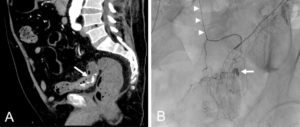
Patient présentant des rectorragies abondantes.
A. TDM après injection en phase artérielle, en reconstruction sagittale, montrant une fuite du produit de contraste dans la lumière digestive (flèche) du côlon sigmoïde, témoignant d'un saignement actif d'origine artérielle (origine diverticulaire non visible ici). B. Angiographie. Par une voie d'abord fémorale droite, une sonde/cathéter a été positionnée à l'origine de l'artère mésentérique inférieure (AMI). Un microcathéter a ensuite été utilisé pour naviguer dans l'AMI et dans une branche plus distale (têtes de flèche). L'injection de produit de contraste dans le microcathéter met en évidence la fuite de produit de contraste, et donc le saignement actif, au sein du côlon sigmoïde (flèche). Une embolisation sélective pourra donc être réalisée.
Dans les cas d'une plaie vasculaire, l'injection de produit de contraste permet de rechercher le site actif de l'hémorragie (ou fuite active ou extravasation). On ne visualise pas directement la brèche vasculaire, mais en regard apparaît une « flammèche » de produit de contraste très hyperdense au sein de l'hématome (voir figure 21.6). La TDM injectée permet donc de déterminer l'artère porteuse de l'hémorragie, ce qui permet de guider le geste thérapeutique (voir figure 21.7).
Lorsqu'il existe une fuite active ou extravasation de produit de contraste d'origine artérielle visible en TDM, un traitement peut être éventuellement entrepris en urgence ; celui-ci sera soit chirurgical, soit radiologique avec embolisation. Cette dernière option est réalisée de façon percutanée et ne nécessite généralement qu'une anesthésie locale, moins invasive pour le patient. Certains saignements actifs d'origine veineuse peuvent également nécessiter un geste d'hémostase en urgence (en cas de rupture d'une varice digestive dans un contexte d'hypertension portale par exemple).
La constatation d'un saignement actif en imagerie n'est cependant pas toujours synonyme de prise en charge chirurgicale ou radiologique par embolisation en urgence. Par exemple, en cas d'hématome musculaire survenant sous traitement anticoagulant avec saignement actif visible en imagerie chez un patient stable ne présentant pas de signe clinicobiologique inquiétant, le traitement consiste en l'arrêt du traitement anticoagulant (avec éventuelle antagonisation), la mise en place d'un pansement compressif si possible, et une surveillance clinicobiologique. A contrario, certains processus hémorragiques nécessitent une prise en charge radiologique ou chirurgicale en urgence, même s'ils ne sont pas objectivés par une fuite active de produit de contraste en imagerie (parce que la cause est connue et la prise en charge urgente, comme une embolisation des artères utérines en cas d'hémorragie de la délivrance), ou parce que le saignement est subintrant (comme pour une embolisation de l'artère gastroduodénale après échec de la prise en charge endoscopique d'un ulcère duodénal).
Artériographie
La prise en charge thérapeutique des hémorragies d'origine artérielle repose actuellement en grande partie sur les techniques d'embolisation, réalisées sous contrôle de l'imagerie par des radiologues interventionnels, permettant l'obtention rapide de l'hémostase. Il s'agit d'une approche mini-invasive où le traitement est réalisé par voie endovasculaire (voir chapitre 15).
L'abord vasculaire se fait par voie percutanée avec ponction le plus souvent d'une artère fémorale, radiale ou brachiale.
La navigation au sein des vaisseaux est réalisée sous contrôle radioscopique/radiographique et à l'aide de sondes/cathéters et de fil-guides, éventuellement de micro-cathéters et de micro-guides. Le radiologue peut ainsi accéder à l'artère porteuse du saignement (par exemple anévrisme) et procéder à l'embolisation (figures 21.8 et 21.9). Les dispositifs d'embolisation sont variés et peuvent être de nature mécanique : coils (spires métalliques), particules, plugs, stents ; ou de nature liquide : colle biologique, agents adhésifs visqueux, etc. (figures 21.10, 21.11 et 21.12) (voir chapitre 15).
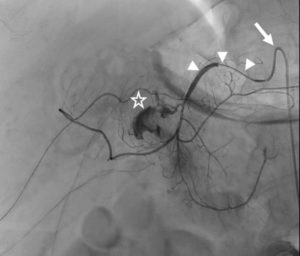
Patient présentant des hématémèses et un méléna sur saignement actif d'un ulcère du bulbe duodénal non contrôlable par voie endoscopique.
Devant l'échec du traitement endoscopique, un traitement radiologique par embolisation est entrepris. Une sonde/cathéter (flèche) a tout d'abord été utilisée pour cathétériser le tronc cœliaque. Ensuite, un microcathéter (têtes de flèche) a été introduit dans l'artère hépatique commune, puis positionné au sein de l'artère gastroduodénale. L'injection de produit de contraste dans le microcathéter met en évidence une importante fuite de produit de contraste (étoile), et donc un saignement actif massif, provenant d'une branche de l'artère gastroduodénale.
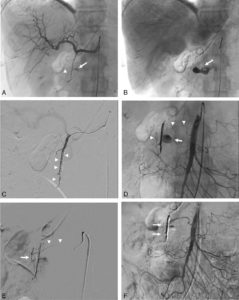
Prise en charge endovasculaire en radiologie interventionnelle d'un patient présentant un choc hémorragique à la suite de la prise en charge chirurgicale par pancréatectomie caudale et splénectomie (+ cholécystectomie) d'une tumeur intracanalaire papillaire et mucineuse du pancréas (TIPMP) des canaux secondaires dégénérée.
La TDM a mis en évidence un saignement actif sur faux anévrisme d'une branche de l'artère gastroduodénale (AGD). Il s'agit du patient de la figure 21.7. A. Angiographie : par une voie d'abord fémorale droite, une sonde/cathéter a été positionnée dans le tronc cœliaque puis à l'origine de l'artère hépatique commune. L'injection de produit de contraste dans le cathéter met en évidence le faux anévrisme (flèche) développé sur une petite branche de l'AGD (tête de flèche ; probable arcade pancréatico-duodénale). B. Acquisition réalisée quelques secondes plus tard montrant l'importante fuite de produit de contraste (flèche) témoignant d'une hémorragie majeure. C. Un microcathéter a permis de cathétériser l'AGD et de l'emboliser à l'aide de multiples micro-coils (têtes de flèche). L'injection de produit de contraste permet de confirmer l'exclusion du segment de l'AGD porteur de la branche porteuse du faux anévrisme. D. Bilan angiographique de l'artère mésentérique supérieure (AMS). La sonde/cathéter a été positionnée à l'origine de l'AMS. L'injection de produit de contraste au travers de la sonde/cathéter permet de dévoiler la reprise du faux anévrisme et du saignement (flèche) par une arcade pancréaticoduodénale (têtes de flèche). Une embolisation complémentaire est donc absolument nécessaire. E. Un microcathéter (têtes de flèche) est positionné en distalité au sein de cette arcade pancréaticoduodénale. L'injection de produit de contraste permet de visualiser le segment porteur du faux anévrisme (flèche). F. Contrôle angiographique après embolisation de l'arcade pancréaticoduodénale par le microcathéter à l'aide de colle biologique (flèches), permettant de confirmer l'exclusion du faux anévrisme et l'arrêt du saignement.
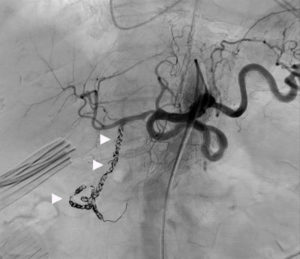
Embolisation par coils (têtes de flèche) de l'artère gastroduodénale pour saignement récidivant d'un ulcère duodénal.
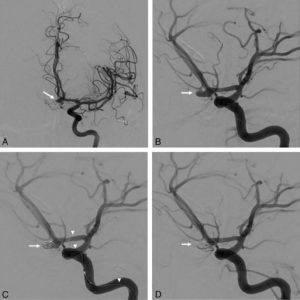
Prise en charge par embolisation en radiologie interventionnelle d'un patient de 28 ans ayant présenté une crise comitiale avec un score de Glasgow à 4 en post-critique suite à la rupture d'un anévrisme intracrânien de l'artère communicante antérieure.
Il s'agit du patient de la figure 21.4. A. Bilan artériographique, incidence frontale, de l'artère carotide interne gauche, permettant la mise en évidence de l'anévrisme sacciforme (flèche) de l'artère communicante antérieure. B. Bilan artériographique, incidence oblique (incidence de travail) de l'artère carotide interne gauche, permettant la mise en évidence de l'anévrisme (flèche) de l'artère communicante antérieure. C. Embolisation par coils (flèche) de l'anévrisme à l'aide d'une micro-cathéter (têtes de flèche). D. Contrôle après embolisation permettant de confirmer l'exclusion de l'anévrisme (flèche).
Les principales indications sont l'hémorragie digestive haute avec ulcère hémorragique et échec du traitement endoscopique par le gastro-entérologue, l'hémorragie de la délivrance et l'hémorragie intracrânienne sur rupture d'anévrisme.
IRM
L'IRM a un rôle fondamental dans le diagnostic positif des hématomes avec un avantage par rapport aux autres techniques d'imagerie : la datation approximative du début du processus hémorragique.
En effet, le signal de l'hématome varie en fonction du délai écoulé entre sa formation et la réalisation de l'IRM (figure 21.13) :
- hyperaigu (quelques heures) : hyposignal en séquence pondérée T1 et hypersignal en séquence pondérée T2 liés au contenu en oxyhémoglobine ;
- aigu (J1-J3) : iso- ou hyposignaux T1 et T2 liés au contenu en désoxyhémoglobine ;
- subaigu précoce (J3-J7) : hypersignal T1 et hyposignal T2 liés au contenu en méthémoglobine ;
- subaigu tardif (J7-J14) : hypersignal T1 et hypersignal T2 au centre de l'hématome. Couronne en hyposignal périphérique T1 et T2 (hémosidérine et tissu fibreux) ;
- chronique (après J14) : hyposignaux T1 et T2 liés à l'hémosidérine et au tissu fibreux.
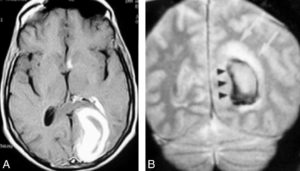
Deux exemples d'hématome intra-parenchymateux en IRM.
A. Coupe axiale en pondération T1 : hématome en phase subaiguë précoce en hypersignal T1. B. Coupe coronale en pondération T2 écho de gradient en phase subaiguë tardive avec centre en hypersignal T2 et périphérie d'hémosidérine en hyposignal T2.
Cette finesse sémiologique est intéressante notamment en neuroradiologie où les patients sont parfois vus à distance de l'épisode initial. Ainsi, en cas d'AVC hémorragique avec hématome intraparenchymateux, il est possible d'apprécier de façon approximative l'ancienneté du saignement.
Scintigraphie aux hématies marquées au 99mTc
La scintigraphie aux hématies marquées peut être utile en cas de saignement digestif occulte, lorsque les méthodes artériographiques et endoscopiques sont négatives, et en dehors d'un contexte d'urgence thérapeutique. Le principe est d'utiliser comme traceur les globules rouges du patient marqués au 99mTc. Ces globules rouges marqués s'accumulent au niveau du site de saignement, à une vitesse dépendant de l'importance du saignement (de quelques secondes à plusieurs heures).
Les techniques scintigraphiques peuvent également permettre de détecter un diverticule de Meckel, cause classique de saignement digestif chez l'enfant (voir chapitre 31).
Conclusion
L'exploration des processus hémorragiques en imagerie est multimodale : hématomes musculaires en échographie, hématomes profonds en TDM, évolution des hématomes intracérébraux en IRM et prise en charge thérapeutique en artériographie.
La TDM joue un rôle clé dans leur prise en charge diagnostique dans le cadre de l'urgence avec la mise en évidence d'une hyperdensité spontanée en phase d'acquisition sans injection. En l'absence de contre-indications, l'examen doit être complété par l'injection de produit de contraste à la recherche d'une fuite active et pour identifier la cause du saignement qui conditionne la prise en charge thérapeutique.
Essentiel à retenir
- Les hémorragies ont une présentation spécifique dans chacune des modalités d'imagerie.
- L'échographie a un rôle chez le polytraumatisé avec instabilité hémodynamique (« FAST » écho), pour la recherche et l'exploration des processus hémorragiques superficiels (hématomes musculaires) et certains saignements profonds.
- La TDM a une place essentielle pour la recherche et l'exploration des processus hémorragiques profonds (urgence +++).
- L'imagerie a un double rôle essentiel dans la prise en charge des hémorragies : 1) diagnostique – affirmer le saignement, le localiser, évaluer son importance, son ancienneté, son potentiel évolutif – ; 2) thérapeutique – prise en charge de la cause du saignement, notamment des techniques d'embolisation, procédures mini-invasives réalisées par voie percutanée.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 20 - Processus ischémiques
P.M. Walker et A. Redheuil
Plan du chapitre
- Ischémie : définition et mécanismes
- Imagerie des processus ischémiques
Objectifs
- Connaître les différents tableaux liés aux processus ischémiques en radiographie, TDM, IRM, échographie et médecine nucléaire.
- Connaître les avantages et limites des différentes modalités d'imagerie pour l'exploration des processus ischémiques.
- Connaître la séméiologie de l'ischémie dans les différentes modalités d'imagerie.
- Connaître les produits de contraste et les médicaments radiopharmaceutiques (MRP) utilisés en imagerie dans l'exploration de l'ischémie.
Ischémie : définition et mécanismes
L'ischémie est un état physiopathologique secondaire à un déficit d'oxygénation d'un tissu par inadéquation entre les apports et les besoins en oxygène. Elle résulte de l'interruption de tout ou partie de la circulation artérielle d'un organe ou d'une région le plus souvent par complication locale d'une plaque d'athérome (sténose serrée, thrombose, embolie ou dissection), dans un contexte favorisant l'athérosclérose (vieillissement, hypertension artérielle [HTA], diabète, dyslipidémie, tabagisme), ou à l'occasion d'une embolie artérielle d'origine cardiaque ou aortique.
L'ischémie peut également survenir lors de l'occlusion d'une veine (thrombophlébite cérébrale par exemple), dont il peut résulter une congestion, une hémorragie et un infarctus veineux. Les facteurs de risque des thromboses veineuses sont les états d'hypercoagulabilité (contexte postopératoire, alitement prolongé, grossesse ou post-partum, thrombophilie).
Quand l'ischémie est temporaire ou rapidement prise en charge, les dégâts sur l'organe ne sont pas permanents et les cellules ne sont pas détruites totalement. En revanche, en cas d'ischémie prolongée, les dommages sur l'organe sont irréversibles. La diminution de l'apport de sang artériel dans un organe ou un tissu entraîne, en effet, une baisse de son oxygénation et la perturbation, voire l'arrêt de sa fonction.
Ainsi, dans l'ischémie aiguë myocardique, l'accumulation de lactate dans le myocarde entraîne une diminution de ses capacités de contraction et de relaxation. Si elle est suffisamment grave et prolongée, l'ischémie peut conduire à un infarctus du myocarde, qui désigne la mort cellulaire.
Le phénomène ischémique est ubiquitaire, c'est-à-dire qu'il peut se produire dans tous les organes (tube digestif, rein, poumon et membres, en particulier inférieurs) ; toutefois, les ischémies aiguës les plus fréquentes intéressent le cerveau et le cœur.
Physiopathologie de l'ischémie cérébrale
Le cerveau, dépourvu de réserves d'oxygène et de glucose, est fortement dépendant des apports extérieurs en substrats énergétiques et, par conséquent, fortement dépendant du débit sanguin. Chez l'adulte, le débit sanguin cérébral normal est en moyenne de 50 mL/min/100 g de tissu cérébral. L'autorégulation permet de maintenir constant le débit sanguin cérébral pour les pressions de perfusion entre 50 et 150 mmHg. En dehors de ces valeurs, le débit sanguin cérébral est directement proportionnel à cette pression. En dépit de la mise en jeu de moyens de protection, une altération fonctionnelle du métabolisme cellulaire apparaît dès que le débit sanguin cérébral est inférieur à environ 20 mL/min/100 g de cerveau. En cas d'occlusion artérielle, on distingue un centre d'ischémie dense au sein duquel le débit sanguin est inférieur à 10 mL/min/100 g et, au pourtour, une zone de tissu avec un débit intermédiaire entre 10 et 20 mL/min/100 g. Cette zone, désignée sous le terme de pénombre ischémique, correspond à la partie du tissu cérébral ischémié où le débit sanguin est insuffisant pour maintenir un fonctionnement cellulaire normal, la survie cellulaire y demeurant cependant assurée dans un premier temps (figure 20.1). En deçà de 10 mL/min/100 g de cerveau, la zone d'oligémie maximale tolérable est atteinte. Si cet état d'oligémie se prolonge plus de quelques minutes, l'évolution se fait vers une mort cellulaire.
Représentation schématique de l'ischémie cérébrale montrant les phases d'apparition de l'oligémie, de la pénombre (ischémie réversible) et de la nécrose.
Imagerie des processus ischémiques
Il faut distinguer l'insuffisance artérielle chronique de l'insuffisance artérielle aiguë. Dans le cas de l'insuffisance artérielle chronique, la réduction du calibre artériel (induite le plus souvent par une plaque d'athérome) est à l'origine d'une inadéquation entre les besoins métaboliques de l'organe et l'apport artériel, le plus souvent asymptomatique en dehors de l'effort, dont l'expression est l'angor pour les coronaires, la claudication intermittente des membres inférieurs pour les artères des membres inférieurs ou la « claudication du grêle » pour l'artère mésentérique supérieure. Cette insuffisance artérielle est mise en évidence en imagerie ou en électrophysiologie lors d'épreuves d'effort ou de stress. Elle est parfois compensée par le développement d'une circulation collatérale si le processus sténosant apparaît progressivement. Cette collatéralité peut être mise en évidence en imagerie.
Dans le cas d'une occlusion artérielle aiguë, la symptomatologie est d'apparition brutale. Elle traduit soit une hypoperfusion d'organe, dont les conséquences sur la morphologie ou la fonction d'un organe sont généralement réversibles, soit une nécrose (infarctus constitué), qui est irréversible (voir encadré « Pour aller plus loin »). Le délai d'apparition des lésions irréversibles en cas d'ischémie aiguë varie en fonction de l'organe atteint et de la présence d'éventuelles voies de suppléance si l'épisode aigu survient dans un contexte d'insuffisance artérielle chronique. Ce délai est de l'ordre de 3 à 6 heures en fonction des organes atteints. La mise en œuvre des examens d'imagerie doit être rapide et, si elle oriente la prise en charge thérapeutique, elle ne doit pas la retarder.
L'imagerie a trois rôles principaux dans l'exploration d'un processus ischémique :
- affirmer l'existence d'une souffrance ischémique aiguë, la localiser, évaluer sa sévérité, son extension, sa cause et la dater (comme en cas d'AVC ischémique) devant un tableau clinique évocateur, d'installation aiguë (douleur thoracique, abdominale, déficit neurologique brutal et un terrain à risque) ;
- après un événement ischémique : faire le bilan de la sévérité des séquelles d'infarctus (zone d'ischémie irréversible, tissu non viable) et évaluer la viabilité et l'ischémie résiduelles ;
- prévenir la survenue de l'ischémie et de ses complications : c'est essentiellement le rôle des techniques d'imagerie vasculaire et des techniques fonctionnelles permettant de démasquer une insuffisance artérielle chronique.
L'imagerie permet d'évaluer, d'une part, la perfusion tissulaire, et d'autre part, les vaisseaux par des techniques distinctes (figure 20.2). L'exploration d'un processus ischémique est par conséquent souvent multimodale. Par exemple, lorsqu'un patient souffre d'un AVC, l'extension des lésions ischémiques du parenchyme cérébral est explorée préférentiellement en IRM ; les anomalies vasculaires causales (thrombus, sténose) sont explorées par échographie ou angiographie non invasive (TDM ou IRM). Enfin, si un traitement endovasculaire est possible, une angiographie invasive en radiologie interventionnelle (voir chapitre 15) permet, en fonction de la cause et du site de l'occlusion, de recanaliser le vaisseau occlus par thrombectomie, thrombolyse, angioplastie ou mise en place d'une endoprothèse (stent).
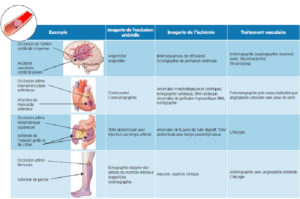
Illustration à partir de quatre exemples de l'exploration multimodale en imagerie des processus ischémiques.
En fonction des organes atteints et du degré d'urgence, l'une ou l'autre des techniques est privilégiée pour évaluer l'anatomie vasculaire d'une part, et le retentissement sur l'organe d'autre part.
Dessins : Cyrille Martinet.
Radiographie standard
La radiographie standard est très peu utile pour l'imagerie de l'ischémie. Une radiographie de thorax peut montrer une complication d'un infarctus du myocarde aigu sévère en mettant en évidence des signes d'œdème pulmonaire aigu que sont l'augmentation du contenu veineux pulmonaire (dilatation et redistribution vasculaire vers les sommets), la diffusion du liquide dans l'interstitium pulmonaire (syndrome interstitiel), voire une diffusion du liquide dans les alvéoles (syndrome alvéolaire). Cette technique d'imagerie n'a pas de place dans la visualisation directe de l'ischémie.
Angiographie X
Les techniques angiographiques utilisant les rayons X selon différents plans de l'espace sont très utiles pour explorer les artères grâce à l'injection intra-artérielle de produits de contraste iodés. Elles sont surtout utilisées à la phase aiguë des formes sévères d'ischémie ou en préalable à une intervention thérapeutique endovasculaire (revascularisation avec angioplastie et pose d'endoprothèse) (voir chapitre 15). L'opacification des artères permet d'identifier une occlusion artérielle, une sténose de la lumière artérielle, une dissection ou maladie artérielle sous-jacente comme un anévrisme. Une occlusion artérielle apparaît comme une interruption brutale de la progression du produit de contraste (exemple en figure 20.3). Des rétrécissements transitoires et fonctionnels de l'artère appelés « spasmes » peuvent également être visualisés. En cas d'occlusion artérielle, l'angiographie peut aussi mettre en évidence l'existence de branches artérielles collatérales permettant de compenser l'hypoperfusion.
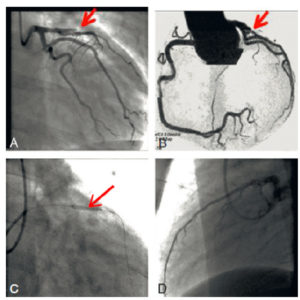
Occlusion d'une artère coronaire en angiographie.
A. Coronarographie sélective de l'artère coronaire gauche montrant une occlusion brutale de l'artère interventriculaire antérieure par un thrombus (flèche). B. L'occlusion était visible sur le coroscanner (flèche). C. Procédure de revascularisation coronaire par déploiement intracoronaire d'un stent monté sur ballon (flèche). D. Résultat final après désobstruction coronaire et mise en place d'un stent sur l'artère interventriculaire antérieure proximale.
TDM
La TDM permet de visualiser avec une grande précision les vaisseaux, mais aussi la perfusion des organes cibles. C'est un examen accessible en urgence et largement utilisé.
Une acquisition à un temps artériel précoce après l'injection de produit de contraste permet d'identifier un rehaussement très intense des structures vasculaires, et donc leur évaluation précise (figure 20.4). Ainsi, l'angio-TDM des troncs supra-aortiques permet d'estimer le degré de sténose d'une artère chez un patient asymptomatique présentant des facteurs de risque vasculaire. En ce qui concerne l'exploration des coronaires en TDM, une synchronisation de l'acquisition avec l'ECG est nécessaire (voir chapitre 26). Le coroscanner permet, de façon non invasive, d'analyser les sténoses, l'anatomie des coronaires, mais ne permet pas de geste endovasculaire contrairement à la coronographie. En revanche, contrairement à la coronarographie qui ne visualise que la lumière artérielle, le coroscanner permet une analyse de la paroi artérielle à la recherche d'athérome et de complications : thrombose, hématome, dissection.
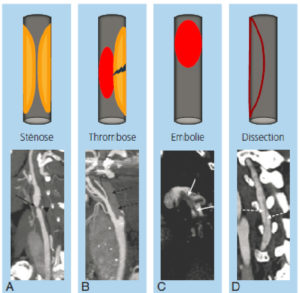
Aspects en angio-TDM des principaux types d'occlusion artérielle.
TDM réalisées après injection de produit de contraste au temps artériel avec reconstructions en mode MIP montrant la lumière artérielle (hyperdense) partiellement ou complètement oblitérée par une structure hypodense. A. Sténose carotidienne sévère (85 %) sur athérome (flèche noire) circonférentiel partiellement calcifié (tête de flèche). B. Thrombose complète de la carotide interne (flèches noires en pointillés). C. Embolie pulmonaire avec présence de thrombus hypodenses dans la lumière de l'artère pulmonaire gauche en vue sagittale (flèches blanches). D. Dissection d'une artère vertébrale avec visibilité du flap intimal dans la lumière artérielle (flèches blanches pointillées).
Une acquisition à un temps plus tardif, parenchymateux (au cours d'un même examen, sans injection supplémentaire), permet d'étudier la perfusion tissulaire de certains organes. Ainsi, en cas d'ischémie mésentérique, la TDM abdominopelvienne montre l'occlusion artérielle et l'état de la paroi des anses digestives du territoire artériel occlus qui peut aller d'un œdème, le plus souvent réversible (figure 20.5), à des lésions irréversibles comme l'absence de rehaussement de la paroi des anses digestives (figure 20.6), ou une nécrose des anses avec présence d'une pneumatose pariétale (présence d'air dans la paroi digestive).
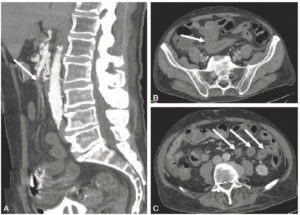
Homme de 74 ans, contexte de cholangiocarcinome intrahépatique. Douleurs abdominales intenses motivant la réalisation d'une TDM abdominale.
A. Images sagittales MIP au temps artériel précoce objectivant une occlusion complète de l'artère mésentérique supérieure (flèche). B, C. Les coupes axiales au temps portal montrent des anses jéjunales à paroi épaisse et hypodense (flèches), avec une prise de contraste persistante de la muqueuse. Il n'existe pas de signe de complication. Le taux de lactates sériques était normal, et le patient ne présentait pas de défaillance d'organe. Le tout correspond donc à une ischémie mésentérique aiguë d'origine artérielle embolique au stade précoce.
Remerciements au Dr Maxime Ronot.
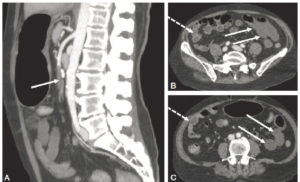
Homme de 58 ans. Douleurs abdominales intenses motivant la réalisation d'une TDM abdominale.
A. Images sagittales MIP au temps artériel précoce objectivant une occlusion complète de l'artère mésentérique supérieure (flèche). B, C. Les coupes axiales au temps portal montrent des anses jéjunales à paroi fine avec un défaut de rehaussement (flèches), comparé aux anses normales dans le flanc droit (flèches pointillées). Il n'existe pas de signe de complication, mais le taux de lactates sériques était à deux fois la valeur supérieure de la normale. Le tout correspond donc à une ischémie mésentérique aiguë d'origine artérielle embolique au stade tardif.
Remerciements au Dr Maxime Ronot.
Une TDM avec injection permet également de détecter la présence d'un réseau de vaisseaux collatéraux en cas de sténose chronique.
IRM
L'IRM est un examen d'imagerie médicale non invasif de référence pour la mise en évidence des processus ischémiques cérébraux et myocardiques. Elle fournit un bon contraste tissulaire spontané et, en association avec les produits de contraste gadolinés, des informations précieuses sur la perméabilité microvasculaire (souvent appelée perfusion) peuvent être récoltées.
L'exploration des conséquences sur le myocarde d'une sténose ou d'une occlusion coronaire en IRM se fait soit par l'étude de l'altération de la fonction contractile segmentaire du myocarde lors d'un stress pharmacologique inotrope (injection de dobutamine), soit par la mise en évidence d'une hypoperfusion relative dans le territoire d'une artère coronaire lors d'un stress pharmacologique vasodilatateur (régadénoson, adénosine ou dipyridamole). L'imagerie de l'infarctus du myocarde aigu (nécrose) ou chronique (séquelle fibreuse irréversible) se fait grâce à la mise en évidence d'un hypersignal tardif par rétention anormale du produit de contraste dans les zones concernées (sous-endocardique ou transmurale selon la sévérité) (figure 20.7). Lorsqu'il existe des zones au sein de la nécrose avec obstruction microvasculaire, on observe un hyposignal au sein de l'hypersignal adjacent par défaut de pénétration du produit de contraste (phénomène de « no reflow »). Par ailleurs, l'IRM est la technique de référence pour l'étude de la fonction systolique cardiaque et permet d'évaluer les conséquences fonctionnelles de l'ischémie ou de l'infarctus du myocarde en étudiant la contraction locorégionale du myocarde (hypokinésie, akinésie ou dyskinésie segmentaires), et d'évaluer la fonction globale par le calcul de la fraction d'éjection des ventricules droit et gauche. En revanche, l'analyse directe complète de la perméabilité des artères coronaires est insuffisante aujourd'hui en IRM ; sa résolution actuelle permet néanmoins de mettre en évidence une anomalie de naissance d'une artère coronaire.
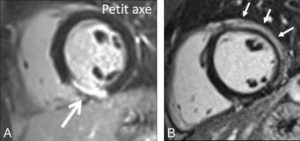
Séquences IRM de « rehaussement tardif » (imagerie T1) réalisée 10 minutes après injection d'un agent de contraste à base de chélates de gadolinium, montrant une séquelle de nécrose inféroseptale et inférieure du ventricule gauche dans le cadre d'un infarctus du myocarde (A) (flèche blanche large) atteignant l'endocarde, à différencier d'une myocardite aiguë latérale du ventricule gauche myocardite (B) (flèches blanches fines) où l'atteinte touche l'épicarde et préserve l'endocarde.
L'IRM est également une des modalités de choix pour la mise en évidence de l'ischémie cérébrale, car elle est capable de différencier les phases critiques telles que l'apparition de l'œdème cytotoxique, de l'œdème vasogénique et de la cavité porencéphalique. L'IRM de diffusion et de perfusion permet la distinction entre la pénombre et la nécrose. L'angio-IRM (réalisée sans injection de produit de contraste) apporte des renseignements sur la perméabilité des artères cérébrales (figure 20.8). Enfin, en cas de thrombophlébite cérébrale, l'IRM cérébrale permet de mettre en évidence des thromboses des sinus veineux cérébraux grâce également à des séquences d'angio-IRM veineuse, et d'apprécier le retentissement sur le parenchyme cérébral d'un éventuel infarctus veineux.
![Figure 20.8 IRM cérébrale à 2 heures de l'apparition d'un déficit hémicorporel gauche. Une cartographie du coefficient apparent de diffusion (A) et une image native de diffusion (B) montrent une zone d'ischémie limitée au territoire cérébral moyen (ou sylvien) profond (flèches blanches). L'image morphologique en pondération fluid-attenuated inversion recovery (FLAIR) dans le plan axial (C) au même niveau ne montre pas d'anomalie. L'angio-IRM (D) sans injection (3D-time of flight [TOF] en reconstruction MIP) montre une occlusion de l'artère cérébrale moyenne droite (flèche en pointillés). Remerciements au Pr Kremer.](https://www.cnp-mn.fr/wp-content/uploads/2023/01/Les-fondamentaux-20.8-225x300.jpg)
IRM cérébrale à 2 heures de l'apparition d'un déficit hémicorporel gauche.
Une cartographie du coefficient apparent de diffusion (A) et une image native de diffusion (B) montrent une zone d'ischémie limitée au territoire cérébral moyen (ou sylvien) profond (flèches blanches). L'image morphologique en pondération fluid-attenuated inversion recovery (FLAIR) dans le plan axial (C) au même niveau ne montre pas d'anomalie. L'angio-IRM (D) sans injection (3D-time of flight [TOF] en reconstruction MIP) montre une occlusion de l'artère cérébrale moyenne droite (flèche en pointillés).
Remerciements au Pr Kremer.
Échographie
L'échographie-Doppler est fondée sur l'étude du retour d'une onde ultrasonore modifiée après passage à travers les tissus explorés. Elle n'est pas irradiante, est facilement disponible au lit du malade, mais peut être non exhaustive chez certains patients peu échogènes. Elle représente l'examen de première ligne indispensable dans les explorations cardiaques et vasculaires périphériques. En pathologie ischémique cardiaque, l'échographie montre les anomalies de contraction segmentaires (figure 20.9) et évalue la fonction cardiaque globale par le calcul de la fraction d'éjection. Toutefois, elle ne permet pas l'analyse directe des artères coronaires (en dehors du tronc coronaire commun en échographie transœsophagienne), ni de la perfusion myocardique. Elle permet de détecter des complications de l'ischémie telles qu'une communication interventriculaire ou un épanchement péricardique.
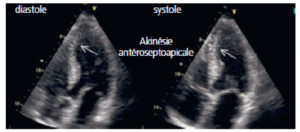
Échographie du cœur dans le plan 4 cavités montrant un segment du septum interventriculaire apical dont l'épaississement en systole est insuffisant (flèche), définissant une hypokinésie à ce niveau.
Il s'agit de la conséquence fonctionnelle ici d'un infarctus du myocarde antéro-septo-apical incomplet. En revanche, l'échographie ne permet pas ici, contrairement à l'IRM, une caractérisation tissulaire.
L'échographie-Doppler des vaisseaux périphériques permet de visualiser directement la sténose ou le thrombus, que ce soit à la phase aiguë ou à un stade asymptomatique. Elle est réalisable pour l'exploration des artères des membres inférieurs et supérieurs, des troncs supra-aortiques au niveau cervical et des artères rénales. Le Doppler pulsé permet d'évaluer le degré de sévérité d'une sténose artérielle en fonction du retentissement hémodynamique en aval de l'obstruction.
L'utilisation de produit de contraste ultrasonore (microbulles) peut permettre de mettre en évidence une zone d'hypoperfusion parenchymateuse en cas d'occlusion artérielle du territoire correspondant.
Médecine nucléaire
Deux approches sont possibles en médecine nucléaire pour explorer l'ischémie :
- utiliser des traceurs ou MRP permettant d'évaluer la perfusion d'un organe ou d'un tissu, sachant qu'une diminution de la perfusion est le plus souvent la cause de l'ischémie ;
- évaluer les conséquences de la survenue d'une ischémie, comme l'hypoxie cellulaire, ou certaines modifications métaboliques.
Exploration de la perfusion tissulaire
Le traceur « idéal » pour l'étude de la perfusion tissulaire est l'eau marquée à l'oxygène-15 (H215O) qui, comme l'eau non marquée, diffuse librement dans tous les compartiments de l'organisme proportionnellement aux débits sanguins locaux. L'H215O étant un émetteur de positons, il est donc possible de réaliser une imagerie et de quantifier la distribution de ce traceur avec de la TEP. Cependant, la période radioactive très courte de l'H215O (2 minutes) rend son utilisation très difficile (injection et acquisition réalisées simultanément, nécessité d'un cyclotron à proximité) ; ce traceur n'est donc pas utilisé en routine.
D'autres MRP plus simples d'utilisation ont été développés ; ils sont en revanche spécifiques d'un organe :
- pour le cœur, il s'agit le plus souvent de cations lipophiles (99mTc-tétrofosmine et 99mTc-sestamibi) qui vont s'accumuler et rester piégés dans les cardiomyocytes ; il est donc possible d'acquérir les images à distance de l'injection. On réalise le plus souvent les acquisitions d'images au repos et après un effort afin d'appréhender les éventuelles différences de perfusion myocardique entre l'effort (ou le stress) et le repos (figure 20.10) ;
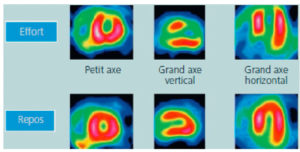
Images TEMP au 99mTc-sestamibi montrant un cas d'ischémie myocardique aux phases d'effort (ou stress) et de repos.
- pour le cerveau, il s'agit également de molécules lipophiles qui vont traverser la membrane hémato-encéphalique et s'accumuler dans les neurones : le 99mTc-éthylène cystéine dimère (ECD) et le 99mTc- HMPAO. Une fois dans le cytoplasme, ils sont convertis en composés hydrophiles et restent donc piégés (voir chapitre 23).
L'accumulation de ces MRP est relativement proportionnelle aux débits sanguins régionaux. Ils sont utilisés en scintigraphie conventionnelle et il n'est donc pas possible de quantifier précisément leur fixation, mais seulement de manière relative (voir chapitre 5). Cependant, du fait de leur disponibilité et de leur facilité d'usage, ils sont très utilisés en routine.
Exploration des conséquences de l'ischémie : l'hypoxie cellulaire
Certains traceurs comme le 18F-FMISO (fluoromisonidazole) s'accumulent spécifiquement dans le cytoplasme des cellules hypoxiques. Ce dernier peut être utilisé, par exemple, pour mettre en évidence des zones de pénombre en cas d'AVC (figure 20.11) ou en oncologie pour mettre en évidence des zones ischémiques dans les tumeurs, qui sont généralement plus résistantes à certains traitements. Cependant, son utilisation en routine reste encore à préciser.
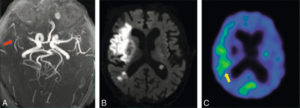
IRM et TEP 18F-FMISO dans le cas d'un AVC à J30.
L'angio-IRM (A) montre une revascularisation partielle (flèche rouge) et la TEP (C) indique une absence de fixation du traceur dans la zone hyperintense en DWI (B). Néanmoins, une fixation du traceur est visible (flèche jaune), postérieure à la lésion, et évoque une possible hypoxie persistante.
Source : Takasawa M, Reda Moustafa R, Baron JC. Applications of nitroimidazole in vivo hypoxia imaging in ischemic stroke. Stroke 2008;39 :1629–37. © Wolters Kluwer 2008.
L'ischémie entraîne également des désordres métaboliques comme dans les cardiomyocytes avec le passage d'un métabolisme aérobie (bêta-oxydation des acides gras) à une prédominance de la glycolyse anaérobie. Ce basculement métabolique peut être mis en évidence avec la TEP au 18F-FDG, un analogue du glucose qui va donc s'accumuler préférentiellement dans le myocarde ischémique par rapport au myocarde normal.
Essentiel à retenir
- L'imagerie permet d'affirmer l'existence d'une souffrance ischémique aiguë et d'établir une cartographie des tissus infarcis, c'est-à-dire non viables, et des tissus ayant un potentiel de récupération si une reperfusion est envisageable.
- La prise en charge en imagerie d'un processus ischémique est le plus souvent multimodale, en fonction des organes atteints, et tient compte du degré d'urgence de l'intervention. Elle repose essentiellement sur les techniques angiographiques en angio-TDM, en angio-IRM et en angiographie X pour visualiser l'obstruction vasculaire, et sur l'IRM, la TDM et la scintigraphie, pour l'évaluation du retentissement sur le parenchyme.
- En médecine nucléaire, il est possible d'évaluer la perfusion d'un organe ou d'un tissu ainsi que l'hypoxie cellulaire, voire certaines modifications métaboliques.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 19 - Processus infectieux
C. Blondet et G. Bierry
Plan du chapitre
- Introduction
- Phase initiale : œdème
- Phase d'état : abcès
- Phase séquellaire : modifications structurelles
- Médecine nucléaire
Objectifs
- Connaître les différents aspects d'une infection débutante en radiographie, TDM, IRM et échographie.
- Connaître les avantages et limites des différentes modalités d'imagerie en pathologie infectieuse.
- Connaître la séméiologie de l'œdème et de l'abcès avec les différentes modalités d'imagerie.
- Connaître les MRP utilisés en médecine nucléaire dans l'exploration de l'infection.
Introduction
L'infection entraîne d'abord des modifications inflammatoires non spécifiques avec augmentation de l'eau extracellulaire (œdème) et infiltration de cellules inflammatoires, puis des altérations structurelles du tissu atteint.
L'imagerie médicale n'est pas encore capable en routine de démontrer directement la présence des agents pathogènes, mais peut montrer des signes indirects :
- un œdème (phase initiale), présent dans toute réaction inflammatoire, et non spécifique de l'infection ;
- un abcès formé par les tissus lésés et les cellules dégradées (phase d'état) ;
- des modifications structurelles (phase séquellaire).
Toutefois, elle peut révéler l'infiltration précoce des cellules inflammatoires (leucocytes) grâce à des traceurs (MRP) en médecine nucléaire.
Phase initiale : œdème
L'œdème peut se résumer à une augmentation de la quantité de l'eau extracellulaire dans les tissus. C'est la première manifestation de l'infection, sans être toutefois spécifique. Plus une technique d'imagerie est efficace pour montrer cet œdème, plus elle est capable de révéler les phases initiales d'infection. On parle de sensibilité : certaines techniques comme l'IRM sont très sensibles pour montrer l'œdème, alors que les radiographies le sont moins.
Radiographies
Les radiographies sont capables de différencier les tissus en les classant selon quatre grandes familles de densité : hydrique (eau, organes pleins, muscles), aérique (air, tissu pulmonaire), graisseuse et osseuse (ou calcifiée) (voir chapitre 3).
Comme l'eau extracellulaire a par définition une densité hydrique, son augmentation est donc plus facile à détecter dans les tissus ayant une densité de base non hydrique (poumon, os) que dans ceux ayant une densité spontanée proche de l'eau (muscles, foie, rein, etc.). De même, l'eau extracellulaire peut prendre la place du tissu graisseux, qui, s'il n'est pas lui-même un organe à proprement parler, enveloppe et ainsi délimite les autres organes. Le remplacement de la densité de la graisse par celle de l'eau est donc un reflet de la présence d'un œdème dans l'organe adjacent.
Parallèlement, l'œdème entraîne un gonflement des structures atteintes, dont la taille va augmenter. Ainsi, même si les modifications de densité sont discrètes, cette augmentation de taille peut révéler la présence d'un œdème dans le tissu concerné.
Infections des tissus mous et des organes pleins
Les radiographies sont peu sensibles pour la détection de l'œdème dans les tissus mous (muscles, peau) et les organes pleins (foie, rein, etc.). Ainsi, le signe le plus intéressant et le plus facile à détecter est une augmentation de la taille, notamment de l'épaisseur du tissu atteint. Le deuxième signe est l'effacement du tissu graisseux entourant les organes et tissus du fait de la densité hydrique de l'eau extracellulaire.
Infection osseuse
Les radiographies montrent une diminution de la densité des os : on parle de déminéralisation (figure 19.1). Cependant, cette déminéralisation apparaît tardivement par rapport au début des manifestations cliniques. Les radiographies sont ainsi peu sensibles pour la détection des infections débutantes.
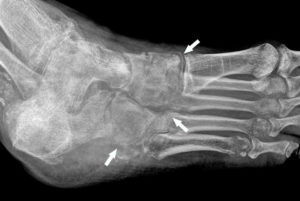
Déminéralisation infectieuse du médio-pied en radiographie.
Radiographie oblique du pied droit chez un patient avec une arthrite septique montrant une diminution diffuse de la densité du médio-pied par rapport aux métatarses (flèches) et une mauvaise visualisation des contours des os (perte de définition de l'os cortical).
Infection des tissus pulmonaires
L'infection pulmonaire est, de toutes les infections, celle qui est la mieux visible en radiographie car la densité du poumon normal est très basse (aérique, c'est-à-dire proche de celle de l'air). L'œdème et l'infiltrat fibrino-leucocytaire vont remplacer la densité aérique par une densité hydrique, et comme la différence entre les deux densités est importante, l'œdème sera relativement aisé à reconnaître sous forme d'une opacité (figure 19.2).
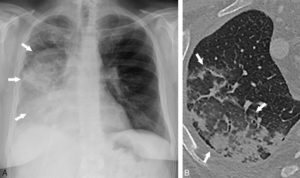
Pneumopathie infectieuse droite.
Radiographie de face (A) et TDM thoracique en coupe axiale (B) montrant des opacités parenchymateuses liées au remplissage des alvéoles par l'œdème (flèches). Le contraste spontané entre air et œdème (densité hydrique) permet la visualisation directe des anomalies pulmonaires aussi bien en radiographie qu'en TDM.
TDM
La TDM repose sur le même principe que la radiographie, mais elle est plus sensible car il s'agit d'une acquisition en coupes et non en projection : elle peut détecter des modifications de densité plus faibles.
La TDM est notamment supérieure pour voir l'œdème dans les tissus ayant une densité naturelle de type hydrique (organes pleins, muscles, tissus mous, etc.) : l'œdème apparaît alors hypodense (figure 19.3).
Appendicite en TDM.
TDM abdominale avec injection de produit de contraste montrant un appendice œdématié, élargi (flèche) avec une infiltration de la graisse adjacente, qui apparaît floue et mal limitée (tête de flèche).
Dans le poumon, l'œdème apparaît sous forme d'une zone de densité supérieure au parenchyme adjacent mal limité (voir figure 19.2). Dans les os, l'œdème entraîne une déminéralisation, c'est-à-dire une densité inférieure à celle de l'os adjacent.
IRM
L'IRM est l'examen d'imagerie médicale de référence pour la détection des modifications de quantité et de distribution de l'eau. Comme l'IRM est très sensible pour la détection de l'œdème, c'est l'examen non isotopique qui montrera le premier les signes débutants de l'infection (figure 19.4). Un tissu œdématié a un signal IRM se rapprochant de celui de l'eau (hyposignal T1, hypersignal T2).
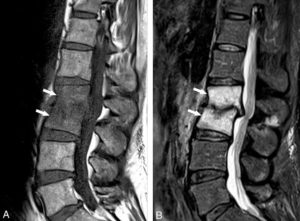
Infection discovertébrale (spondylodiscite infectieuse) L3/L4.
IRM en coupe sagittale en séquence T1 (A) et T2 (B). L'œdème vertébral leur donne un hyposignal en T1 et un hypersignal T2 (flèches). L'atteinte de deux corps vertébraux adjacents d'un disque avec la présence d'érosions est évocatrice de spondylodiscite infectieuse.
Échographie
Le tissu œdématié apparaît hypoéchogène (voir chapitre 18). Par ailleurs, l'échographie permet une analyse fonctionnelle directe : l'augmentation de la vascularisation associée à la réaction inflammatoire peut être mise en évidence par le Doppler.
Phase d'état : abcès
Un abcès est une poche liquidienne néoformée dans un tissu infecté, composée d'agents pathogènes et de leucocytes détruits. L'apparition d'un abcès est la confirmation de la nature infectieuse d'un processus pathologique.
Radiographies
Les radiographies sont limitées à la détection des abcès pulmonaires où ils apparaissent comme des opacités dans le parenchyme pulmonaire.
TDM
La TDM montre une formation généralement arrondie, de densité liquidienne. L'abcès est limité par une couronne inflammatoire. L'injection de produit de contraste rehausse cette couronne très vascularisée alors que le centre liquidien reste inchangé : prise de contraste (ou rehaussement) annulaire ou périphérique, caractéristique de l'abcès.
Échographie
L'abcès des parties molles est reconnu en échographie (s'il n'est pas trop profond) comme une formation arrondie hypoéchogène (noir).
IRM
L'abcès apparaît sous forme d'une lésion arrondie en hyposignal T1 et hypersignal T2 (figure 19.5). Comme en TDM, l'injection de produit de contraste permet de sensibiliser sa détection : sur une séquence T1 après injection, le centre liquidien reste en hyposignal, alors qu'il existe un rehaussement périphérique.
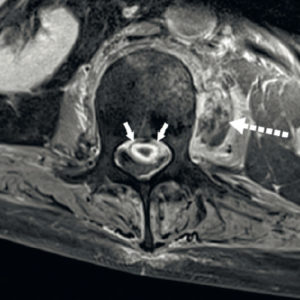
Abcès dans l'espace épidural suite à une spondylodiscite infectieuse en IRM.
Coupe IRM axiale en séquence T1 avec injection de produit de contraste montrant une formation nodulaire avec un centre en hyposignal (cavité liquidienne) et une prise de contraste périphérique en anneau (flèches) typique d'un abcès ; un autre abcès est visible en paravertébral à gauche (flèche pointillée).
Phase séquellaire : modifications structurelles
Les modifications structurelles sont des altérations des organes liées à l'action destructrice des agents pathogènes, survenant après ou simultanément à l'œdème. Ces modifications sont plus ou moins irréversibles, selon les capacités de récupération des tissus. Les modifications des tissus mous sont ainsi le plus souvent transitoires et d'aggravation progressive (œdème simple puis formation d'un abcès). Elles peuvent néanmoins être définitives dans les tissus à faible capacité de récupération comme les tissus osseux ou cartilagineux. Ainsi, ces modifications structurelles sont souvent des séquelles définitives.
Radiographies et TDM
Les modifications structurelles ont le même aspect en radiographie et en TDM ; cette dernière est cependant plus performante.
Atteintes osseuses
Les modifications structurelles les plus fréquemment observées en radiographie sont les atteintes osseuses.
Les os infectés apparaissent initialement déminéralisés puis détruits sur une plage plus ou moins grande ; on parle d'ostéolyse. Ces modifications sont non spécifiques de l'infection et peuvent se voir également dans les atteintes inflammatoires non infectieuses.
Des zones d'os mortifiés sont visibles sur le site infectieux sous la forme de fragments osseux très denses ; on parle de séquestres.
Dans les infections articulaires, la destruction du cartilage se manifeste par un pincement de l'interligne articulaire. Les ostéolyses autour des interlignes articulaires s'appellent des érosions, qui sont des zones de résorption secondaire à une atteinte articulaire (par exemple une arthrite septique) (figure 19.6).
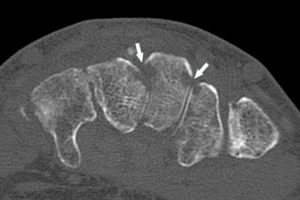
Érosions osseuses en TDM.
TDM du poignet (coupe axiale) montrant des ostéolyses focales (flèches) chez un patient avec une arthrite septique.
Atteintes pulmonaires
Après une infection, il est fréquent que le poumon ne récupère pas un volume normal. Des adhérences se sont formées dans les lobes et empêchent l'ampliation complète. Des plages de poumon collabé forment ainsi des bandes cicatricielles (atélectasies cicatricielles). Des calcifications cicatricielles peuvent être présentes.
Atteinte des tissus mous
Les tissus mous, mieux vascularisés, ont une meilleure capacité de récupération que les os et les poumons. Les principales séquelles sont des atrophies parenchymateuses focales ou diffuses, ou des rétractions ou oblitérations de canaux (voies biliaires, tube digestif, etc.). Des calcifications cicatricielles peuvent également être présentes.
IRM
Les modifications structurelles visibles en IRM sont de deux types :
- zones d'atrophie et/ou d'adhérence ;
- fibrose (ou sclérose) tissulaire en hyposignal T1 et T2 car la zone séquellaire est déshydratée.
Médecine nucléaire
Parmi les médicaments radiopharmaceutiques (MRP) disponibles, certains sont généralistes et montrent la distribution de cellules impliquées dans la composante inflammatoire des processus infectieux : le gallium 67 (67Ga), historique, le 18F-FDG, les leucocytes autologues marqués au 99mTc-HMPAO, au 111In-oxinate, voire au 18F-FDG, et les anticorps antigranulocytaires marqués (99mTc-sulesomab ou 99mTc-besilesomab). Quand la demi-vie d'un traceur généraliste le permet (marquage des leucocytes au 99mTc-HMPAO ou au 111In-oxinate en particulier), le recueil de sa distribution tardive (24 heures après injection) reflète plus spécifiquement un processus infectieux évolutif qu'une inflammation non septique : les leucocytes s'accumulent durablement dans un site infecté alors qu'ils ne sont recrutés que transitoirement à l'occasion d'un processus inflammatoire.
D'autres MRP ont une forte spécificité tissulaire et sont utilisés afin de caractériser les conséquences précoces et/ou tardives de l'infection sur un tissu. C'est le cas du 99mTc-HMDP, traceur ostéotrope (hyperfixation signant la reconstruction en périphérie d'une ostéite) et du 99mTc-DMSA, traceur du cortex rénal (lacune de fixation si séquelle de pyélonéphrite).
Médicaments radiopharmaceutiques généralistes (18F-FDG, leucocytes marqués, 67Ga)
Communs avec l'exploration de l'inflammation, les MRP non spécifiques ont les caractéristiques suivantes :
- le 18F-FDG traduit l'hypermétabolisme glucosé des cellules impliquées dans les phénomènes inflammatoires ou infectieux ;
- les leucocytes marqués (soit in vitro, soit in vivo par des anticorps) se distribuent dans les sites de recrutement des cellules de la lignée blanche ;
- le citrate de 67Ga s'accumule principalement dans les macrophages.
En cas de suspicion clinique ou biologique d'infection évolutive, ces MRP décèlent la mobilisation cellulaire en rapport (figure 19.7), y compris si l'infection évolue à bas bruit, situation fréquente au contact du matériel prothétique orthopédique (prothèses totales de hanche ou de genou). Notons l'intérêt du 18F-FDG dans les suspicions d'endocardites, notamment sur valve prothétique ou matériel intracardiaque de stimulateur (voir figure 19.7).
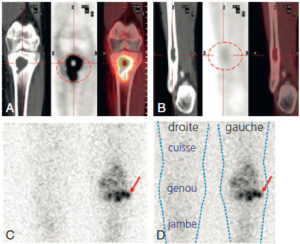
MRP généralistes.
A, B. TEP-TDM au 18 F-FDG. Ostéomyélite bifocale avec récidive infectieuse chez un enfant. Intense consommation cellulaire de glucose en périphérie de la lacune osseuse de la métaphyse tibiale supérieure gauche (cercle), signant l'évolutivité de l'ostéomyélite à ce niveau (A). Le coté controlatéral (B) ne montre pas de reprise évolutive avec une lacune osseuse séquellaire (cercle). C, D. Scintigraphie aux leucocytes marqués (111In-oxinate). Infection de prothèse totale de genou avec accumulation de leucocytes marqués en périphérie de la pièce tibiale de la prothèse (flèche, vue antérieure). E, F. TEP-TDM au 18 F-FDG. Endocardite infectieuse sur prothèses mécaniques valvulaires mitrale et aortique. E. Intense hypermétabolisme glucosé (flèche) au niveau des prothèses mécaniques (ellipse rouge). F. Embolie septique à distance (flèche) dans le parenchyme pulmonaire.
Médicaments radiopharmaceutiques à spécificité tissulaire
Ces MRP sont particulièrement utilisés dans la recherche d'infections évolutives ou de séquelles fonctionnelles d'infection, notamment en pédiatrie.
Traceur ostéotrope : 99mTc-HMDP
L'acquisition précoce (5 minutes après injection) révèle l'hyperhémie des régions infectées, liée à l'inflammation inhérente.
L'acquisition tardive (3 à 5 heures après injection) révèle l'augmentation d'activité des ostéoblastes liée à la reconstruction osseuse qui accompagne la destruction induite par l'infection ; ce temps tardif caractérise par exemple une ostéomyélite (figure 19.8A) ou le descellement septique d'une prothèse ostéoarticulaire. Chez l'enfant, l'infection osseuse, d'origine hématogène, touche préférentiellement la métaphyse, très vascularisée.
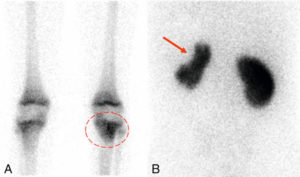
MRP spécifiques.
A. Scintigraphie osseuse au 99mTc-HMDP. Ostéomyélite tibiale chez un enfant : hyperfixation relative sur la métaphyse tibiale supérieure gauche (entourée, vue antérieure). À noter : la fixation du traceur osseux est également accentuée physiologiquement dans l'ensemble des cartilages de conjugaison. B. Scintigraphie rénale au 99mTc-DMSA. Séquelle fonctionnelle de pyélonéphrite : lacune de fixation corticale supéro-externe du rein gauche (flèche, vue postérieure).
Traceur du cortex rénal : 99mTc-DMSA
De 3 à 6 heures après injection de 99mTc-DMSA, seul le cortex rénal fonctionnel fixe le traceur. Une lacune corticale de fixation suggère donc une infection aiguë ou une séquelle fonctionnelle de pyélonéphrite (figure 19.8B).
Essentiel à retenir
- L'imagerie est peu spécifique et il est parfois difficile de distinguer une infection d'une inflammation non infectieuse.
- À la phase précoce, les signes indirects sont l'œdème et un épanchement, libre ou dans une cavité séreuse, identifié selon la localisation anatomique par IRM, radiographie, TDM ou échographie.
- L'abcès est une manifestation plus spécifique de l'infection avec un centre liquidien et une couronne vascularisée, prenant le contraste aussi bien en IRM qu'en TDM.
- À la phase tardive, des modifications séquellaires sont présentes avec altérations permanentes de la forme et de la structure du tissu atteint.
- Quelle que soit la phase d'évolution de l'infection, la médecine nucléaire utilise des MRP révélant la présence de cellules impliquées dans l'infection (leucocytes) et/ou des MRP caractérisant la dysfonction du tissu atteint.
 |
Chapitre suivant |
 |
Retour https://www.cnp-mn.fr/les-fondamentaux-de-limagerie-medicale-acces-public/au sommaire |
Les fondamentaux - Chapitre 18 - Processus inflammatoires
G. Bierry , C. Blondet et F. Besson
Plan de l'article
- Physiopathologie de l'inflammation
- Phase initiale : œdème
- Phase séquellaire : fibrose
- Médecine nucléaire
Objectifs
- Comprendre les bases physiopathologiques des modifications inflammatoires visibles en imagerie médicale.
- Connaître les différents aspects d'une lésion inflammatoire en radiographie conventionnelle, tomodensitométrie (TDM), imagerie par résonance magnétique (IRM), échographie.
- Connaître les médicaments radiopharmaceutiques (MRP) utilisés en médecine nucléaire, notamment en tomographie par émission de positons (TEP) dans l'exploration de l'inflammation.
- Connaître les avantages et limites des différentes modalités d'imagerie pour l'exploration des anomalies inflammatoires.
Physiopathologie de l'inflammation
L'inflammation est la réponse physiologique d'un tissu vivant vascularisé à une agression (infection, traumatisme, corps étranger, allergie, auto-immunité, etc.) dans le but de limiter l'agression et de permettre la réparation tissulaire. Ce processus comprend des phénomènes généraux (syndrome inflammatoire biologique, fièvre, altération de l'état général) et des phénomènes locaux.
Au niveau local, la réaction inflammatoire est un processus dynamique combinant des modifications de l'espace extracellulaire et une infiltration cellulaire. Le flux sanguin artériolaire locorégional et la perméabilité capillaire augmentent, ce qui entraîne une extravasation de plasma depuis l'espace intravasculaire vers l'espace extracellulaire : c'est l'œdème tissulaire. Cliniquement, cet œdème se manifeste par une augmentation de taille, un aspect rougeâtre en superficie, une augmentation de la chaleur locale et une douleur (tumor, rubor, calor, dolor). Parallèlement, des cellules sont recrutées et/ou activées sur le site inflammatoire. Dans les premières heures, les polynucléaires neutrophiles sont les leucocytes prépondérants, relayés ensuite par les monocytes et lymphocytes pour circonscrire l'agression. Les cellules sont extraites de la lumière vasculaire pour pénétrer dans les tissus par diapédèse. Ensuite, les tissus sont nettoyés par les polynucléaires et surtout les macrophages pour permettre la cicatrisation ad integrum. En cas de réparation incomplète ou insuffisante, la réaction inflammatoire peut devenir chronique. Parfois, quand la réparation ad integrum n'est pas possible, le tissu original est remplacé par de la fibrose.
Pour détecter des zones inflammatoires, l'imagerie médicale non isotopique (radiographie, TDM, IRM ou échographie) va chercher à mettre en évidence les modifications extracellulaires, et surtout l'œdème tissulaire et l'hypervascularisation. La médecine nucléaire va permettre d'identifier la présence et la distribution des cellules inflammatoires.
Phase initiale : œdème
Avec la douleur, l'œdème est la première manifestation cliniquement évidente de l'inflammation. Le but de l'imagerie est de détecter cet œdème, signe de l'inflammation, soit pour confirmer la suspicion clinique (dans la majorité des cas), soit pour le mettre en évidence avant l'apparition des signes cliniques, ou dans des zones d'exploration difficiles ou profondes (cavité abdominale par exemple).
Plus une technique d'imagerie est capable de détecter précocement l'œdème, et donc de révéler les phases initiales d'une atteinte inflammatoire, plus elle est sensible.
Par ordre décroissant de sensibilité, on retrouve l'IRM (très sensible), la TDM et l'échographie (moyennement sensibles) et les radiographies standard (peu sensibles).
Radiographies
Les radiographies révèlent les différences de densité des tissus mais ne peuvent les différencier visuellement qu'en quatre grandes familles de densité :
- aérique (air, tissu pulmonaire) ;
- graisseuse ;
- hydrique (eau, épanchement, organes pleins, muscles, etc.) ;
- osseuse (ou calcifiée).
Les interfaces entre des tissus de densités différentes forment des lignes visibles sur les radiographies (par exemple la corticale osseuse limitée par la densité hydrique des parties molles, ou le rebord du cœur limité par la densité aérique des poumons). L'œdème (eau extracellulaire) est visible soit par modification de la densité du tissu inflammatoire, soit par déplacement des tissus adjacents qui ont une autre densité.
L'œdème a, par définition, une densité hydrique ; sa présence est plus facile à détecter dans les tissus ayant une densité de base non hydrique (poumon, os) que dans ceux ayant une densité spontanée proche de l'eau (muscles, foie, rein, etc.). Par ailleurs, le tissu inflammatoire augmente de volume et va déplacer les tissus environnants : les lignes créées par les interfaces (liquide/graisse ; liquide/air, etc.) sont déplacées.
Inflammation des tissus mous et des organes pleins
Comme cela a été décrit plus haut, les radiographies sont relativement peu sensibles pour la détection de l'œdème dans les tissus mous (muscles, peau) et les organes pleins (foie, rein, etc.) qui ont une densité radiographique de base « hydrique ».
Il faut plutôt rechercher une augmentation de la taille du tissu/organe atteint, souvent seulement détectable par le déplacement des interfaces avec les tissus environnants (s'ils ont des densités différentes) (figure 18.1).
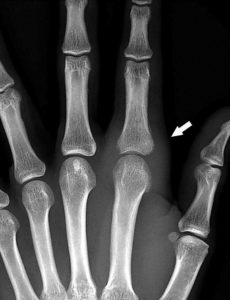
Radiographie conventionnelle de la main montrant un épaississement des tissus mous (flèche) chez une patiente ayant une atteinte inflammatoire (polyarthrite rhumatoïde) de l'articulation métacarpophalangienne de l'index.
Inflammation osseuse
L'augmentation de l'eau extracellulaire dans les os va faire diminuer leur densité (on passe d'une densité osseuse à une densité plus hydrique). Les os apparaissent moins denses ; on parle de déminéralisation (figure 18.2).
Radiographie conventionnelle du poignet montrant une déminéralisation inflammatoire (dite « en bande ») (flèches) chez une patiente ayant une atteinte inflammatoire (polyarthrite rhumatoïde) du carpe.
Ces modifications sont cependant très tardives, très en retard sur la clinique : les radiographies sont ainsi peu sensibles pour la détection des inflammations osseuses débutantes ; l'IRM est préférable.
Inflammation pulmonaire
L'inflammation du tissu pulmonaire entraîne, dans la majorité des cas, la formation d'un transsudat/exsudat (œdème pulmonaire) dans les alvéoles pulmonaires.
Dans les poumons, l'œdème est relativement aisé à voir en radiographie car la densité du poumon est très basse (aérique, c'est-à-dire celle de l'air). L'œdème va remplacer la densité aérique par une densité hydrique, et comme la différence entre les deux densités est importante, l'œdème sera relativement aisé à reconnaître. Une augmentation de la densité dans le poumon est appelée une opacité.
Séreuses
Les atteintes inflammatoires des séreuses (plèvre, péricarde, péritoine, synoviale) se manifestent précocement par un épanchement, sous la forme d'une formation de tonalité hydrique.
TDM
Comme les radiographies, la TDM utilise des rayons X comme source de rayonnement ; le raisonnement sur les densités est ainsi le même que pour les radiographies. La TDM réalise cependant des acquisitions en coupes et non en projection ; elle est ainsi plus sensible que la radiographie et peut détecter des modifications inflammatoires plus précoces et/ou difficiles à voir.
La TDM est notamment plus performante que la radiographie pour démontrer l'œdème dans les tissus ayant une densité naturelle de type hydrique (organes pleins, muscles, tissus mous, etc.). Dans ces tissus, l'œdème forme une zone de moindre densité ; on parle d'une zone hypodense ou d'hypodensité. Les épanchements sont hypodenses, de façon identique à l'eau. L'injection de produit de contraste iodé par voie intravasculaire entraîne une augmentation du contraste (hyperdensité dans le tissu inflammatoire) en raison des modifications vasculaires (angiogenèse, modifications de perméabilité) : on parle de prise de contraste ou de rehaussement.
Un autre signe très important et souvent plus évident à repérer est la modification du contraste habituel du tissu graisseux. À l'état normal, la graisse apparaît « propre » en TDM : noire, homogène, bien limitée. L'inflammation induit un aspect flou et une augmentation hétérogène de sa densité (figure 18.3).
TDM abdominale avec injection de produit de contraste chez un jeune patient ayant une atteinte inflammatoire colique (maladie de Crohn) montrant un épaississement et une prise de contraste de la paroi colique (tête de flèche) et une infiltration de la graisse périphérique (flèches).
IRM
L'IRM est l'examen d'imagerie de référence pour la détection des modifications de quantité et de distribution de l'eau. Elle est donc très sensible pour la détection de l'œdème ; c'est l'examen d'imagerie médicale non isotopique le plus performant pour détecter les phases précoces d'une réaction inflammatoire (figure 18.4).
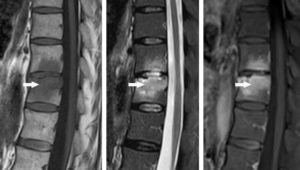
IRM de la colonne vertébrale (séquences sagittales T1, T2 et T1 avec injection d'agent de contraste) montrant une atteinte inflammatoire des vertèbres T11 et T12 (flèches) chez un patient ayant une atteinte inflammatoire de type spondylarthrite ankylosante : aspect caractéristique de l'inflammation en hyposignal T1, hypersignal T2 avec un rehaussement en T1 après injection d'agent de contraste.
Un tissu œdématié a un signal IRM qui se rapproche de celui de l'eau : plus noir en T1 – on parle d'hyposignal ou d'hypo-intensité – ; plus blanc en T2 – on parle d'hypersignal ou d'hyperintensité.
L'injection par voie intraveineuse de produit de contraste à base de gadolinium produit une augmentation du contraste (hypersignal) sur la séquence T1 du tissu inflammatoire ; comme en TDM, il s'agit d'une prise de contraste ou d'un rehaussement (voir figure 18.4).
Échographie
L'échographie est un examen très performant pour détecter les atteintes inflammatoires dans les zones explorables (tissus superficiels, zone abdominopelvienne chez les sujets minces ou les enfants). L'accumulation d'eau extracellulaire dans le tissu œdématié réduit son échogénicité ; il apparaît plus hypoéchogène (plus noir) que le tissu normal. Un épanchement dans une séreuse apparaît en échographie comme une formation fortement hypoéchogène, identique à l'eau : on parle d'aspect anéchogène (figure 18.5).
Échographie montrant un épanchement (anéchogène) dans l'articulation du genou (flèche) dans le contexte d'une inflammation de la synoviale.
Un autre avantage important de l'échographie est la possibilité d'une étude fonctionnelle directe par application de la technique Doppler (écho-Doppler). Elle met directement en évidence l'hypervascularisation tissulaire de la réaction inflammatoire (hypersignal Doppler) (figure 18.6).
Échographie avec Doppler montrant une hypervascularisation (flèche) de la synoviale du poignet chez un patient ayant une atteinte inflammatoire (polyarthrite rhumatoïde) du carpe.
Phase séquellaire : fibrose
La fibrose (ou sclérose) est une cicatrice, développée en remplacement du tissu original s'il n'a pas pu être régénéré ou a été détruit après la réaction inflammatoire. La fibrose est, grossièrement, un dépôt excessif de tissu conjonctif fibreux qui modifie l'architecture et parfois la fonction de l'organe atteint. La zone fibrotique est plus dense, plus compacte que le tissu original, et plus pauvre en eau avec un espace extracellulaire réduit suite à des adhérences. Des distorsions architecturales par rétraction sont fréquentes, avec une perte de l'élasticité normale.
Radiographie et TDM
En radiographie et TDM, la fibrose apparaît souvent plus dense que le tissu original, dans une zone plus ou moins étendue et épaisse en fonction du tissu lésé. Les adhérences cicatricielles forment des bandes, qu'on peut comparer à des zones de tissus compactés, « collés », peu élastiques, qui souvent déforment la structure et/ou limitent son expansion (figure 18.7).
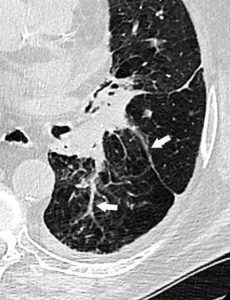
TDM thoracique (fenêtre parenchymateuse) montrant des adhérences fibrotiques cicatricielles (flèches).
IRM
Les plages de fibrose apparaissent en hyposignal par rapport aux tissus sains aussi bien sur les séquences T1 que T2, à cause de la réduction du volume de l'espace extracellulaire (moins d'eau donc moins de signal) et d'une diminution de la vascularisation. Les tissus fibreux peuvent se rehausser après injection de produit de contraste, mais de façon tardive (quelques minutes), à l'opposé des tissus inflammatoires qui sont rehaussés de façon précoce (quelques secondes).
Médecine nucléaire
L'inflammation étant par définition un processus physiologique non spécifique, l'objectif de l'imagerie nucléaire n'est pas d'établir un diagnostic étiologique mais de détecter et de localiser d'éventuels foyers inflammatoires. L'identification de ces foyers accumulant le MRP permet, dans un second temps, d'orienter des biopsies ciblées à visée diagnostique lorsqu'elles sont nécessaires ou de suivre sous traitement ces foyers dans un objectif d'évaluation thérapeutique. Trois approches d'imagerie isotopique sont actuellement disponibles en pratique clinique :
- la scintigraphie au gallium 67 (67Ga), sous forme de citrate, méthode historique ;
- la scintigraphie osseuse (diphosphonates marqués au 99mTc) ;
- la TEP au 18F-FDG, méthode isotopique actuelle de référence en pathologie inflammatoire.
Scintigraphie au 67Ga
Le 67Ga est un analogue de l'ion ferrique Fe3 + qui se fixe sur diverses protéines plasmatiques (ferritine, transferrine, lactoferrine). Au cours d'une réaction inflammatoire, les leucocytes recrutés au niveau du site lésionnel libèrent localement de grandes quantités de lactoferrine. Le 67Ga préalablement injecté par voie intraveineuse s'accumule donc préférentiellement au niveau du site inflammatoire, riche en lactoferrine. MRP historique en imagerie isotopique de l'inflammation, il est de moins en moins utilisé du fait de temps d'acquisition élevés (jusqu'à 48-72 heures après l'injection du MRP) et de la disponibilité de la TEP au 18F-FDG (voir plus loin).
Scintigraphie osseuse en plusieurs temps (diphosphonates marqués au 99mTc)
Les diphosphonates se fixent naturellement sur la phase minérale de la matrice osseuse (cristaux d'hydroxyapatite en formation). Par conséquent, les diphosphonates radiomarqués au 99mTc permettent d'imager tout processus de remodelage osseux (ostéoblastose), qu'il soit inflammatoire, infectieux ou tumoral. Le temps scintigraphique osseux nécessite environ 2 à 3 heures de délai entre l'injection du MRP et l'acquisition des images (temps nécessaire à la fixation du MRP sur la matrice osseuse). Néanmoins, un temps d'acquisition « précoce » réalisé environ 10 minutes après l'injection du MRP permet d'identifier la biodistribution tissulaire du MRP, qui, en cas de processus inflammatoire, s'accroît localement du fait d'une augmentation réactionnelle locorégionale du flux sanguin artériolaire et de la perméabilité capillaire. Il est par conséquent possible, en scintigraphie osseuse, de détecter une composante inflammatoire locorégionale d'un processus osseux/ostéoarticulaire d'intérêt (figure 18.8).
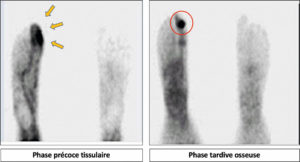
Processus ostéoblastique du 1er rayon du pied droit avec composante inflammatoire locorégionale (scintigraphie osseuse au 99mTc des pieds en deux temps).
Hyperhémie des parties molles de l'orteil droit en phase précoce (A, flèches), témoignant d'une composante inflammatoire locorégionale du processus osseux d'intérêt, visualisé en phase osseuse (B, hyperfixation focale, cercle).
TEP au 18F-FDG
Analogue du glucose marqué au fluor 18 (18F), le 18F-FDG est un MRP qui reflète le métabolisme glucidique des cellules. Les cellules médiatrices de l'inflammation, une fois activées, présentent un métabolisme accru et accumulent donc le 18F-FDG. Par conséquent, la TEP au 18F-FDG est un examen d'une très grande sensibilité pour détecter les phénomènes inflammatoires actifs. Les acquisitions volumiques sont réalisées sur l'ensemble du corps (typiquement vertex à mi-cuisse, voire pieds si besoin), permettant d'obtenir une évaluation corps entier en 3D, avec une résolution spatiale bien plus élevée qu'en scintigraphie conventionnelle. Les lésions séquellaires pures n'étant pas métaboliquement actives, elles ne présentent pas de traduction métabolique. Il est par conséquent possible de discriminer des lésions inflammatoires chroniques en phase « active » de séquelles inflammatoires cicatricielles (c'est-à-dire métaboliquement inactives), de morphologie parfois similaire.
Ce MRP ne présente aucun effet indésirable. Les images sont réalisées entre 1 heure et 1 heure et 30 minutes après l'injection intraveineuse du MRP, chez des patients à jeun depuis 6 heures. Incontournable en oncologie (bilan initial et suivi des cancers), l'intérêt du 18F-FDG en pathologie inflammatoire est plus récent et quelques grandes indications sont actuellement définies : vascularites des gros troncs artériels (figure 18.9), sarcoïdose (figure 18.10), maladies auto-immunes, pathologie inflammatoire ostéoarticulaire, mais aussi fièvres au long cours.
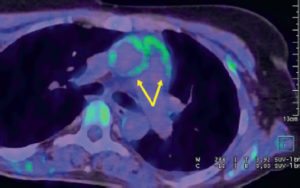
Maladie de Takayasu (vascularite des gros vaisseaux)/stade inflammatoire actif (TEP-TDM au 18F-FDG en coupe axiale de l'artère pulmonaire).
Hypermétabolisme des parois de l'aorte ascendante et du tronc pulmonaire (flèches), témoignant de l'inflammation active des parois artérielles.
Sarcoïdose avec atteinte pulmonaire chronique.
A. Image volumique TEP-FDG (3D-MIP) montrant de multiples foyers hypermétaboliques lymphatiques sus- et sous-diaphragmatiques (en noir). B. TDM thoracique du même sujet (coupe axiale) montrant une fibrose pulmonaire, avec distorsions bronchiques par rétraction du parenchyme pulmonaire (flèches). C. Le 18FDG (TEP-TDM en coupe axiale) confirme le caractère hypermétabolique de la fibrose pulmonaire (flèches), témoignant d'un processus inflammatoire encore actif.
Essentiel à retenir
- Dans les processus inflammatoires à la phase initiale, l'imagerie non isotopique (radiographie, TDM, IRM, échographie) permet de mettre en évidence l'œdème.
- Les zones inflammatoires œdématiées ont un aspect se rapprochant de celui de l'eau (hypodense en TDM, hyperintense en T2 en IRM, etc.).
- Les lésions actives ont un signal augmenté précocement après injection de produit de contraste (on parle de prise de contraste, ou de rehaussement).
- Les lésions cicatricielles sont en revanche peu hydratées, avec peu de prise de contraste ou une prise de contraste retardée avec de fréquentes déformations architecturales.
- L'imagerie nucléaire est sensible pour la détection des processus inflammatoires : vascularites, fièvres au long cours, sarcoïdose.
- La scintigraphie osseuse en plusieurs temps permet d'identifier une composante inflammatoire associée aux processus osseux/ostéoarticulaires évalués.
- La scintigraphie au 67Ga est aujourd'hui supplantée par la TEP au 18F-FDG.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 17 - Processus tumoraux
F. Cachin et L. Fournier
Plan du chapitre
Définition et rôle de l'imagerie : détection et caractérisation
Imagerie du syndrome tumoral
Bilan d'extension
Suivi des traitements
Objectifs
- Connaître le rôle de l'imagerie dans le syndrome tumoral.
- Connaître les signes séméiologiques permettant de reconnaître un syndrome tumoral.
- Connaître les traceurs utilisés en médecine nucléaire dans l'exploration des tumeurs.
Définition et rôle de l'imagerie : détection et caractérisation
Le syndrome tumoral est constitué d'un ensemble d'éléments cliniques ou paracliniques qui traduisent le développement d'une lésion tumorale, quelle qu'en soit la nature, entraînant progressivement le refoulement ou la compression des structures voisines.
Ce syndrome tumoral peut être en rapport avec une tumeur, bénigne ou maligne, mais certains diagnostics différentiels peuvent entraîner les mêmes signes tels que les processus infectieux ou inflammatoires.
L'imagerie a deux rôles dans le cadre du syndrome tumoral : la détection et la caractérisation.
La détection représente la capacité de déceler la présence d'une tumeur. Un examen d'imagerie sera d'autant plus performant pour détecter une tumeur qu'il aura une sensibilité élevée. Une circonstance particulière de la détection en imagerie est le dépistage, qui consiste à rechercher chez une personne en bonne santé apparente des signes d'une maladie avant qu'elle ne se déclare. En France, la mammographie est l'examen d'imagerie proposé en dépistage du cancer du sein chez des patientes sans symptôme et sans antécédent. Lorsqu'un examen d'imagerie est proposé pour explorer les causes d'un symptôme amenant le patient à consulter, on parle d'un examen de diagnostic (et non de dépistage).
La caractérisation représente la capacité de différencier une tumeur bénigne d'une tumeur maligne, voire de caractériser le type tumoral pour certaines tumeurs, ou de différencier une tumeur d'un autre diagnostic. Un examen d'imagerie sera d'autant plus performant pour caractériser une tumeur qu'il aura une spécificité élevée.
Imagerie du syndrome tumoral
Le syndrome tumoral sera diagnostiqué en imagerie devant :
- des signes directs, c'est-à-dire la visualisation de la tumeur grâce à une différence de signal entre la tumeur et son environnement ;
- des signes indirects, tels que le syndrome de masse refoulant les structures avoisinantes, ou le syndrome obstructif entraînant une dilatation d'amont (organes creux comme le côlon et structures canalaires comme les voies biliaires).
Signes directs du syndrome tumoral : contraste en signal
La tumeur sera d'autant mieux visualisée qu'elle présente un signal différent de son environnement (figure 17.1), soit d'opacité en radiographie, d'échogénicité en échographie, de densité en TDM, d'intensité en IRM, de captation en médecine nucléaire. Ces différences sont en rapport avec les différences de propriétés physiques entre la tumeur et les tissus, par exemple une différence d'absorption des rayons X en radiographie ou en TDM. En IRM, différentes propriétés physiques des tissus sont responsables des différences de signal : la densité en protons, l'environnement moléculaire des protons, la restriction de la diffusion de l'eau (pour la séquence pondérée en diffusion). En médecine nucléaire, ce sont les caractéristiques biologiques ou métaboliques des tumeurs qui sont utilisées pour leur détection, telles que l'hyperconsommation de glucose ou l'hyperexpression de certains récepteurs par les cellules tumorales.
Visualisation directe de tumeurs.
A. Radiographie thoracique. De multiples nodules (flèches) sont visibles dans les deux poumons sous la forme d'opacités bien limitées de tailles variables. Ces nodules de tonalité hydrique (tissulaire) sont visibles au sein du poumon car ils contrastent avec la clarté aérique du poumon normal. Il s'agit d'une image en « lâcher de ballons » évocatrice de métastases pulmonaires. B. Coupe transverse en échographie mode B du segment VI du foie (F) au sein duquel on visualise deux lésions suspectes de métastases (flèches) dont l'échogénicité contraste avec l'échogénicité environnante du foie. La lésion supérieure est hypoéchogène homogène. La lésion inférieure présente l'aspect typique « en cible » avec un centre hypoéchogène, une couronne isoéchogène au parenchyme hépatique et une limite périphérique hypoéchogène.
Les tumeurs peuvent se présenter sous la forme de nodule ou de masse (figure 17.2). Le terme de nodule est utilisé en général pour une lésion de petite taille, ronde et bien limitée. Le terme de masse est utilisé plutôt pour une lésion plus volumineuse, à contours irréguliers. La limite en taille entre un nodule et une masse est variable, mais on peut citer l'exemple des lésions pulmonaires définies par la société Fleischner [1] :
- un micronodule est une lésion globalement sphérique de moins de 5 mm ;
- un nodule est une lésion mesurant entre 6 mm et 3 cm ;
- une masse est une lésion mesurant au moins 3 cm.
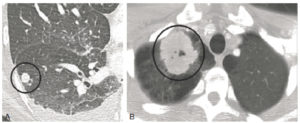
Nodules et masses pulmonaires en TDM.
A. Coupe axiale en TDM, image centrée sur le lobe inférieur droit. Un nodule (cercle noir) est visible sous la forme d'une hyperdensité ronde au sein du poumon aéré hypodense. B. Coupe axiale en TDM au niveau des apex. Une masse (cercle noir) du lobe supérieur droit mesurant 6 cm est visible sous la forme d'une hyperdensité à bords spiculés au sein du poumon hypodense.
L'injection de produit de contraste par voie veineuse permet de sensibiliser l'examen en exploitant des caractéristiques vasculaires, tissulaires ou cellulaires différenciant la tumeur des tissus avoisinants.
En radiologie, les agents de contraste utilisés en routine clinique exploitent essentiellement la différence de vascularisation des tumeurs. Le changement de signal après injection de l'agent de contraste par voie veineuse, appelée rehaussement, permet de mieux détecter la tumeur, mais aussi de la caractériser. L'échographie, la TDM et l'IRM peuvent être réalisés avec injection d'agent de contraste. En imagerie hépatique par exemple, la dynamique de rehaussement d'une lésion permettra parfois de prédire s'il s'agit d'une tumeur bénigne (angiome, par exemple) ou d'une tumeur maligne (carcinome hépatocellulaire, par exemple).
La séméiologie radiologique de ces lésions dans ces deux cas particuliers est suffisamment typique pour pouvoir se dispenser d'une preuve histologique, contrairement à la majorité des tumeurs qui nécessiteront un prélèvement afin d'affirmer le diagnostic.
En médecine nucléaire, la diversité des médicaments radiopharmaceutiques (MRP) permet d'interroger un grand nombre de processus physiopathologiques tumoraux. Dans la majorité des cas, une analyse de la biodistribution du traceur « corps entier » (scintigraphie corps entier) a pour double objectif la détection et la caractérisation du syndrome tumoral, sur la base d'anomalies de fixation à type d'hyperfixation ou d'hypofixation respectivement lors d'une augmentation ou d'une diminution de la fixation par rapport à une fixation dite « normale » (physiologique) (figure 17.3). L'analyse porte sur la tumeur elle-même (caractérisation) et sur les sites métastatiques potentiels (bilan d'extension). L'intensité des anomalies de fixation est fonction de la nature du traceur et du type histologique de la tumeur.
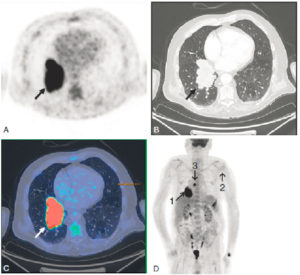
Acquisition multimodale. TEP/TDM (coupes transverses).
TEP au 18F-FDG (A), TDM (B), fusion TDM-TEP (C) et projection 3D de la biodistribution du 18F-FDG (D). Caractérisation d'une masse tumorale pulmonaire lobaire inférieure droite (B, flèche noire). Hyperfixation très intense du 18F-FDG (A, flèche noire ; C, flèche blanche) de la lésion tumorale pulmonaire orientant vers un carcinome. L'analyse de la biodistribution du 18F-FDG sur l'ensemble de l'acquisition (D) permet de réaliser le bilan d'extension. Noter les hyperfixations localisées sur la tumeur primitive (1) et sur l'adénopathie médiastinale rétrocarénaire (3), la tête humérale gauche (2) et la 10e côte gauche, témoignant respectivement d'une atteinte locorégionale lymphatique et d'une atteinte osseuse. La biopsie de la lésion pulmonaire montrera l'existence d'un adénocarcinome pulmonaire.
Plusieurs MRP sont disponibles et sont choisis en fonction de la question clinique posée et des recommandations publiées (figure 17.4). Tous explorent une perturbation du métabolisme ou d'une fonction cellulaire impliquée directement ou indirectement dans les mécanismes physiopathologiques de la cancérogenèse. Plusieurs classifications ont été proposées, les unes en fonction de la nature du traceur (acides aminés, anticorps, etc.), les autres relatives à la cible ou au métabolisme exploré (récepteurs à la somatostatine, métabolisme glucidique ou lipidique, hypoxie, etc.). Nous listons dans le tableau 17.1 les principaux MRP ayant obtenu une autorisation de mise sur le marché (AMM) et utilisés en oncologie.
Tableau 17.1 - Médicaments radiopharmaceutiques (MRP) utilisables en oncologie ayant obtenu une autorisation de mise sur le marché (AMM).
|
Nom du MRP |
Technique scintigraphique |
Phénomène biologique ciblé |
Principales indications |
|
18F-FDG1 |
TEP |
Métabolisme glucidique (expression de transporteurs GLUT-1, activité hexokinase) |
La plupart des tumeurs solides et lymphomes (à l'exception de certaines tumeurs très bien différenciées ne présentant pas ou peu de modifications du métabolisme glucidique) |
|
18F-FCH (fluorocholine) |
TEP |
Synthèse des lipides membranaires (activité choline kinase) |
Cancers de la prostate, cancers primitifs du foie |
|
18F-Fluciclovine |
TEP |
Transport d'acides aminés, analogue de la leucine |
Cancers de prostate |
|
18F-F-DOPA |
TEP |
Transport d'acides aminés |
Tumeurs cérébrales, tumeurs neuroendocrines, tumeurs du système amine precursor uptake decarboxylation (APUD) (phéochromocytomes, neuroblastomes, carcinoïdes, cancer médullaire de la thyroïde) |
|
18F-FET 18Fluoro-ethyl-thyrosine |
TEP |
Transport d'acides aminés |
Tumeurs cérébrales |
|
18F-fluorure ou FNa |
TEP |
Remodelage osseux (incorporé dans les cristaux d'hydroxyapatite de la matrice osseuse) |
Tous les cancers ostéotropes (recherche de métastases osseuses) |
|
99mTc phosphonates |
Scintigraphie conventionnelle |
Remodelage osseux (incorporé dans les cristaux d'hydroxyapatite de la matrice osseuse) |
Tous les cancers ostéotropes (recherche de métastases osseuses) |
|
123I-MIBG |
Scintigraphie conventionnelle |
Recapture et stockage de la noradrénaline |
Tumeurs du système APUD (phéochromocytomes, neuroblastomes, carcinoïdes, cancer médullaire de la thyroïde) |
|
111In-octréotide (OctreoScan®) |
Scintigraphie conventionnelle |
Expression de récepteurs de la somatostatine |
Tumeurs neuroendocrines |
|
68Ga-DOTA-(Tyr3)-octréotate |
TEP |
Expression de récepteurs de la somatostatine |
Tumeurs neuroendocrines |
|
18F-FES (18F-fluoro-estradiol) |
TEP |
Expression de récepteurs des œstrogènes |
Cancers du sein hormonodépendants, cancers de l'endomètre |
|
68Ga/18F-PSMA-ligand |
TEP |
Expression de PSMA |
Cancers de la prostate |
1. Voir chapitre 5. PSMA : prostate-specific membrane antigen.
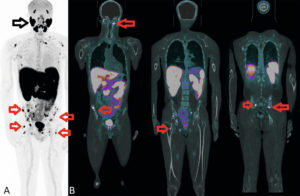
Acquisition multimodale. TEP/TDM (coupes frontales).
TEP au 68Ga-PSMA : TEP projection 3D (A), fusion TDM-TEP (B). Bilan d'extension de récidive d'un adénocarcinome prostatique. Hyperfixation très intense de nombreuses lésions osseuses secondaires (flèches rouges). Noter l'hyperfixation physiologique du traceur sur les glandes salivaires (flèche noire). La fixation intense des lésions osseuses est expliquée par une forte expression des récepteurs PSMA présents à la surface des cellules tumorales.
Signes indirects : syndrome de masse et syndrome obstructif
L'effet de masse ou le syndrome de masse est l'effet de la croissance d'une lésion, qui se traduit par des effets pathologiques indésirables, lié au déplacement ou à la compression du tissu environnant. Ces effets peuvent correspondre au refoulement des organes (figure 17.5), ou à la compression d'organes creux ou de structures canalaires. Dans ce dernier cas, un syndrome obstructif (figure 17.6) apparaît et deux types d'images sémiologiques sont observées : des images de sténose, avec une réduction du calibre du canal ou de l'organe creux à l'endroit de la pathologie, et des images de dilatation de l'organe creux ou des structures canalaires en amont de la compression.
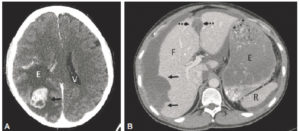
Signes indirects d'une tumeur : syndrome de masse.
A. Coupe axiale en TDM cérébrale. Une masse cérébrale prenant le contraste (flèche) entraîne un œdème en doigt de gant (E) responsable d'un syndrome de masse sur le ventricule latéral homolatéral et effaçant les sillons corticaux. Seul le ventricule controlatéral (V) est visible. B. Coupe axiale en TDM de l'abdomen. Le patient est porteur d'une tumeur péritonéale qui entraîne un effet de masse (flèches noires), refoulant le bord latéral du foie (F) et élargissant le ligament falciforme (flèches en pointillé). E : estomac, R : rate.
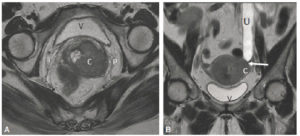
Signes directs (A) et indirects (B) d'une tumeur : syndrome obstructif.
A. Coupe axiale en IRM en pondération T2 centrée sur le col utérin. Un cancer du col est visible sous la forme d'une lésion en signal intermédiaire (C) envahissant le paramètre gauche (P). V : vessie. B. Coupe coronale en IRM en pondération T2 centrée sur le bassin. L'uretère gauche (U) est sténosé (flèche) à hauteur du paramètre gauche car envahi par le cancer du col (C), et dilaté en amont de la compression, visible sous la forme d'un canal à contenu liquidien en hypersignal T2 franc.
Lésions tumorales osseuses
Dans le cas des lésions tumorales osseuses, l'anomalie visualisée correspond le plus souvent à la réaction de l'os au contact de la lésion sous-jacente parfois non visible directement. Deux types de lésions sont décrites : les lésions lytiques entraînant une lyse de la trame osseuse et les lésions condensantes (ou sclérosantes) entraînant une condensation de la trame osseuse (figure 17.7). Typiquement, les lésions de myélome et certaines métastases osseuses sont lytiques (par exemple dans les cancers du poumon), alors que d'autres lésions métastatiques sont condensantes (par exemple dans les cancers de la prostate). Chez un même patient, la coexistence de lésions osseuses sclérosantes, de lésions ostéolytiques ou de lésions mixtes est possible.
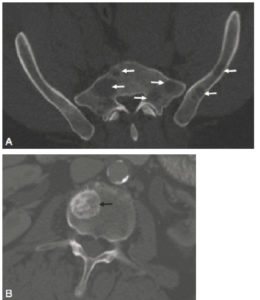
A. Métastases osseuses lytiques du bassin chez un patient porteur d'un cancer du rein. Les lésions (flèches) apparaissent sous la forme de lacunes (hypodensités) de la trame osseuse. B. Métastase osseuse du corps vertébral de L2 chez un patient porteur d'un cancer de la prostate. La lésion (flèche) apparaît sous la forme d'une condensation focale (hyperdensité) de la trame osseuse.
Bilan d'extension
Un rôle important de l'imagerie dans les syndromes tumoraux est le bilan d'extension d'un cancer. Trois niveaux d'extension sont analysés : l'extension locale et en particulier l'envahissement possible des organes de voisinage ; l'extension locorégionale et en particulier l'envahissement lymphatique ; et l'extension à distance avec l'existence de métastases dans d'autres organes.
En fonction des cancers, l'extension locale est parfois réalisée en IRM, qui offre un contraste tissulaire plus performant que la TDM. On peut citer à titre d'exemple les cancers du rectum ou utérins (voir figure 17.6).
Le diagnostic de l'atteinte lymphatique en TDM et IRM est fondé essentiellement sur des critères de taille. Un nœud lymphatique sera considéré comme suspect si son petit diamètre est supérieur ou égal à 10 mm lorsqu'il est de topographie « proximale » (le long des gros vaisseaux), et supérieur ou égal à 5 mm lorsqu'il est de topographie « distale » (dans le mésorectum par exemple). Cependant, ce critère de taille est peu spécifique, puisqu'il peut exister des nœuds lymphatiques métastatiques de petite taille et, inversement, des adénopathies réactionnelles de grande taille. L'imagerie métabolique, telles que la TEP au 18F-FDG, permet de caractériser spécifiquement l'atteinte lymphatique en montrant une hyperfixation des nœuds lymphatiques cancéreux.
Enfin, l'imagerie peut aider à guider la décision de réaliser un curage lymphatique lors de la chirurgie d'exérèse d'un cancer grâce à la technique du nœud lymphatique sentinelle – appelée technique du « ganglion sentinelle » en pratique clinique courante (voir chapitre 29). Un nœud lymphatique sentinelle est défini comme le premier relais lymphatique vers lequel les cellules cancéreuses sont les plus susceptibles de se propager à partir d'une tumeur primitive. Le médecin nucléaire et le chirurgien injectent respectivement une substance radioactive et un colorant bleu à proximité de la tumeur plusieurs heures avant la procédure chirurgicale. Lors de la chirurgie, le chirurgien utilise une sonde-compteur afin de détecter dans quel nœud lymphatique la substance radioactive a diffusé, le résèque et l'envoie à l'anatomopathologiste. Si le nœud lymphatique ne contient aucune cellule cancéreuse, le risque que le cancer se soit propagé aux autres nœuds lymphatiques situés en aval du nœud lymphatique sentinelle est très faible. Si l'analyse histologique montre la présence de cellules cancéreuses, un curage lymphatique sera réalisé afin de s'assurer que la chirurgie est carcinologique et que l'ensemble de la maladie a été réséqué.
Enfin, le bilan d'extension à distance est réalisé par TDM (figure 17.8) ou TEP (voir figure 17.3), en fonction des indications. Ces deux types d'imagerie permettent d'analyser les sites métastatiques les plus fréquents : poumon, foie, os, etc. Dans certaines indications, l'IRM corps entier peut être réalisée pour le bilan de la maladie (les myélomes, par exemple). Ces mêmes techniques permettront également de réaliser le suivi de la maladie, afin de déterminer si le cancer répond au traitement en cas de maladie métastatique traitée par thérapie systémique (chimiothérapie, thérapie ciblée, etc.).
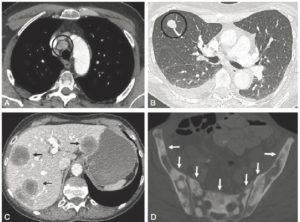
Coupes axiales en TDM du thorax en fenêtres médiastinale (A) et pulmonaire (B) de l'abdomen, en fenêtre tissu mou (C) et du bassin en fenêtre osseuse (D) montrant les multiples métastases disséminées chez une patiente porteuse d'un cancer du sein (cercles et flèches).
Suivi des traitements
L'imagerie joue un rôle majeur dans l'évaluation des traitements en cancérologie, car elle permet une mesure objective et une traçabilité des résultats.
Après un traitement curatif, elle permet de rechercher l'apparition secondaire de nouvelles lésions (rechute ou récidive).
Lors des traitements palliatifs (chimiothérapie ou thérapies ciblées, par exemple), elle permet de déterminer si le traitement proposé est efficace, résultant en une diminution, voire une disparition des lésions, ou si, au contraire, la thérapeutique est inefficace et que la maladie progresse malgré le traitement.
La plupart des méthodes d'évaluation des traitements en radiologie sont fondées sur la mesure de la taille des lésions, et des critères internationaux sont proposés pour standardiser l'évaluation de la réponse aux thérapies antitumorales (par exemple Response Evaluation Criteria In Solid Tumors [RECIST]). En médecine nucléaire, une diminution ou la disparition complète de la captation des MRP permet de définir une réponse métabolique complète ou partielle, alors qu'à l'inverse une augmentation du métabolisme ou l'apparition de nouvelles lésions métaboliques définissent une progression de la maladie. L'utilité de la médecine nucléaire pour l'évaluation de la réponse thérapeutique a été particulièrement bien démontrée avec la TEP au 18F-FDG. Cet examen est en effet devenu incontournable pour le suivi thérapeutique de certains lymphomes. La disparition précoce, dès la première ou deuxième cure de chimiothérapie, des anomalies de fixation tumorale est alors une information pronostique importante. La seule diminution de la fixation sans disparition complète est considérée comme insuffisante et pourrait imposer un changement thérapeutique. Cette stratégie est en cours de validation pour d'autres tumeurs.
L'imagerie est utilisée pour suivre l'efficacité des traitements de radiologie interventionnelle comme la radio-chimio-embolisation ou l'ablation thermique, qui requièrent l'utilisation de critères spécifiques d'efficacité.
Enfin, l'imagerie peut aider au diagnostic de certaines toxicités des traitements anticancéreux, comme les pneumopathies iatrogènes, la radionécrose ou l'insuffisance cardiaque.
Essentiel à retenir
- Le syndrome tumoral est l'ensemble des éléments cliniques ou paracliniques traduisant le développement d'une tumeur, entraînant le refoulement ou la compression des structures voisines.
- Le signe direct est la visualisation de la tumeur grâce à une différence de signal entre la tumeur et son environnement.
- Les signes indirects sont le syndrome de masse refoulant les structures avoisinantes, ou le syndrome obstructif entraînant une dilatation d'amont dans les organes creux ou structures canalaires.
- L'imagerie a pour objectif de détecter le syndrome tumoral, de le caractériser (tumeur bénigne ou maligne), d'en faire le bilan d'extension et d'en assurer le suivi sous traitement.
Référence
[1] Hansell DM, Bankier AA, MacMahon H, et al. Fleischner Society : glossary of terms for thoracic imaging. Radiology 2008; 246(3):697–722.
 |
Chapitre suivant |
 |
Retour au sommaire |
