Les fondamentaux - Chapitre 16 - Radiothérapie interne vectorisée
C. Lussey-Lepoutre et E. Deshayes
Plan du chapitre
- Introduction et principes généraux
- Particularités de radioprotection
- Applications
- Radiothérapie interne sélective (RIS)
Objectifs
- Connaître les particularités de la radiothérapie interne vectorisée : type de sources, indications, effets indésirables.
- Connaître les prérequis de la radiothérapie interne vectorisée.
- Connaître les conséquences de la radioprotection.
Introduction et principes généraux
La radiothérapie interne vectorisée (RIV) est la partie thérapeutique de la médecine nucléaire. Elle concerne à l'heure actuelle une minorité de patients par rapport à la partie diagnostique, mais est en plein essor et conforte la place de thérapeute du médecin nucléaire. Cette thérapie est par ailleurs loin d'être nouvelle ; elle est utilisée depuis plusieurs dizaines d'années puisque la première utilisation remonte à 1941, date à laquelle le Dr Saul Hertz a utilisé pour la première fois de l'iode 131 pour traiter une hyperthyroïdie.
Le principe biophysique est le même que celui utilisé avec la radiothérapie externe. Il repose sur l'utilisation de l'énergie des rayonnements ionisants pour détruire un tissu ou une tumeur en créant des dommages à l'ADN de manière directe ou indirecte (radiolyse de l'eau principalement). La particularité de la RIV est son caractère spécifique d'un type cellulaire. On utilise, comme en imagerie, une source radioactive non scellée, appelée médicament radiopharmaceutique, qui est un isotope radioactif lié à une molécule biologique capable de cibler certains organes, tissus ou cellules du corps humain. Ce radiopharmaceutique va spécifiquement atteindre toutes les cellules cibles, permettant le traitement des cibles de petite taille, nombreuses et dispersées. La source est ainsi au contact ou au sein de la tumeur ou du tissu, ce qui permet d'épargner les tissus voisins et de diminuer les effets indésirables. En revanche, il n'y a pas de relation simple entre l'activité administrée et la dose absorbée, rendant la dosimétrie beaucoup plus complexe que pour la radiothérapie externe. En effet, la dose absorbée est directement reliée à la pharmacocinétique du radiopharmaceutique qui est propre à chaque patient.
L'administration se fait habituellement par voie générale (orale ou intraveineuse) et la fixation au niveau des cibles se fait en utilisant un processus métabolique (radiothérapie métabolique), par le biais d'une liaison antigène-anticorps (radio-immunothérapie) ou récepteur-ligand (radio-peptido-thérapie ou radio-ligand-thérapie).
Il existe différents types de radio-isotopes qui sont caractérisés par le type de rayonnement émis et qui vont avoir des comportements différents dans la matière. En fonction du type de désintégration et de rayonnement, les parcours dans la matière et les transferts linéiques d'énergie (TEL) sont variables. Le parcours d'un rayonnement ionisant est la distance moyenne parcourue dans la matière avant qu'il ne dépose totalement son énergie. Le TEL est une quantité qui décrit l'énergie transférée par une particule ionisante traversant la matière, par unité de distance, exprimée en keV ∙ μm− 1. En thérapie, contrairement à l'imagerie, on utilise des rayonnements ionisant à TEL plus élevé ayant pour conséquence une forte densité d'ionisations sur un court trajet. C'est une irradiation continue, à bas débit de dose avec un débit décroissant selon la période effective (Teff). La Teff est la résultante de la période physique du radioélément utilisé (Tphys) et de la période biologique (Tbio) qui est le temps mis par l'organisme pour éliminer biologiquement la moitié du radiopharmaceutique (élimination urinaire pour la plupart d'entre eux), selon la relation suivante :
Les particules principalement utilisées actuellement sont les particules α et les particules β−. Les particules α sont des noyaux d'hélium ; ce sont donc des particules lourdes dont le pouvoir ionisant est très élevé et le parcours dans la matière est extrêmement court (de l'ordre de quelques μm) à l'origine d'un TEL élevé. Les particules β− sont des électrons, beaucoup plus légers, avec un parcours plus long et plus erratique, de l'ordre de quelques millimètres. Les radio-isotopes émetteurs α utilisés en clinique sont principalement le radium 223 et l'actinium 225 (traitement des cancers de la prostate métastatiques). Les émetteurs β− peuvent être des émetteurs β purs (yttrium 90 avec faible co-émission β+) ou avec une émission γ associée (iode 131, lutétium 177).
La RIV est une thérapie administrée par voie systémique (principalement par voie veineuse périphérique ou orale). Il est donc nécessaire de connaître la biodistribution du traceur dans l'organisme et les tissus cibles ; c'est la notion de ciblage et de compagnon théranostique. En effet, ce principe de théranostique (contraction de « thérapeutique » et de « diagnostic ») est de « traiter ce qu'on voit et voir ce qu'on traite ». Cela repose sur une phase préliminaire de ciblage par une imagerie diagnostique utilisant le même vecteur radiomarqué avec un radio-isotope, le plus souvent un émetteur β+ permettant de réaliser une imagerie par tomographie par émission de positons (TEP) et de visualiser la biodistribution du traceur. Si le patient est éligible au traitement, les cibles devant présenter un niveau de captation suffisant, l'émetteur β+ diagnostique sera remplacé sur le même traceur par un émetteur α ou β–, à visée thérapeutique (figure 16.1). Après administration du radiopharmaceutique thérapeutique, s'il est émetteur impur avec une émission γ associée, il sera alors possible de visualiser sa fixation par la réalisation d'une scintigraphie dite « post-thérapeutique » (figures 16.1 et 16.2).
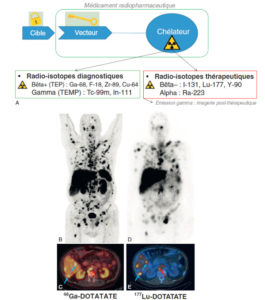
Illustration du concept de « théranostique ».
A. Concept général (cible, vecteur, chélateur, isotope). B-C. Validation de l'expression des cibles. Imagerie TEP-TDM à l'aide du 68Ga-DOTATOC (analogue des récepteurs à la somatostatine). L'examen montre une hyperfixation intense en regard de multiples lésions métastatiques majoritairement osseuses, mais également hépatiques (flèches bleues) et ganglionnaires (flèche rouge) visibles sur l'image corps entier (projection d'intensité maximale, B) et une coupe axiale au niveau hépatique (C). Ces images attestent d'une forte surexpression des récepteurs à la somatostatine. Ce critère validé, le patient a reçu une injection de Lu-177-DOTATATE thérapeutique. D, E. Imagerie post-thérapeutique. Ces images (projection d'intensité maximale vue antérieure en D, et coupe axiale TEMP-TDM en E) réalisées 24 heures après l'injection de 7,4 GBq de 177Lu-DOTATATE confirment la bonne captation du médicament radiopharmaceutique thérapeutique par les différentes cibles tumorales.
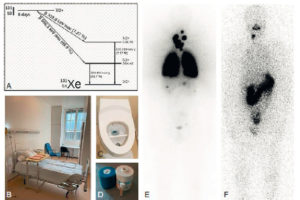
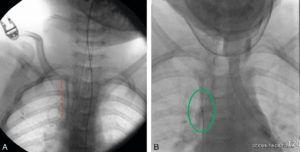
Illustration du cas d'un patient présentant un carcinome thyroïdien différencié métastatique aux poumons traité par iode 131.
A. Schéma de désintégration de l'iode 131. B. Chambre d'hospitalisation en secteur protégé. C. Sanitaire à deux compartiments permettant le recueil et le stockage des urines radioactives. D. Pot plombé et gélule d'iode 131. E. Balayage corps entier d'une scintigraphie réalisée à J5 d'un premier traitement par 3700 MBq d'iode 131 chez un patient atteint de cancer thyroïdien montrant des fixations anormales pulmonaires (aspect de miliaire pulmonaire) et cervicales (adénopathies cervicales persistantes après chirurgie). F. Balayage corps entier chez le même patient réalisé à J5 d'un second traitement par iode 131, 6 mois après le précédent et après exérèse chirurgicale des adénopathies cervicales, montrant la rémission complète au niveau pulmonaire et une fixation physiologique gastroduodénale.
Particularités de radioprotection
La RIV implique des précautions de radioprotection à la fois communes et différentes de celles appliquées à la médecine nucléaire diagnostique. L'irradiation interne étant beaucoup plus importante, les précautions vis-à-vis d'une éventuelle grossesse doivent être renforcées et prolongées à plusieurs mois après l'administration du radio-isotope. Concernant l'entourage et l'environnement, il est nécessaire, lorsque l'excrétion est principalement urinaire, de recueillir les urines et de les conserver pour décroissance dans des cuves spéciales, ainsi que d'éloigner le patient de son entourage. La durée de ces précautions est variable (de quelques heures à quelques jours) et peut nécessiter une hospitalisation. Cette hospitalisation se fait dans un secteur dit « protégé », dans une chambre spécialement conçue pour ce type de traitement avec une protection plombée au niveau des murs et des sanitaires spéciaux permettant le recueil des urines dans les cuves de décroissance.
Dans tous les cas, le suivi des recommandations de radioprotection nécessite une participation active du patient, et l'absence de compréhension de ces consignes est une contre-indication au traitement.
Applications
Les radio-isotopes les plus utilisés actuellement en RIV sont l'iode 131 en pathologie thyroïdienne bénigne et maligne, et les radiopharmaceutiques marqués au lutétium 177 pour les tumeurs neuroendocrines et le cancer de la prostate.
Iode 131 et pathologie thyroïdienne
L'iode est un élément chimique de la famille des halogènes de numéro atomique 53 et possédant 37 isotopes connus. L'iode 131 est l'isotope utilisé en thérapie thyroïdienne. C'est un émetteur double : deux émissions β– (à 90 %) permettant le traitement, puisque 95 % de l'énergie délivrée par ce rayonnement sera transférée sur une distance de 1 mm, et deux émissions γ permettant l'imagerie. Sa période physique est de 8 jours.
Ce traitement a deux indications : l'hyperthyroïdie et le cancer thyroïdien différencié. Il est administré par voie orale, uniquement au sein des services de médecine nucléaire, sous la forme d'une gélule calibrée spécifiquement pour un patient donné et livrée sur commande dans un pot plombé (voir figure 16.2). Le traitement de l'hyperthyroïdie est réalisé avec de faibles activités (le plus souvent < 740 MBq) et peut ainsi être délivré à des patients en ambulatoire (le patient peut rentrer chez lui après l'administration de la gélule). En revanche, le traitement des patients avec un cancer thyroïdien nécessite des activités beaucoup plus importantes, de l'ordre de 1100 à 3700 MBq, délivrées lors d'une courte hospitalisation de 48 à 72 heures.
L'élimination de l'iode non fixé se fait essentiellement par les urines et la période biologique varie en fonction du type de pathologie traitée : environ 6 jours pour une hyperthyroïdie (captation et rétention importantes de l'iode dans la glande thyroïde) contre seulement 24 à 48 heures pour les patients atteints de cancer thyroïdien, le traitement intervenant après thyroïdectomie totale. Les effets secondaires sont rares car l'iode, s'il peut être capté par certaines glandes exocrines (salivaires, lacrymales, etc.), est uniquement stocké dans les cellules thyroïdiennes, ce qui en fait un traitement très spécifique. L'émission γ permet la détection des foyers de fixation grâce à la réalisation systématique d'une scintigraphie dite « post-thérapeutique » entre J3 et J5 de l'administration de la gélule. C'est un traitement peu coûteux et très efficace. Il contribue au bon pronostic de ce cancer en permettant la guérison complète des formes métastatiques chez un tiers des patients, notamment s'ils sont jeunes, avec des métastases de petite taille [1], efficacité à l'heure actuelle inégalée pour un traitement systémique de cancer solide métastatique.
Lutécium 177
Le lutécium (ou lutétium) est un élément chimique de la famille des lanthanides (terres rares) de numéro atomique 71. Son dérivé isotope, le lutécium 177 (ou Lu-177), se désintègre en hafnium 177 avec une demi-vie de 6,7 jours et un mode de désintégration β– (0,4971 MeV d'énergie maximale à 78,6 %). Il possède un parcours moyen dans les tissus de 0,7 mm et, lors de sa désintégration, il existe une émission de particules γ permettant une imagerie scintigraphique post-thérapeutique.
Deux médicaments radiopharmaceutiques utilisant le Lu-177 sont actuellement disponibles en France : le 177Lu-DOTATATE (Lutathera®), médicament ciblant les tumeurs neuroendocrines [2] et disposant d'une autorisation de mise sur le marché depuis 2017, et le 177Lu-PSMA-617, disposant d'une autorisation temporaire d'utilisation pour traiter les cancers de la prostate [3]. Contrairement à l'iode qui est son propre vecteur, le lutécium 177 doit être attaché à la molécule vectrice de manière forte et stable dans le temps. On utilise pour cela un chélateur, le plus souvent le DOTA (tetraxetan), qui est lui-même relié à la molécule vectrice. Avant de réaliser ces traitements, il faut valider l'expression suffisante des cibles par une imagerie, le plus souvent TEP, à l'aide de l'émetteur gallium-68 (68Ga-DOTATOC ou 68Ga-DOTATATE). Le 177Lu-DOTATATE a pour cible les récepteurs à la somatostatine, qui sont habituellement surexprimés dans les tumeurs neuroendocrines digestives bien différenciées. Pour le cancer de la prostate, il s'agit d'une glycoprotéine transmembranaire, le PSMA (prostate-specific membrane antigen), surexprimé dans les cancers prostatiques évolués. Ces traitements ont montré une efficacité sur le contrôle de la progression tumorale, mais ils ont également un impact positif sur la qualité de vie des patients (douleurs, diarrhées, etc.). Les schémas de traitement sont standardisés : le patient reçoit des injections intraveineuses d'activités fixes de 7,4 GBq toutes les 8 semaines pour les tumeurs neuroendocrines (au maximum 4 injections), ou toutes les 6 semaines pour le cancer de la prostate (au maximum 4 injections). Une courte hospitalisation peut être proposée, mais la tendance future sera de délivrer ces traitements en ambulatoire, les contraintes de radioprotection étant moins importantes qu'avec l'iode 131. Une attention particulière est apportée au risque d'extravasation (passage du produit en dehors de la veine) lors de l'injection.
Ces traitements sont en général bien supportés ; les effets secondaires sont liés à la biodistribution du médicament (excrétion et présence des cibles sur certains tissus non tumoraux). En particulier, on note fréquemment une toxicité hématologique (variation des paramètres sanguins circulants), modérée et transitoire avec le 177Lu-DOTATATE, plus fréquente et profonde avec le 177Lu-PSMA. Le patient est donc surveillé régulièrement en cours de traitement. Une imagerie post-thérapeutique scintigraphique est habituellement réalisée après les injections ; elle permet de valider la bonne captation par les tumeurs du médicament radiopharmaceutique voire de calculer la dose absorbée.
Radiothérapie interne sélective (RIS)
La RIS ou radio-embolisation est à la frontière de la radiologie interventionnelle et de la médecine nucléaire thérapeutique, utilisée dans le traitement local des cancers du foie. Elle consiste en l'injection intra-artérielle hépatique de microsphères chargées d'yttrium 90 (90Y). L'yttrium 90 est un émetteur β– pur de haute énergie (2200 keV) avec un parcours moyen de 2,5 mm, permettant d'irradier la tumeur en préservant le foie sain péritumoral. Sa période physique est de 64,2 heures. Ce traitement nécessite un certain nombre d'étapes préalables et une collaboration étroite entre l'équipe de radiologie interventionnelle, en charge de cathétériser de façon ultra-sélective l'artère hépatique par abord fémoral, et le médecin nucléaire, en charge de l'administration par ce microcathéter des microsphères radiomarquées. Une scintigraphie préthérapeutique est systématiquement réalisée. Elle permet notamment de s'assurer de l'absence de shunt hépato-pulmonaire trop important (risque d'irradiation pulmonaire). L'yttrium 90 n'émettant pas de rayonnement γ, cette phase d'imagerie préalable est réalisée avec des macro-agrégats d'albumine marqués au Tc-99m. Cette approche endovasculaire est récente, encore en cours d'évaluation, mais pourrait avoir une efficacité en termes de contrôle du volume tumoral dans plus de 60 % des cas [4].
Essentiel à retenir
• La radiothérapie interne vectorisée (RIV) utilise des sources radioactives non scellées rendant son utilisation très réglementée.
• La RIV est très spécifique d'un type cellulaire.
• La RIV est intéressante pour les cibles disséminées (métastases) et de petite taille. Elle est plus assimilable à un traitement de type systémique que focal.
• Un ciblage des récepteurs et de la captation du traceur est souvent nécessaire : c'est la notion de théranostique.
• Les mesures de radioprotection sont spécifiques, nécessitant notamment de garder les patients dans les premières heures ou les premiers jours après l'administration du traitement dans un service de médecine nucléaire, en particulier pour recueillir leurs urines (gestion des effluents).
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 15 - Radiologie interventionnelle
P. Chabrot
Plan du chapitre
- Introduction
- Consultation pré-interventionnelle
- Modalités de guidage
- Techniques élémentaires
- Conclusion
Objectifs
- Savoir décrire les grandes classes de gestes d’imagerie thérapeutique.
- Connaître le principe des différentes modalités de guidage.
- Connaître les avantages et limites des techniques d’imagerie thérapeutique.
Introduction
Les différentes techniques d’imagerie sont très largement connues pour leur utilisation diagnostique : l’échographie, la radiographie conventionnelle, l’imagerie par résonance magnétique (IRM), la tomodensitométrie (TDM) et la médecine nucléaire interviennent dans le diagnostic et le suivi de nombreuses pathologies. Même si le volet thérapeutique de ces techniques existe depuis leurs débuts, il a connu un large développement ces dernières années. Le déploiement de l’imagerie interventionnelle dans des champs d’application très larges lui confère désormais une place incontournable dans la prise en charge thérapeutique des patients. En médecine nucléaire, la radiothérapie vectorisée repose sur l’utilisation de sources radioactives non scellées concentrées vers une cible principale selon différentes techniques (métabolique, immunologique, liaison peptidique) permettant une destruction tissulaire ciblée (voir chapitre 16). La radiologie interventionnelle représente la réalisation d’actes médicaux sous contrôle radiologique. Les différentes modalités d’imagerie, présentes dans la plupart des services de radiologie, permettent d’accéder à une cible par voie percutanée ou endovasculaire pour y délivrer différents matériaux, agents chimiques ou physiques. Les radiologues sont formés à la réalisation des actes simples (biopsies, ponctions, drainages). Les actes intermédiaires ou complexes (embolisations, infiltrations, ablations tumorales, cimentoplasties, revascularisations) sont réalisés par des radiologues formés spécifiquement en radiologie interventionnelle dans des structures spécialisées.
Selon le geste réalisé et la cible à atteindre, la modalité d’imagerie adaptée est choisie par le radiologue : échographie, fluoroscopie, TDM, IRM ou combinaison de plusieurs d’entre elles.
La finalité peut être diagnostique (biopsie et analyse histologique) ou thérapeutique (destruction tumorale, contrôle de la douleur ou de saignements, etc.). Elle peut concerner différents champs d’application (cancérologie, traumatologie, affections cardiovasculaires, inflammatoires, traitement de la douleur, etc.) et toutes les localisations anatomiques.
L’utilisation de techniques peu invasives a permis d’élargir les indications aux patients fragilisés, de développer les prises en charge ambulatoires et de raccourcir les durées d’hospitalisation et de convalescence.
Les actes sont réalisés sous anesthésie locale le plus souvent, ou parfois sous anesthésie générale lorsqu’une immobilité parfaite est requise, comme en pédiatrie chez les jeunes enfants.
Consultation pré-interventionnelle
La consultation est un temps essentiel de la relation entre le patient et son médecin radiologue. Durant ce temps privilégié, ils établissent une relation contractuelle singulière. Il permet de colliger les informations nécessaires à la réalisation du geste, d’informer le patient sur l’évolution naturelle de la maladie, les bénéfices attendus du geste, les modalités de suivi et d’évaluation, la fréquence et la gravité des complications potentielles (en abordant spécifiquement les plus fréquentes et les plus graves). L’explication exposera les différentes techniques alternatives et précisera la place du geste dans la stratégie globale de prise en charge.
Au décours de la consultation, les risques hémorragiques et infectieux, le contrôle de la douleur, les modalités de surveillance et d’hospitalisation seront clairement établis.
Modalités de guidage
Le principe général repose soit sur le prélèvement, soit sur l’administration à distance d’une énergie (radiofréquence, micro-ondes, etc.), d’un matériel (stent, coil, colle, etc.) ou d’un médicament (chimiothérapie, anti-inflammatoire, etc.) au niveau d’une cible. Pour atteindre cette cible, différentes techniques d’imagerie peuvent être utilisées seules, en association ou combinées avec des techniques d’assistance au guidage.
Échographie
L’utilisation des ultrasons permet de bénéficier d’une imagerie non irradiante et de suivre la progression du matériel en temps réel. Par exemple, lors de la réalisation d’une biopsie échoguidée, le trajet de l’aiguille est visualisé depuis l’entrée à la peau jusqu’à l’entrée dans la cible. Les limites de cette technique sont les obstacles au franchissement des ultrasons (air, os, complexité du trajet, etc.). La facilité de mobilisation des appareils portatifs et le faible coût en font une technique privilégiée pour toutes les cibles superficielles.
Fluoroscopie
L’utilisation des rayons X permet la visualisation en temps réel des éléments radio-opaques (aiguilles, produit de contraste, etc.). Les rayons X sont notamment utilisés pour les techniques interventionnelles vasculaires de revascularisation et d’embolisation, permettant le suivi des cathéters et des guides intravasculaires. Les limites reposent sur l’exposition aux rayonnements ionisants proportionnelle à la durée d’exposition. Le coût reste limité et l’accessibilité favorable sous réserve de la mobilisation du patient dans une salle dédiée.
TDM
La TDM fait également appel à l’utilisation des rayons X. Elle permet, grâce à une bonne résolution spatiale et de contraste, d’accéder à des cibles profondes ou inaccessibles en fluoroscopie ou échographie (os, poumon, etc.). Toutefois, cette technique est limitée par une exposition aux rayonnements ionisants plus importante et par le caractère différé du repérage, qui ne se déroule plus en temps réel comme en échographie ou en fluoroscopie. En imagerie en coupe, l’image acquise sert à planifier un trajet, puis l’opérateur place son aiguille selon le trajet préétabli et réalise le contrôle dans une troisième étape. Ces étapes sont répétées jusqu’à atteindre la cible. Le coût reste modéré et le développement des équipements dédiés à la radiologie interventionnelle en a amélioré l’accès.
IRM
L'IRM offre une bonne résolution en contraste, et des données fonctionnelles comme des cartographies de température, utilisées dans les techniques de destruction tissulaire pour éviter les lésions des structures de voisinage. Bien que non irradiante, cette technique a des contraintes d’environnement : utilisation de matériel amagnétique, faible diamètre du tunnel. Le faible nombre de machines, notamment dédiées à la radiologie interventionnelle (aimant ouvert), en fait une technique difficile d’accès et qui reste coûteuse.
Guidage multimodal et outils d’assistance
Les développements informatiques et en traitement du signal ouvrent la possibilité de superposer plusieurs modalités d’imagerie en associant notamment une imagerie en temps réel (échographie ou fluoroscopie) à une imagerie en coupe (TDM, IRM), facilitant la visualisation de la cible et du trajet. Des dispositifs d’assistance au guidage ont été développés pour visualiser, selon l’orientation de l’aiguille au point d’entrée, le trajet potentiel, donnant ainsi accès à des balistiques (trajet jusqu’à la cible) complexes tout en sécurisant les structures potentiellement à risque de perforation (tube digestif, poumon) ou de plaie (uretères, vaisseaux).
Techniques élémentaires
Les différentes techniques de radiologie interventionnelle concernent l’ensemble des localisations anatomiques et ont un vaste champ applicatif. Nous pouvons schématiquement distinguer les techniques percutanées des techniques endovasculaires.
Radiologie interventionnelle percutanée
Le principe général repose sur l’accès distant à une cible à partir d’un point d’entrée cutané selon une balistique prédéfinie, repérée salon une modalité de guidage adapté. Cette stratégie peut être déclinée pour atteindre différentes finalités.
- Les cytoponctions et les biopsies consistent en la réalisation d’un prélèvement d’un fragment tissulaire. Elles sont réalisées le plus souvent sous anesthésie locale à l’aide d’aiguilles spécifiques. Les prélèvements font ensuite l’objet d’analyses complémentaires (histologie, bactériologie, etc.).
- Les drainages consistent en la ponction d’une cavité et la mise en place d’un drain pour en assurer la vidange. Selon la localisation et la nature du liquide, des sondes d’un calibre plus ou moins important peuvent être utilisées. Le drainage d’abcès a réduit drastiquement le nombre d’interventions chirurgicales. Un drainage des cavités pyélocalicielles rénales (néphrostomie) est possible pour dériver les urines au-dessus d’un obstacle urinaire. Il est également possible d’utiliser les techniques de guidage radiologique pour mettre en place une sonde pour remplir une structure. Ainsi, la mise en place d’une sonde au sein de l’estomac (gastrostomie) est utilisée pour des programmes de renutrition.
- Les infiltrations et neurolyse (figure 15.1) consistent en l’injection d’un agent pharmacologique dans une zone cible précise (cavité articulaire, périphérie de plexus ou racines nerveuses, etc.). Il peut s’agir d’anti-inflammatoires, d’anesthésiques locaux, voire de dérivés d’alcool pour assurer la destruction d’une structure algique et diminuer les douleurs du patient.
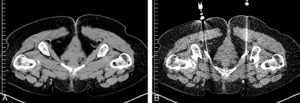
Coupes axiales de scanner avant (A) et après injection de repérage (B) dans le canal obturateur ou d’Alcock (dédoublement de l’aponévrose du muscle obturateur interne) permettant l’injection d’anesthésiques locaux et d’anti-inflammatoires à visée antalgique dans le cadre de douleurs périnéales (névralgie pudendale).
- Les destructions tumorales percutanées (figure 15.2) regroupent différentes techniques reposant sur la délivrance d’une énergie au sein de la tumeur pour entraîner sa destruction. Les plus utilisées reposent sur des techniques modifiant la température : nécrose par augmentation de température (radiofréquence, micro-ondes, laser, ultrasons focalisés) ou au contraire par le froid (cryoablation). Plus récentes, des techniques normothermes sont mises en œuvre et délivrent une différence de potentiel modifiant la perméabilité membranaire (électroporation) pouvant entraîner la mort cellulaire par hydrolyse.
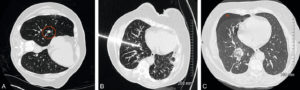
Patiente suivie pour une tumeur digestive avec métastase pulmonaire unique (TDM de repérage, cercle rouge) (A) traitée par radiofréquence (B).
TDM de contrôle (C) après 24 heures montrant la plage de destruction (ablathermie) satisfaisante et une lame de pneumothorax (astérisque) spontanément résolutive.
- Les consolidations osseuses (figure 15.3) consistent en l’injection d’agents chimiques (cimentoplastie) ou mécaniques (vissage, matériel intravertébral, etc.) dans une lésion osseuse (tassement traumatique ou métastase). Ces éléments permettent un contrôle rapide de la douleur et une amélioration fonctionnelle importante sans recours à une chirurgie.
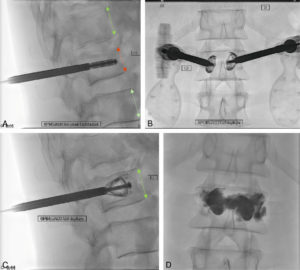
Patient présentant un tassement traumatique du corps de la vertèbre L1.
Repérage fluoroscopique de profil (A) (flèche rouge) et de face (B) lors de l’insertion transpédiculaire du dispositif d’expansion vertébrale. Ce dispositif d’expansion vertébrale permet de restaurer une hauteur satisfaisante (flèche verte) (C) avant injection complémentaire de ciment (D).
Radiologie interventionnelle endovasculaire
Cette technique utilise un repérage fluoroscopique permettant de suivre du matériel inséré par voie intravasculaire (guide, sonde, ballon, etc.). La finalité peut être le traitement d’une lésion vasculaire (rétrécissement ou saignement), mais aussi l’administration d’agents pharmacologiques au sein d’un parenchyme. L’évolution des techniques d’imagerie, la miniaturisation des outils de cathétérisme et le développement des dispositifs implantables (stent et agent d’embolisation) placent les traitements endovasculaires le plus souvent en première intention des gestes thérapeutiques de nombreuses affections (tableau 15.1). Les principales limites sont la possibilité d’obtenir un accès à la lésion cible, la dose délivrée et la quantité de produit de contraste nécessaire au traitement des lésions complexes.
- Les revascularisations (figure 15.4) permettent de restaurer le calibre normal d’un vaisseau à partir d’une dilatation par un ballon d’angioplastie. Elles peuvent être associées à la mise en place dans un stent. L’utilisation de stent couvert restaure l’étanchéité vasculaire, notamment en cas de traumatisme ou d’anévrisme. Ce geste peut être proposé devant une artériopathie des membres inférieurs, des sténoses des artères digestives en cas d’angor mésentérique, des sténoses veineuses en cas de compression tumorale, d’anévrismes de l’aorte.
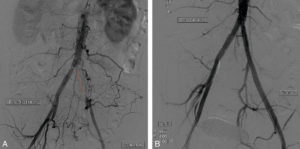
Patient présentant une claudication intermittente gauche avec un périmètre de marche limité.
L’artériographie avec soustraction osseuse objective une occlusion de l’artère iliaque commune gauche (ligne pointillée en A) suppléée par des collatérales pelviennes. Contrôle après recanalisation par dilatations et stents (B).
- Les embolisations (figures 15.5 et 15.6) consistent, à l’inverse, à réaliser l’occlusion d’un vaisseau ou d’une lésion vasculaire (plaie, saignement tumoral, anévrisme, malformation artérioveineuse). La diversité des agents d’embolisation permet de couvrir une large gamme de traitement. Il peut s’agir d’éléments temporaires ou définitifs, mécaniques particulaires liquides, inertes ou associés à des agents ayant leur action propre. Ils peuvent être associés à des agents pharmacologiques, notamment chimiothérapie pour combiner l’efficacité de l’ischémie tumorale avec celle des cytostatiques de chimiothérapie, ou particules radioactives pour réaliser une radiothérapie interne.
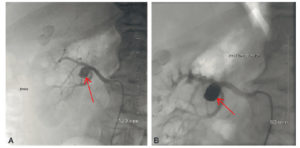
Patient présentant un anévrisme sacciforme de la bifurcation de l’artère rénale droite (A, flèche) traité par embolisation du sac par coils (flèche) respectant la perméabilité des branches porteuses permettant de prévenir le risque de rupture et de conserver la fonction rénale (B).
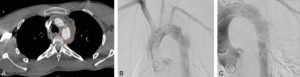
Patient adressé pour une rupture traumatique de l’isthme aortique lors d’un accident de voiture.
Coupe axiale en TDM injectée (cercle pointillé rouge, A) et artériographie avant (B) et après traitement (C).
- Les prélèvements vasculaires ciblés sont réalisés à partir du cathétérisme des veines de drainage de glandes endocrines (surrénales, pancréas, parathyroïdes, hypophyse, ovaires) pour dosage hormonal afin de préciser une éventuelle anomalie de sécrétion.
- Les accès vasculaires sont obtenus à partir d’une ponction échoguidée du vaisseau cible et mise en place d’un dispositif adéquat : cathéter périphérique ou central, chambre implantable.
- La récupération de corps étranger (figure 15.7) : des lassos ou pinces intravasculaires ont été développés pour extraire différents éléments ayant migré dans la circulation (fragment de cathéter, guide, implant contraceptif).
Fracture du cathéter d’une chambre implantable lors de son retrait chirurgical.
La radiographie thoracique retrouve le fragment en projection du tronc veineux brachiocéphalique droit (ligne pointillée en A). Un cathéter lasso (cercle vert, B) permet la recapture et l’extraction à partir d’une ponction veineuse fémorale droite.
Tableau 15.1 - Liste non exhaustive d’indications de traitement en radiologie interventionnelle endovasculaire.
|
Indication |
Cible |
|
|
Embolisation |
Hémorragie de la délivrance |
Artères utérines |
|
Fibromes utérins |
Artères utérines |
|
|
Anévrismes |
Artères cérébrales, digestives, iliaques, bronchiques, aorte |
|
|
Hypertrophie bénigne de la prostate |
Artère prostatique |
|
|
Malformations vasculaires (malformations artérioveineuses, fistules, etc.) |
Artère afférente à la malformation |
|
|
Tumeurs hépatiques, rénales, autres |
Artères hépatiques, rénales |
|
|
Hémorroïdes, varices pelviennes, varicocèles |
Artères ou veines pelviennes |
|
|
Revascularisation |
Artériopathie oblitérante des membres inférieurs |
Artères iliaques, fémorales, poplitée, aorte |
|
Sténose des troncs supra-aortiques |
Carotides |
|
|
Angor mésentérique |
Artères mésentériques |
Conclusion
L’imagerie thérapeutique a connu un essor récent considérable. Les améliorations technologiques, l’individualisation de services de radiologie interventionnelle et la formation des radiologues contribuent au déploiement de ces techniques. Leur efficacité en fait un traitement curatif ou adjuvant, dont l’indication est posée en concertation pluridisciplinaire.
Essentiel à retenir
- La radiologie interventionnelle recouvre l’ensemble des actes médicaux réalisés sous contrôle radiologique.
- Les modalités d’imagerie permettant de réaliser des gestes sous contrôle radiologique sont l’échographie, la radioscopie, l’IRM et la TDM. Elles sont présentes pour la plupart dans les services de radiologie. Elles permettent d’accéder à une cible à l’intérieur du corps soit par voie percutanée, soit par voie endovasculaire pour y délivrer différents matériaux, qu’il s’agisse d’agents chimiques ou physiques.
- Les radiologues sont formés à la réalisation des actes simples (biopsies, ponctions, drainages). Les actes intermédiaires ou complexes (embolisations, infiltrations, ablations tumorales, cimentoplasties, revascularisations) sont réalisés par des radiologues formés spécifiquement en radiologie interventionnelle dans des structures spécialisées.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 14 - Coûts des examens de radiologie et de médecine nucléaire en France
V. Hazebroucq et J.-P. Beregi
Quatre-vingts millions d'actes d'imagerie sont réalisés en France chaque année pour des patients ambulatoires (c'est-à-dire non hospitalisés), pour un coût total d'environ 6 milliards d'euros. Le prix moyen d'un examen, toutes techniques confondues, est d'environ 57 euros par acte, et varie selon la technique d'imagerie, ainsi que le mode de tarification :
- pour une majeure partie des examens, le tarif de prise en charge par l'assurance maladie8.8. des actes définis à la classification commune des actes médicaux (CCAM) englobe la rémunération « intellectuelle » du médecin et l'ensemble des « coûts de la pratique », c'est-à-dire la rémunération des personnels techniques et de secrétariat, les frais d'acquisition, d'entretien et de fonctionnement des appareillages et des locaux, les consommables, le chauffage, l'électricité, le système d'information et d'archivage, la téléphonie, l'assurance du cabinet et de responsabilité civile professionnelle, etc. ;
- pour la tomodensitométrie (TDM), l'imagerie par résonance magnétique (IRM) et la tomographie par émission de positons (TEP), un double système de prise en charge a été établi, distinguant un « forfait intellectuel » versé au médecin – ou à l'employeur du médecin en cas de salariat – pour rémunérer l'acte médical et un « forfait technique » versé à l'exploitant de l'appareil pour financer l'ensemble des frais engagés pour la réalisation de l'examen.
La figure 14.1 résume les coûts moyens des examens par technique, en distinguant, le cas échéant, les tarifs des actes intellectuels de ceux des forfaits techniques [1].
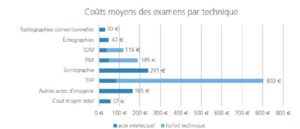
Coûts moyens des examens d'imagerie.
Le tableau 14.1 indique, pour information, le tarif réel « opposable » de la prise en charge de quelques actes d'imagerie parmi les plus fréquents (hors suppléments d'honoraires).
Tableau 14.1 - Tarifs opposables d'une sélection d'actes d'imagerie diagnostique en France.
|
Nature de l'examen |
Coût de l'acte ou de l'acte intellectuel |
|
Radiographie thorax simple |
21 € |
|
Radiographie thorax – gril costal |
45 € |
|
Radiographie mains/poignets |
20 € |
|
Radiographie genou |
23 € |
|
Radiographie bassin et coxofémorales |
31 € |
|
Radiographie rachis cervical (trois incidences ou plus) |
41 € |
|
Radiographie rachis lombaire |
46 € |
|
Mammographie bilatérale |
66 € |
|
Échographie mammaire |
42 € |
|
Échographie thyroïdienne |
35 € |
|
Échographie abdominale ou pelvienne |
52 € |
|
Échographie abdominopelvienne |
76 € |
|
TDM 1 territoire anatomique (cervical, thoracique, face, encéphale, rachis, etc.) |
25 € |
|
TDM 2 territoires anatomiques (abdominopelvien, sans et/ou avec contraste, etc.) |
51 € |
|
TDM 3 territoires anatomiques ou plus, uniquement pour la cancérologie |
76 € |
|
IRM quel que soit le territoire anatomique, hors membres (cérébrale, thorax, cou, cœur, sein, abdomen ou abdominopelvien, rachis, etc.) |
69 € |
|
IRM d'un segment de membre, supérieur ou inférieur |
55 € |
|
Scintigraphie myocardique |
470 € |
|
Scintigraphie pulmonaire |
360 € |
|
Scintigraphie osseuse |
170 € |
|
Scintigraphie thyroïdienne |
110 € |
|
TEP au 18F-FDG |
90 € + forfait technique (550 ou 1000 €) |
Données CCAM de janvier 2017 ; il s'agit d'exemples de tarifs de base, variables en fonction des détails techniques de réalisation et de l'application possible de divers modificateurs ; ils sont arrondis à l'euro le plus proche.
Les dépenses de santé pour les examens de radiologie et de médecine nucléaire peuvent être placées en regard des coûts liés au transport sanitaire pour les soins de ville et les soins hospitaliers prescrits par les professionnels de santé, qui s'élèvent à environ 4 milliards d'euros pour l'année 2017, avec une croissance de l'ordre de 4,8 % par an. La réglementation par les autorités de santé des coûts liés au transport sanitaire n'est pas moins nécessaire pour l'économie globale des dépenses de santé que celle des examens de radiologie et de médecine nucléaire.
Enfin, il n'est sans doute pas indifférent de relever, avec l'économiste Frédéric Bizard [2], que les tarifs unitaires des examens d'imagerie sont en France nettement inférieurs à ceux pratiqués en Suisse, ou en Belgique ainsi qu'à la moyenne européenne, bien qu'assez comparables à ceux de l'Allemagne.
Ces différences tarifaires contribuent à expliquer le nombre plus élevé d'actes par appareil, ou par milliers d'habitants par rapport aux pays cités ci-dessus, et posent de réelles questions de fond sur la pertinence et la qualité de ces actes, ainsi que sur la qualité de vie au travail des professionnels.
Lors d'actes de radiologie réalisés pendant une hospitalisation dans un hôpital public, ces actes sont alors inclus dans un groupement homogène de séjour (GHS). Le prix du GHS est défini en fonction de la pathologie, des comorbidités et des actes réalisés dont les actes de chirurgie. Les actes de radiologie n'influent en général pas sur le prix du GHS payé à l'établissement. En radiologie interventionnelle et parfois lors d'un bilan diagnostique, un séjour en hospitalisation de jour de radiologie peut être proposé par l'établissement.
Des consultations médicales sont réalisées par les radiologues ou les médecins nucléaires, soit avant un acte de radiologie interventionnelle, soit après un acte diagnostique pour une pré-annonce ou pour une conduite à tenir.
Comprendre la nécessité de régulation et de contrôle des flux des demandes d'examens d'imagerie fait partie aujourd'hui de la formation des futurs médecins. Les efforts portent sur l'enseignement des indications des examens d'imagerie dans le but avoué de privilégier la qualité et l'efficience au volume. Plutôt que des demandes d'actes, l'approche par les soins radiologiques apportés aux patients, les consultations pour le patient ou les avis pour le correspondant sont aujourd'hui des organisations qui permettent de fluidifier les parcours.
Références
[1] L'imagerie médicale en France, un atout pour la santé, un atout pour l'économie. Livre blanc du Conseil professionnel de la radiologie française (G4 Rx), Paris novembre 2016, disponible sur : http://livreblancimagerie.fr/.
[2] Bizard F. L'imagerie médicale dans huit pays européens. Brochure éditée par la Fédération nationale des médecins radiologues (FNMR).
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 13 - Demande et compte-rendu des examens d'imagerie
J.-P. Beregi et F. Le Jeune
Plan du chapitre
- Demande des examens d'imagerie
- Introduction
- Notion de pertinence
- Résumé clinique
- Compte-rendu des examens d'imagerie
- Introduction
- Évolution des comptes-rendus de radiologie et de médecine nucléaire
- Annonce du résultat
- Conclusion
Demande des examens d'imagerie
Objectif
- Connaître les principaux éléments d'une demande d'examen d'imagerie.
Introduction
Les notions de justification, d'optimisation et de responsabilité pour la réalisation des actes d'imagerie utilisant les rayonnements ionisants ont été abordées dans le chapitre 6. Elles peuvent théoriquement être étendues à l'ensemble des actes d'imagerie (échographie et IRM) car elles permettent, dans un souci d'efficience, de structurer la prise en soin des malades.
Dans l'ensemble du chapitre, quand l'expression « imagerie médicale » est utilisée, elle inclut l'ensemble des actes diagnostiques de radiologie et de médecine nucléaire.
Notion de pertinence
La demande d'examen est un document écrit qui constitue la base de la relation entre le médecin demandeur et le radiologue ou le médecin nucléaire. Le radiologue ou le médecin nucléaire est le médecin prescripteur car c'est lui qui prescrit le protocole d'examen aux manipulateurs et qui est responsable du bon choix d'un examen vis-à-vis du patient (le terme de médecin prescripteur est utilisé dans le texte suivant pour désigner le radiologue ou le médecin nucléaire).
Le médecin demandeur justifie la réalisation de l'examen en indiquant le contexte clinique et les antécédents, en explicitant les hypothèses diagnostiques. La demande d'examen doit poser une question à laquelle l'examen d'imagerie doit tenter de répondre. Cette demande doit être compréhensible pour le médecin prescripteur qui confirme la légitimité de l'examen. Les résultats doivent avoir un impact sur la prise en charge du patient, en modifiant par exemple la thérapeutique ou la conduite à tenir.
La demande d'examen doit également apporter au médecin prescripteur les éléments nécessaires à la réalisation dans les conditions optimales de l'examen demandé. Le médecin prescripteur pourra ainsi juger des éventuelles contre-indications absolues ou relatives à la réalisation de l'examen ou à l'injection d'un produit de contraste (iodé, gadoliné, CO2, traceurs, etc.).
Les renseignements apportés dans la demande lui permettront également d'adapter au mieux l'examen réalisé, en proposant parfois un autre examen, ou en adaptant le protocole de réalisation de l'examen à la maladie recherchée.
Il est important de préciser si des examens antérieurs ont été réalisés et leurs résultats ; l'accès aux antériorités est fondamental, notamment en cancérologie, pour analyser les critères morphologiques, métaboliques ou fonctionnels attestant de l'évolutivité ou non de la pathologie.
La demande comporte aussi un délai souhaité pour la réalisation de l'examen et l'urgence doit être justifiée. Un guide d'Aide à la demande des examens de radiologie et d'imagerie médicale (ADERIM, consultable à l'adresse : https://aderim.radiologie.fr/home) a été édité par la Société française de radiologie. Un guide du « bon usage » des examens d'imagerie (http://gbu.radiologie.fr/) a été édité par les sociétés savantes de radiologie et de médecine nucléaire. Ces guides précisent les examens à réaliser, leur délai, en fonction des symptômes ou des pathologies suspectées.
La notion de pertinence est complexe à définir. Elle peut se résumer ainsi : le bon examen est celui réalisé au bon moment, pour le bon patient, avec la bonne technique, pour une bonne indication.
Il est souvent difficile pour le demandeur de connaître le bon examen à réaliser, car les indications varient en fonction des innovations technologiques, de la disponibilité des appareils et des radiopharmaceutiques ainsi que de l'expérience des équipes. Il est souvent nécessaire que le médecin demandeur contacte le médecin prescripteur pour échanger avec lui sur la problématique posée par le patient ; ensemble, ils décideront la meilleure stratégie pour avancer dans le diagnostic, le dépistage, le suivi, les traitements, dont un éventuel acte de radiologie interventionnelle.
Les radiologues et les médecins nucléaires effectuent également des consultations de radiologie interventionnelle ou des consultations de second avis (ou d'expertise) et des consultations préthérapeutiques. Les examens d'imagerie réalisés à la suite des demandes peuvent ainsi être organisés et programmés.
Rédaction de la demande d'examen
Une demande d'examen d'imagerie doit comporter les éléments suivants :
- type d'acte demandé : radiographie, tomodensitométrie (TDM), imagerie par résonance magnétique (IRM), scintigraphie, TEP-TDM, actes de radiologie interventionnelle ;
- l'organe ou le processus à étudier ;
- la localisation du côté si indiquée ;
- l'identification du patient :
- nom ;
- prénom ;
- date de naissance ;
- adresse.
Résumé clinique
Le résumé clinique comprend :
- le tableau clinique du patient, sa date d'installation, son mode de début brutal ou progressif, son mode évolutif ;
- les affections associées et les traitements en cours : recherche de diabète ou d'interactions médicamenteuses avant certains examens de médecine nucléaire ;
- les antécédents du patient :
- hypothèses diagnostiques : les hypothèses diagnostiques et la question à laquelle l'examen doit répondre ;
- contre-indications : les contre-indications éventuelles à la réalisation de l'examen ou à l'injection d'un produit de contraste. Exemples : grossesse, allaitement, présence d'un pacemaker (pour les IRM), réaction allergique lors d'une injection antérieure d'un produit de contraste ou altération de la fonction rénale, etc. Pour un acte de radiologie interventionnelle, la prise de médicaments anticoagulants ou antiagrégants et les troubles de la crase sanguine doivent être indiqués ;
- état clinique du patient : la coopération prévisible du patient pour les examens nécessitant une immobilité parfaite ; la nécessité de réaliser l'examen au lit (pour une radiographie ou une échographie) ; patient en ambulatoire ou nécessité de prévoir un brancardage.
- nom du médecin demandeur, numéro de téléphone, signature, permettant au médecin prescripteur de le contacter soit pour préciser un élément avant la réalisation de l'acte, soit pour l'informer du résultat si celui-ci implique un traitement immédiat ou une information modifiant le parcours du patient.
Le médecin demandeur et le prescripteur s'engagent à informer le patient des modalités de réalisation, des résultats attendus et des possibles complications de l'examen demandé.
Une attestation écrite du consentement du patient est recommandée avant l'examen, attestant sa bonne compréhension, son accord et l'absence de contre-indication.
Compte-rendu des examens d'imagerie
Objectif
- Connaître les principaux éléments d'un compte-rendu d'examen d'imagerie.
Introduction
Le compte-rendu de radiologie ou de médecine nucléaire fait partie intégrante de l'acte d'imagerie ; il est indispensable et obligatoire. Il est une trace médico-légale de la consultation en radiologie ou en médecine nucléaire. Il s'intègre dans un parcours patient et doit obligatoirement conduire à orienter les soins du patient en l'informant. Le patient décide de communiquer les résultats au médecin demandeur ou à un autre médecin de son choix. Éventuellement, le compte-rendu peut être communiqué à d'autres médecins en cas d'urgence.
L'annonce du résultat et les propositions de prise en soin ultérieures font partie des obligations pour les radiologues et médecins nucléaires.
Structuration d'un compte-rendu de radiologie/médecine nucléaire
Le compte-rendu est organisé en différentes parties:
- Titre du compte-rendu : type d'acte réalisé.
- Identification du patient.
- Date de réalisation de l'examen,
- Nom du médecin demandeur,
- Indication : résume le contexte et la question clinique.
- Technique et protocole :
- données techniques de la machine utilisée, date d'installation,
- principes techniques de réalisation de l'examen d'imagerie : zones anatomiques explorées, modalités d'acquisition,
- si une injection a été nécessaire, avec quel agent diagnostique et à quel temps l'acquisition a été réalisée (artériel, veineux ou parenchymateux). Radiopharmaceutique utilisé/mode d'administration/activité injectée,
- si un matériel implantable a été utilisé, le numéro de lot doit être présent, permettant de tracer le dispositif médical,
- dosimétrie : pour les examens utilisant les rayonnements ionisants : produit dose × longueur (PDL en mGy·cm) si TDM et produit dose × surface (PDS en mGy·cm2) pour les radiographies,
- dates des examens comparatifs.
- Résultats :
- description de l'ensemble des constatations faites par le radiologue ou le médecin nucléaire avec la description des signes positifs, c'est-à-dire les éléments pathologiques, et des signes négatifs pertinents ou les variantes du normal,
- dans le cas d'une fixation pathologique de certains traceurs, on note l'intensité de fixation par un indice SUV (standardized uptake value) fourni automatiquement par les logiciels qui permet de suivre l'évolution des anomalies sous traitement,
- les anomalies sont décrites en fonction de leur localisation anatomique et avec des termes de séméiologie d'imagerie.
- Conclusion :
- résume les points majeurs de la description des résultats et donne une conclusion clinique qui répond à la question posée par le demandeur en proposant des hypothèses diagnostiques,
- le médecin peut suggérer des explorations complémentaires ou une nécessité d'une prise en soin médicale, chirurgicale ou en radiologie interventionnelle.
- Nom du médecin radiologue ou nucléaire, signature.
Évolution des comptes-rendus de radiologie et de médecine nucléaire
Dans les années à venir les comptes-rendus de radiologie et de médecine nucléaire sont amenés à évoluer, allant vers plus de standardisation et de précision.
- L'utilisation de comptes-rendus à structure type, voire de comptes-rendus informatisés dans certains cas est amenée à se généraliser. Ceux-ci participent à l'effort d'harmonisation et d'homogénéisation des pratiques et contribuent à améliorer la qualité.
- Les comptes-rendus d'imagerie sont souvent descriptifs. En plus des données descriptives, des données quantitatives, morphologiques ou fonctionnelles sur l'organe étudié ou sur des marqueurs de l'état général du patient peuvent actuellement être fournies. Ces données sont appelées radiométrie. Elles permettent notamment :
- une surveillance dans le temps avec des critères quantitatifs, par exemple l'étude du volume d'une lésion tumorale avec des scores étudiant l'efficacité d'un traitement,
- une comparaison à des populations types, par exemple des marqueurs de risque cardiovasculaire, d'ostéoporose ou de sarcopénie ou des bases de données de volontaires sains pour évaluer la fixation du traceur chez un patient par rapport aux variations physiologiques liées à l'âge.
La radiologie et la médecine nucléaire sont également considérées comme des « producteurs de données » permettant de constituer des bases de données importantes, accessibles à des traitements statistiques par des logiciels d'intelligence artificielle, ou à des analyses de l'image par des techniques de radiomique (technique fondée sur l'exploration d'un très grand nombre de paramètres quantitatifs à partir d'images radiologiques corrélés aux examens clinique et biologique permettant de proposer de nouveaux biomarqueurs diagnostiques, pronostiques ou prédictifs), ouvrant ainsi une voie vers l'imagerie personnalisée et prédictive.
Annonce du résultat
Le médecin radiologue ou médecin nucléaire a l'obligation de s'impliquer dans le suivi du patient pour lequel un examen d'imagerie a été réalisé. Le devoir d'information s'impose après tout examen d'imagerie. Au-delà de la délivrance de l'information, il doit s'assurer de la bonne compréhension par le patient (ou à défaut par son entourage) des résultats et prévoir avec lui la conduite à tenir qui peut être de revoir son médecin, de poursuivre les investigations ou éventuellement de réaliser un geste de radiologie interventionnelle. Il doit s'assurer aussi que ses confrères sont informés des résultats et de la conduite à tenir qui résulte de l'examen réalisé.
Cependant, la consultation en imagerie, à visée diagnostique, est singulière car elle est une rencontre parfois unique entre un patient, pouvant présenter une affection grave, et un médecin, qui n'a souvent que peu de renseignements sur le patient. En effet, pendant le temps restreint de la consultation à l'issue d'un examen d'imagerie, le radiologue ou le médecin nucléaire connaît parfois mal le profil psychologique ou la personnalité du patient, le niveau d'information du patient sur sa pathologie, le degré d'implication de l'entourage, l'historique de ses examens antérieurs et son projet thérapeutique personnalisé.
Des recommandations encadrent le devoir d'information du patient par un médecin. Ainsi, la loi du 4 mars 2002 (article L. 1111-2), code de déontologie médicale 2012, sur le dispositif d'annonce indique que : « Le devoir d'information incombe à tout professionnel de santé dans le cadre de ses compétences et dans le respect des règles qui lui sont applicables. Seules l'urgence ou l'impossibilité d'informer peuvent l'en dispenser ». Cette information a pour but d'obtenir le consentement libre et éclairé du patient aux actes et traitements proposés. Cependant, ces recommandations sont, par nature, d'ordre général et rien n'est spécifiquement imposé.
La consultation en imagerie médicale peut aboutir à l'annonce d'une mauvaise nouvelle, comme une récidive de cancer, un accident vasculaire cérébral ou des lésions irréversibles du myocarde. Même s'il n'existe pas de « bonne façon » d'annoncer une mauvaise nouvelle, les radiologues et les médecins nucléaires s'appuient au cours de ces consultations d'annonce sur trois principes généraux détaillés dans l'encadré ci-dessous qui permettent d'amener le patient à s'approprier le diagnostic et la prise en charge immédiate.
Les points principaux de la consultation d'annonce d'un résultat d'examen
- Principe 1 : le temps à prendre pour parler avec le patient. Il n'y a pas de temps minimal ou défini pour une consultation. Un temps court peut être vécu comme satisfaisant par le patient à condition de connaître les bases de la communication. On parle davantage ici de disponibilité pour le patient.
- Principe 2 : l'écoute active. Que sait le patient de la pathologie ? Que veut-il savoir ? Souvent, le patient n'est pas en demande d'explications compliquées, mais si l'examen a décelé quelque chose qui explique les symptômes et la conduite à tenir. Dire que l'examen est normal ou pathologique est au final moins important que la conduite à tenir après. Le patient doit se sentir écouté et pris en soin.
- Principe 3 : les bases de la communication. Les mots sont importants (langage verbal) mais moins que l'attitude (langage non verbal) ou l'intonation et la rapidité d'énonciation de votre discours (paraverbal). En voulant rassurer, souvent le médecin augmente l'anxiété. Un endroit calme est préférable à un couloir. La position du médecin par rapport au patient est importante : s'il est assis, vous l'êtes ; s'il est allongé, vous vous mettez à son niveau. Le positionnement à côté de lui est souhaitable, et non en face, vécu comme une opposition. L'information délivrée oralement doit être lente, posée, en délivrant une information simple, répétée, en contrôlant la compréhension par le malade (ratification) et en lui proposant un ou des objectifs à court terme.
Comment conduire un entretien d'annonce de résultats en pratique
L'entretien type contient cinq étapes clés.
1. Bonjour, je suis le Dr Y., médecin dans le service. (Serrer la main renforce le sentiment d'adhésion et de confiance.)
2. C'est moi qui ai pris soin de la réalisation de votre examen. (Notion de soin.)
3. L'examen s'est bien déroulé et j'ai pu avoir toutes les informations nécessaires. (Notion de compétence.)
4. Comment s'est déroulé pour vous cet examen ? (Écoute.)
5. Votre motif de consultation est bien… et l'examen retrouve… L'examen est rassurant/L'examen retrouve une image sur… J'informe votre médecin pour qu'il analyse ce résultat avec l'ensemble de votre dossier… (Je ne vous laisse pas tomber, je m'occupe du suivi, je suis à votre disposition.)
Conclusion
Le radiologue et le médecin nucléaire sont des cliniciens. Le compte-rendu d'un examen d'imagerie est un acte médical obligatoire rédigé en des termes médicaux qui doivent être expliqués au patient lors d'une consultation médicale, idéalement à l'issue de l'examen, par le spécialiste d'imagerie. Ainsi, le radiologue ou le médecin nucléaire ébauche une explication sur la normalité, les anomalies ou sur l'évolution d'une pathologie déjà connue au patient demandeur d'une information sur sa santé. Il le fait sans sortir de son domaine de compétence (par exemple, le diagnostic de certitude d'une tumeur solide relève des résultats d'un examen anatomopathologique) tout en ouvrant des perspectives pour la suite des soins. La communication entre les médecins demandeurs et les spécialistes d'imagerie est primordiale, car elle bénéficie directement au patient par la fluidité des échanges (secrétariat, téléphone, logiciels de demandes d'examen, messagerie) et par la richesse des informations mises en commun.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 12 - Erreurs en imagerie médicale
L. Arrivé
Plan du chapitre
- Introduction
- Erreurs procédurales
- Erreurs de détection
- Erreurs d'interprétation
- Erreurs de communication
- Solutions d'amélioration
Introduction
La médecine n'est pas une science exacte. Il existe une intervention humaine qui implique la possibilité toujours présente d'une erreur qui peut avoir des conséquences plus ou moins graves. Évidemment, l'imagerie médicale n'échappe pas à cette règle. Dans la majorité des cas – et c'est une particularité propre à l'imagerie médicale –, l'erreur est vérifiable a posteriori puisqu'elle est attestée par un support physique qui peut être réanalysé a posteriori. Elle est en cela différente d'autres erreurs médicales moins faciles à vérifier a posteriori. Il est par exemple beaucoup plus difficile d'analyser l'imputabilité à une erreur médicale pour une complication chirurgicale.
En imagerie médicale, on peut résumer le processus de l'examen d'imagerie en plusieurs étapes :
- la demande d'examen par un médecin clinicien (le « demandeur ») qui doit ainsi poser une question ;
- la prescription de l'examen par un spécialiste d'imagerie, radiologue ou médecin nucléaire (le « prescripteur ») – il faut bien distinguer demande et prescription ;
- la réalisation de l'examen, le plus souvent par un membre du personnel non médical, le manipulateur en électroradiologie (sauf pour l'échographie, directement réalisée par un médecin en France ; en Australie, au Royaume-Uni, au Canada et aux États-Unis, les échographies sont réalisées par des membres du personnel non médical, des sonographers) ;
- la détection d'une anomalie potentiellement présente ;
- l'interprétation de cette anomalie ;
- la communication des résultats de l'examen (le prescripteur tente de répondre à la question du demandeur ; ce dernier interprète lui-même la réponse).
Chacune de ces étapes expose par nature aux risques d'erreurs.
Erreurs procédurales
Ce type d'erreurs concerne la réalisation de l'examen, qu'il s'agisse d'un examen dont l'indication n'est pas pertinente, d'un examen pour lequel la technique de réalisation a été insuffisante ou inappropriée (par exemple absence d'injection de produit de contraste alors que cette dernière était nécessaire), ou d'un examen pour lequel une erreur physique a été réalisée (erreur sur la région à examiner, épaule droite pour épaule gauche par exemple, voire erreur concernant l'identité du patient). L'identitovigilance constitue une des règles primordiales en imagerie médicale comme dans les autres domaines d'application médicale.
L'indication d'un examen d'imagerie médicale constitue un des piliers garants d'un résultat adéquat. Tout examen d'imagerie médicale est réalisé à la suite d'une demande d'examen. Celle-ci permet au radiologue ou au médecin nucléaire de choisir l'examen le plus adapté à la demande médicale et le protocole de l'examen à réaliser, mais également une interprétation des images en fonction des renseignements cliniques fournis par le médecin demandeur.
Pour optimiser sa prescription, le médecin peut s'appuyer sur des référentiels de recommandations de pratique clinique, réalisés par les différentes sociétés savantes (la Société française de radiologie [SFR], la
Société française de médecine nucléaire [SFMN]), ou l'association de plusieurs d'entre elles (on prendra le seul exemple du Guide du bon usage des examens d'imagerie médicale).
Ainsi, le choix du bon examen et de la bonne procédure de réalisation est fonction de ce qui est recherché. Par exemple, pour détecter un pneumopéritoine secondaire à la perforation d'un ulcère, il n'est pas raisonnable aujourd'hui de prescrire et de réaliser chez un adulte un cliché radiographique d'abdomen sans préparation dont on sait qu'il est très largement inférieur à la tomodensitométrie (TDM) qui permettra de visualiser un pneumopéritoine de petite abondance (voir chapitre 27). Il est vraisemblable que les applications de l'intelligence artificielle viendront optimiser les indications des examens d'imagerie médicale.
Toujours dans le cadre des erreurs procédurales – et il s'agit là de la responsabilité du médecin spécialiste d'imagerie –, il faut adapter la technique d'imagerie à la question clinique posée. Par exemple, si l'objectif est de chercher un pneumopéritoine, on peut parfaitement réaliser une TDM sans injection de produit de contraste. Au contraire, si l'on cherche une lésion d'un organe plein, il est généralement utile d'injecter un produit de contraste par voie veineuse pour sensibiliser la recherche des anomalies.
Erreurs de détection
On considère ici comme erreur de détection, ou erreur de perception, une anomalie non détectée alors qu'elle était présente, mais non vue par l'observateur. L'erreur de détection est effectivement différente de l'erreur procédurale. Il s'agit donc ici d'une erreur visuelle, c'est-à-dire de la non-détection d'une anomalie visible a posteriori, erreur visuelle soumise aux lois de la vision humaine et de la perception. Ces erreurs doivent être évitées autant que possible, mais elles peuvent toucher même les médecins les plus expérimentés. Elles dépendent en partie du niveau de compétence et de la formation du médecin spécialiste d'imagerie, mais également de facteurs conjoncturels, comme le manque d'informations cliniques pertinentes, des conditions de travail mal adaptées et du degré de fatigue ou de stress de l'observateur.
Cependant, même dans les meilleures conditions, ces erreurs de détection sont inévitables de façon sporadique. Dans ce domaine encore, les applications de l'intelligence artificielle viendront vraisemblablement optimiser la détection des anomalies.
Erreurs d'interprétation
Il s'agit, dans ce cas, de l'interprétation inadéquate d'une anomalie supposée qui a été détectée. Elle peut entraîner un diagnostic faussement positif, quand par exemple une variante anatomique de la normale est considérée à tort comme une anomalie ou, a contrario, une interprétation faussement négative si une véritable anomalie, qui nécessiterait une prise en charge spécifique, est considérée comme une variante de la normale.
L'analyse rétrospective de larges séries d'erreurs en imagerie médicale a montré que les erreurs de détection sont beaucoup plus fréquentes que les erreurs d'interprétation ou cognitives avec un rapport d'environ 5 pour 1. Il est là encore possible que les applications de l'intelligence artificielle viennent optimiser l'interprétation des images. C'est probablement dans ce domaine de l'interprétation que l'influence de l'intelligence artificielle sera la moins rapide à s'installer.
Erreurs de communication
On peut classer ici l'ensemble des erreurs qui découlent d'une mauvaise communication entre le médecin spécialiste d'imagerie qui a interprété l'examen et le médecin demandeur. Il peut s'agir d'une absence physique d'information. C'est, par exemple, dans le cadre de la découverte d'une anomalie potentiellement grave mais non attendue, du non-respect du devoir d'information du médecin spécialiste d'imagerie au médecin demandeur. Par exemple, la découverte inattendue d'une embolie pulmonaire observée à l'occasion d'une TDM réalisée pour une autre raison implique, de la part du radiologue, l'obligation de s'assurer que l'information va directement et rapidement être communiquée au médecin demandeur. Plus généralement, les erreurs de communication peuvent découler de malentendus quant à la lecture d'un compte-rendu qui, par exemple, pourrait être jugé rassurant par le médecin demandeur, alors qu'il était simplement mal énoncé par le médecin spécialiste d'imagerie. Nous prendrons le seul exemple de l'interprétation du terme « compatible » qui peut être très différente (soit plutôt négatif, soit plutôt positif) selon les interlocuteurs.
Solutions d'amélioration
- La double lecture : interprétation systématique des examens par deux médecins de manière indépendante. Cette approche est appliquée dans le cadre des mammographies réalisées pour le dépistage du cancer du sein, afin de diminuer le risque d'interprétation faussement négative (voir chapitre 29). En revanche, cette double lecture expose au danger d'augmenter le risque d'interprétation faussement positive.
- La recherche d'un avis d'expert peut se faire dans le cadre d'un exercice en groupe, mais également aujourd'hui assez simplement dans le cadre des activités de télé-expertise propres à la téléradiologie qui fait appel au concours d'un spécialiste à distance consulté grâce aux techniques modernes de diffusion et de communication des informations.
- L'intervention des techniques d'intelligence artificielle va probablement améliorer les performances pour ce qui est de la juste indication des examens d'imagerie, de la détection des anomalies radiologiques et possiblement pour l'interprétation des images.
- Comme dans l'ensemble des exercices humains, il a été montré qu'une des techniques les plus efficaces pour réduire le risque d'erreur médicale était d'effectuer une analyse rétrospective des erreurs effectuées, afin de comprendre leurs mécanismes de survenue et de mettre en place des mesures de prévention pour éviter leur récidive.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 11 - Perception de l'image
J.-Y. Devaux , D. Galanaud et F. Brunotte
Plan du chapitre
- Introduction
- Étapes de la perception visuelle
- Particularités normales de la vision susceptibles d'interférer avec la perception des images
- Limitations de perception visuelle liées au vieillissement physiologique ou à des maladies de l'observateur
- Conséquences pour l'analyse des images
- Conclusion
Introduction
La perception visuelle est « le processus d'accès à la connaissance des objets et événements de l'environnement par l'extraction de l'information de la lumière émise ou réfléchie » [1]. La perception est donc une activité cognitive qui se distingue des phénomènes purement optiques. La présentation des images est susceptible d'en modifier la perception. La perception, combinée avec un choix judicieux de l'examen et avec la manière dont celui-ci est visualisé, permet d'arriver à un diagnostic d'imagerie. De nombreux écueils sont à identifier, liés à la manière dont le cerveau humain traite l'information visuelle.
Une image correspond à la localisation dans l'espace d'un signal physique. Les images examinées par le médecin sont soit constituées par de la lumière visible réfléchie (examen direct de la peau, endoscopie), soit transmises par l'élément biologique (microscopie), soit créées sur un écran vidéo, une image papier ou un film transparent. L'imagerie médicale décrite dans cet ouvrage correspond à la transformation en image visible des interactions d'un rayonnement avec un détecteur, rayons X et gamma en radiologie et médecine nucléaire respectivement, ondes radiofréquences en résonance magnétique et ondes ultrasonores en échographie. In fine, une image médicale est donc toujours transmise à l'observateur en lumière visible, condition pour qu'elle puisse constituer une image rétinienne, transmise au cerveau puis analysée et confrontée aux connaissances acquises par le médecin.
L'ordinateur est présent dans pratiquement tous les examens d'imagerie, à la fois pour le pilotage des acquisitions et leur visualisation sur les différents supports cités précédemment. Initialement analogiques, les images médicales sont donc désormais numérisées. Leur mode de présentation doit favoriser la capacité de l'œil humain à analyser ce qu'il perçoit. Les différentes modalités d'imagerie génèrent un volume croissant de données, représentant une information de plus en plus complexe, véritable défi cognitif pour le médecin chargé de l'analyse et de l'interprétation. La réalisation et l'interprétation correctes d'un examen vont nécessiter une série de décisions, conscientes et inconscientes, de la part du médecin imageur, qui vont interférer avec l'interprétation et le diagnostic final.
Les images soumises à l'interprétation médicale sont bidimensionnelles et représentent habituellement une matrice rectangulaire de pixels (voir chapitre 2).
Étapes de la perception visuelle
Les photons de lumière visible traversent les milieux transparents de l'œil dont le cristallin, responsable de l'accommodation, avant de former l'image rétinienne. Le spectre du rayonnement électromagnétique perceptible est très limité (au maximum de 380 à 780 nm). Le signal issu de la rétine, qui comporte à la fois des cellules sensibles aux couleurs (cônes) ou uniquement à l'intensité lumineuse (bâtonnets), subit un premier traitement de l'information au sein même de la rétine (par exemple détection de contours, détection de mouvements, analyse des couleurs). Il transite par les nerfs optiques, le chiasma et les corps géniculés latéraux, puis atteint le cortex visuel primaire dans la région occipitale. L'information visuelle est ensuite traitée dans deux régions distinctes : le réseau ventral (lobe temporal), impliqué essentiellement dans la reconnaissance de l'objet, la sensibilité aux détails et la mémorisation à long terme ; le réseau dorsal (lobe pariétal) traitant la relation de l'objet au sujet, le mouvement et la mémorisation à court terme.
Un élément essentiel du traitement de l'information, comme nous le verrons à plusieurs reprises, est la confrontation aux connaissances acquises préalablement par l'observateur qui va sans cesse confronter ce qu'il voit à ce qu'il connaît.
Perception du contraste et des couleurs
Les images issues des capteurs médicaux sont généralement représentées en nuances de gris. Leur représentation sur écran se fait le plus souvent sur 8 bits, soit 256 nuances de gris. Or, l'œil humain n'est capable de discerner en moyenne que 20 à 30 niveaux de gris différents et la discrimination des nuances est d'autant plus élevée qu'elles ne sont ni très sombres, ni très claires. Même l'examen d'imagerie le plus simple (une radiographie de thorax par exemple) dépasse largement nos capacités de perception et il faut développer des stratégies pour rendre visible de manière optimale le contraste des images. Il existe une transformation entre le signal mesuré (valeur numérique stockée dans un pixel) et sa représentation sur l'écran (figure 11.1). Cette représentation est généralement une fonction affine avec un minimum correspondant au noir et un maximum correspondant au blanc. Mais elle peut aussi être une fonction courbe plus complexe ou conduire à un affichage en échelle de couleurs.
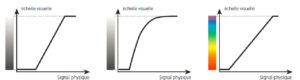
Passage du signal physique mesuré à une échelle visuelle affichée.
Dessin : Emmanuel Durand.
L'échelle de Hounsfield, utilisée pour la TDM, fait correspondre des valeurs allant de − 1000 UH (unités Hounsfield) à + 1000 UH à des niveaux de gris. On règle ainsi la largeur et la position de la fenêtre ou, ce qui revient au même, le minimum (correspondant au noir) et le maximum (au blanc) (figure 11.2).

Fenêtrage en TDM.
Dessin : Emmanuel Durand.
On obtient ainsi différentes « fenêtres » pour sélectionner les tissus explorés, voire accentuer leurs contrastes. De base, trois fenêtres sont utilisées : celle des « os », des « poumons » et des « tissus mous » (foie, cerveau, disques intervertébraux, etc.).
La plupart des autres modalités d'imagerie sont correctement présentées en 256 niveaux de gris, mais certains traitements d'image, en particulier ceux de l'imagerie fonctionnelle (IRM fonctionnelle, scintigraphie), les représentations volumiques et les associations bimodalités font appel à des échelles de couleurs.
Un des intérêts de la représentation colorée est qu'une couleur est identifiable de manière absolue avec une certaine précision (on distingue un jaune d'un rouge), alors que les niveaux de gris ne sont pas identifiables de manière absolue (figure 11.3). Les échelles colorées sont donc plus adaptées à la quantification alors que les échelles en niveaux de gris sont plus adaptées à une interprétation plus qualitative.

La partie A de la barre grise médiane semble plus claire que la partie B alors que le niveau de gris est le même tout le long de cette barre.
Il n'est donc pas possible d'identifier correctement un niveau de gris de manière absolue. On n'a pas la même impression avec les couleurs (le rouge est correctement identifié).
La représentation des couleurs peut se faire par synthèse « additive » (ajout de lumières de différentes longueurs d'onde) ; c'est le cas pour les moniteurs qui génèrent les couleurs au moyen de trois primaires (rouge, vert, bleu [RVB], RGB en anglais), correspondant grossièrement aux trois types de cônes de la rétine. Générant pourtant 16 millions de couleurs différentes, alors que l'œil humain n'en distinguerait, en moyenne, que quelques dizaines de milliers, les écrans de visualisation ne pourront jamais représenter toutes nos capacités de différenciation de nuances colorées, en particulier dans les verts ou les pourpres.
Lors d'une impression sur papier, il s'agit au contraire de synthèse soustractive : les encres ou la peinture absorbent certaines longueurs d'onde, qu'elles « soustraient » ainsi d'une lumière blanche polychromatique ; c'est la synthèse cyan, magenta, jaune (CMJ) (ou CMY en anglais). La représentation colorée est donc différente selon que le support est un écran ou un document imprimé, avec une difficulté de calibration pour représenter correctement les couleurs.
Résolution spatiale
La résolution des différentes modalités d'imagerie n'est pas identique (voir chapitre 2). Nettement inférieures au millimètre, les images radiographiques sont, en pratique, les plus résolues. Les images d'IRM et d'échographie sont de l'ordre du millimètre alors que les images de TEP et surtout celles de scintigraphie sont peu inférieures au demi-centimètre.
La résolution de l'image visualisée dépend de la taille du pixel. Devenus de grande dimension, les écrans actuels des services d'imagerie sont toujours très résolutifs. La résolution de l'écran peut être inutilement élevée si elle excède notablement la résolution physique de la technique. Mais elle peut être aussi trop faible et diminuer artificiellement les performances du système d'imagerie.
La résolution de l'œil humain habituellement appelée acuité visuelle est d'une minute d'angle (c'est-à-dire un soixantième de degré) pour un œil normal (acuité de 10/10) et correspond à la distance sur la rétine entre deux cônes adjacents.
Il faut donc s'assurer que l'angle sous lequel deux points à distinguer sur l'écran sont vus n'est pas inférieur à un angle d'une minute.
Particularités normales de la vision susceptibles d'interférer avec la perception des images
Contraste simultané
Une image en niveaux de gris est constituée de stimuli de luminance différente présentés simultanément. La perception visuelle va évidemment dépendre du pouvoir que possède le système visuel de discriminer ces stimuli. La psychophysique de la vision décrit des interactions entre ces plages voisines qui induisent la perception de contrastes qui n'existent pas sur l'image :
- échiquier d'Adelson (figure 11.4) ;

Les deux carrés A et B ont la même intensité.
Pourtant, le carré B apparaît plus clair car le cerveau « corrige » le cône d'ombre généré par le cylindre. Un tel phénomène peut se produire, en particulier en échographie (distorsion de la perception des contrastes liée au cône d'ombre derrière des calcifications). L'aspect inverse peut être dû au renforcement du signal derrière un volume purement liquidien.
Dessin : Cyrille Martinet
- grilles d'Hermann (figure 11.5) (illusion de présence de carrés gris) et bandes de Mach (renforcement de la perception du passage d'une nuance à une autre, augmentant le contraste) attribuables à l'organisation même de la rétine sous forme de champs récepteurs rétiniens ;

Grilles d'Hermann (1870).
Des carrés gris sont générés par illusion perceptive entre les cases noires ou inversement entre les cases blanches.
- dépendance de la perception du contraste de la fréquence spatiale dans l'image.
Illusions visuelles
De nombreux exemples démontrent que la perception d'une image n'est pas seulement l'enregistrement d'une image bidimensionnelle formée de luminance variable.
C'est le cas du contraste simultané que nous venons de détailler, mais c'est aussi celui de nombreux exemples montrant que l'évaluation des longueurs ou des formes géométriques dépend de leur environnement.
En fonction de leur environnement, deux formes géométriques de taille identique peuvent être perçues comme de tailles différentes, une droite peut apparaître courbe, un nodule identique peut paraître de taille différente en fonction du grossissement de l'image, etc.
Ces illusions sont à distinguer des artefacts : les premières correspondent à la mauvaise perception d'une information exacte, tandis que les artefacts sont la présence d'une information fausse sur l'image liée à des problèmes lors de la réalisation de l'examen. Les illusions d'optique peuvent entraîner des erreurs d'interprétation par mauvaise perception des images, en particulier en ce qui concerne la taille des objets ou leur intensité de signal.
Figures ambiguës
Une autre démonstration de la nature interprétative de la vision vient de l'existence d'images pouvant donner lieu à plusieurs perceptions différentes. C'est le cas de l'ambiguïté visage/vase (cas classique du « vase de Rubin »). Il faut noter que ces deux perceptions sont mutuellement exclusives et qu'elles sont en compétition dans l'interprétation que nous en faisons, ce qui exprime le fait que la perception implique la construction d'un modèle d'interprétation.
Remplissage perceptif
Lorsque plusieurs figures géométriques se cachent les unes derrière les autres, l'observateur a tendance à en reconstruire la partie cachée en fonction d'un modèle géométrique dont il fait plus ou moins inconsciemment l'hypothèse plus ou moins juste.
Objets « impossibles »
Certaines images bidimensionnelles formées de lignes très simples ne peuvent pas être décrites de manière synthétique. En effet, la forme ainsi construite ne peut pas être construite physiquement, ce qui en rend la perception impossible et ce qui prouve que la vision humaine comprend l'image rétinienne associée à une étape de modélisation qui repose sur une connaissance préalable des objets.
Limitations de perception visuelle liées au vieillissement physiologique ou à des maladies de l'observateur
Les anomalies pouvant toucher le système visuel sont très nombreuses. On peut citer (de manière non exhaustive !) : les troubles de la réfraction ou de la convergence, les dyschromatopsies7 qui touchent un homme sur dix mais pratiquement pas les femmes, les réductions du champ visuel, les rétinopathies, les atteintes des voies visuelles, du cortex visuel primaire ou du cortex associatif. La perception de l'image va ainsi varier considérablement en fonction des individus. Tous ces éléments doivent donc être pris en compte dans la visualisation des examens. L'analyse d'une série de 24 images/s sur un moniteur d'ordinateur sera plus spontanée pour un sujet jeune ayant une vision parfaite que pour un sujet plus âgé présentant une presbytie et un début de cataracte !
Conséquences pour l'analyse des images
Précautions dans la visualisation des images
Les modalités de visualisation de l'image peuvent exercer à l'insu de l'observateur un certain traitement de l'image. Ainsi, un examen imprimé sur un papier ou présenté sur un écran de mauvaise qualité sera plus difficilement interprétable et fera courir le risque de passer à côté de lésions de petite taille ou présentant un faible contraste.
La perception du contraste est également influencée par les conditions d'éclairage de l'environnement. L'interprétation requiert des tâches cognitives complexes qui seront influencées par la concentration du lecteur, mais aussi par ses connaissances acquises (voir chapitre 12). La lecture d'un examen dans une salle d'interprétation sombre, au calme, sur un moniteur de catégorie médicale de luminosité et de gamme colorimétrique bien calibrées n'aura pas grand-chose à voir avec la visualisation de ce même examen dans une salle bruyante, ensoleillée, sur un écran de petite taille non dédié et non calibré.
Compréhension des traitements d'images « involontaires »
Un certain nombre de manipulations d'images sont susceptibles, à l'insu du médecin, de modifier le contraste et la résolution des images. Parmi les situations correspondantes, citons un écran de résolution insuffisante, des images transmises après compression entraînant des pertes en résolution. L'utilisation de filtres destinés à améliorer la qualité visuelle de l'image (soit filtres lissants comme les filtres « gaussiens », soit filtres renforçant les bords) présente un certain danger de suppression d'une information pertinente ou de création d'artefacts et d'illusions d'optique. Ils sont donc à manier avec prudence.
Une lésion plus petite que la résolution de l'appareillage utilisé pourra ne pas être détectée à un stade précoce. En revanche, une lésion de très petite dimension sera identifiable si son métabolisme permet une imagerie fonctionnelle et génère une intensité élevée.
Adaptation de la présentation des images aux performances visuelles de l'imageur
La présentation des images doit être adaptée aux performances visuelles de l'imageur. L'exemple le plus convaincant est celui du fenêtrage que nous avons vu plus haut. L'œil étant incapable de percevoir l'ensemble des niveaux de luminance d'un examen en une seule image, il est nécessaire d'utiliser les 30 niveaux de gris que nous pouvons distinguer en plusieurs fois afin de bien détailler toute l'échelle des niveaux de gris. En matière de résolution, l'utilisation de zoom est souvent utile.
Importance de la confrontation à une base de connaissance solide de l'imageur
Il faut insister sur le fait que l'interprétation de l'image ne peut se faire de manière adéquate que par référence à la base de connaissance dont dispose l'imageur. Par exemple, un nodule pulmonaire ne sera pas vu de la même manière chez un jeune patient atteint d'une sarcoïdose que chez un sujet plus âgé et gros fumeur, ou bien une lésion osseuse qui peut avoir de multiples origines (fracture, infection, inflammation, arthrose, tumeur, etc.) ne pourra pas être analysée correctement si le type d'examen pratiqué ou les reconstructions d'images réalisées ne sont pas adaptés au mécanisme causal. Le mode de présentation de l'image est également important, comme nous l'avons vu précédemment.
Pour aller plus loin
« Have you seen the dancing gorilla ? » : il s'agit d'une expérience célèbre réalisée par Daniel Simons et Christopher Chabris des départements de radiologie et de psychologie de la Harvard Medical School. Une courte vidéo est projetée, durant laquelle deux groupes de joueurs, certains habillés en blanc d'autres en noir, se font des passes de basket. Il est demandé aux participants de compter le nombre de fois où les joueurs habillés en blanc se passent la balle. Dans le même temps, un septième personnage, déguisé en gorille, traverse la scène en effectuant quelques pas de danse. La moitié des participants ne remarque pas la présence du gorille.
Ce phénomène est appelé cécité d'inattention, c'est-à-dire le fait de ne pas percevoir un stimulus visuel parfaitement visible car l'attention est captée par une autre tâche. L'implication en imagerie médicale est évidente et a été vérifiée par une équipe de radiologues de la même université. Si on recherche une lésion particulière (par exemple une tumeur), on peut ne pas remarquer une autre pathologie, pourtant bien visible (par exemple accident vasculaire cérébral, embolie pulmonaire, etc.).
Conclusion
Recueillir, traiter et interpréter des images : ce sont les actions à la base de nombreux diagnostics médicaux. Les caractéristiques du contraste et de la résolution de ces images doivent être adaptées de manière optimale, à la fois selon le procédé d'acquisition utilisé et selon les capacités de perception visuelle des imageurs concernés. Les possibilités de traitement de l'image par les ordinateurs modernes sont très performantes, mais leurs procédés d'affichage doivent être régulièrement contrôlés afin de maintenir la sûreté de leur usage dans l'intérêt des patients. Parallèlement, les imageurs doivent toujours être conscients des limites de la vision humaine lors de leur interprétation des images.
Référence
[1] Palmer SE. Vision Science. Photons to phenomenology. Cambridge MA : The MIT Press Third printing ; 2002.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 10 - Traitement de l'image reconstruite
A. Blum
Plan du chapitre
- Introduction
- Reconstructions d'acquisitions volumiques
- Recalage, soustraction, fusion
- Réalité augmentée
- Conclusion
Objectif
- Connaître les principales modalités de traitement de l'image.
Introduction
En imagerie médicale, la formation de l'image résulte de la mesure physique des interactions entre un processus physique (rayons X, ultrasons, ondes radiofréquences, etc.) et les tissus biologiques. Ces variations d'interactions sont captées, analysées et transformées en signaux. Ces signaux sont alors traduits en une ou plusieurs images immédiatement interprétables.
L'image médicale est numérique. Qu'elle représente une projection ou une coupe, elle se divise en unités élémentaires appelés pixels (picture element). Ces pixels possèdent une information topographique et une valeur de signal représentant les interactions avec les tissus biologiques.
Lorsque l'image représente une coupe, le pixel correspond à une unité de volume élémentaire appelée voxel (volume element) (voir chapitre 2). On dispose des informations concernant sa position au sein de la coupe, sa position au sein du volume, l'épaisseur de la coupe (identique à l'épaisseur du voxel) et sa valeur de signal. L'accès aux informations affectées à chaque pixel et à chaque voxel fournit de multiples possibilités de traitement de l'image pour les modalités d'acquisition par coupes (tomodensitométrie [TDM], imagerie par résonance magnétique [IRM] et échographie). Ce chapitre aborde quelques-unes des nombreuses opérations de traitement de l'image :
- reconstructions d'acquisitions volumiques ;
- segmentation qui vise à délimiter les contours d'organes et les sélectionner ;
- recalage, permettant soustraction ou fusion.
Reconstructions d'acquisitions volumiques
Reconstructions multiplanaires (MPR)
L'empilement des coupes permet de reconstituer le volume et de produire des coupes dans tous les plans de l'espace (axial, coronal, sagittal, oblique) (figure 10.1). Ces coupes sont appelées reconstructions multiplanaires (multiplanar reconstruction [MPR]). Leur qualité est d'autant meilleure que la résolution spatiale longitudinale (axe perpendiculaire au plan de coupe) est élevée, c'est-à-dire que l'épaisseur du voxel et la distance séparant les coupes sont faibles. Un volume isotrope (résolution identique dans les trois axes ou voxel cubique) procure les meilleurs résultats. En TDM, le chevauchement des coupes améliore la résolution spatiale longitudinale.
MPR : le volume obtenu à partir d'une acquisition sur le crâne en IRM en pondération T1 permet d'analyser les structures cérébrales dans les trois plans de l'espace.
Reconstructions projectives
Cette technique permet de projeter sur un même plan, selon une direction choisie, les voxels d'intensité maximale (maximal intensity projection [MIP]) (figure 10.2) ou les voxels d'intensité minimale (minimal intensity projection [MinIP]) (figure 10.3). La technique MIP est utile pour étudier les structures vasculaires. La technique MinIP est utile pour étudier les structures contenant de l'air, comme les bronches, ou pour de fines structures au sein de l'os en haute résolution.
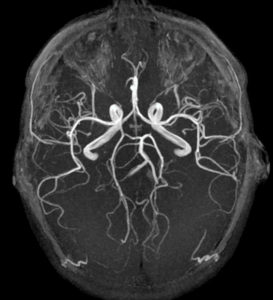
Projection en mode MIP (maximum intensity projection) dans le plan axial à partir d'une séquence d'angio-IRM sans injection de produit de contraste (technique de temps de vol ou time of flight) montrant les artères du cercle artériel du cerveau.
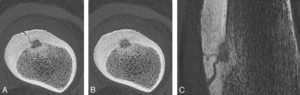
Projection MinIP (minimum intensity projection).
Ostéome ostéoïde de 8 mm de hauteur du fémur gauche chez une femme de 31 ans exploré en super haute résolution (coupes de 0,25 mm d'épaisseur, matrice 1024 × 1024). A, B. Coupes axiales. C. Image MinIP dans le plan sagittal. Noter la qualité de l'analyse de la réaction corticopériostée et la démonstration d'une multitude de vaisseaux alimentant le nidus. Noter également qu'une image MinIP de l'os n'a d'intérêt qu'avec des voxels particulièrement petits.
Source : Blum A, Teixeira P. Scanner et IRM ostéo-articulaires en pratique. Paris : Elsevier Masson ; 2022.
Segmentation
La délimitation d'une zone (par exemple un organe ou une tumeur) dans une image permet de mieux visualiser la structure, d'en quantifier le signal ou d'en mesurer le volume. Une telle zone est appelée région d'intérêt (region of interest [ROI]) et sa délimitation est appelée segmentation. Celle-ci peut se faire manuellement, mais l'utilisation d'algorithmes automatiques ou semi-automatiques de segmentation d'organes et de lésions permet d'augmenter la précision, la fiabilité et la répétabilité de leur représentation ainsi que la mesure de leur volume. Différentes techniques de segmentation sont utilisées ; la plus simple est de déterminer si un pixel appartient ou non à la région d'intérêt en fonction de la valeur du signal par simple seuillage. D'autres techniques plus complexes prennent en compte la taille, la régularité du contour, les caractéristiques des pixels voisins, la connectivité (le fait que la région soit d'un seul tenant).
Rendu de volume et illumination globale
Les images 3D ont pour objectif d'améliorer l'analyse topographique des structures, en offrant une vue globale de la région explorée. Les images 3D font appel à une technique dite de volume rendering technique (VRT). Elles sont réalisées après un seuillage des voxels afin de sélectionner les structures d'intérêt. Des pseudo-couleurs et un certain degré de transparence sont affectés à chaque voxel en fonction de leur valeur de signal. Certains logiciels permettent une mesure des distances ou des angles tridimensionnels.
L'obtention d'une vue 3D sur un plan est obtenue en appliquant deux principes :
- le principe des surfaces cachées : une structure proche de l'œil de l'observateur cache un objet plus distant ;
- l'ombrage : en supposant que l'œil de l'observateur soit la source lumineuse, les objets proches de son œil ou qui lui font face sont plus lumineux que ceux qui sont lointains ou dans l'axe du faisceau lumineux (figure 10.4A).
![Figure 10.4 Comparaison des techniques de rendu de volume (volume rendering technique [VRT]) et du global illumination dans un cas de plaie par balle. A. VRT. B. Global illumination reconstruction. Noter la meilleure visibilité des lésions grâce à l'imagerie photoréaliste (B). Source: Blum A, Gillet R, Rauch A, et al. 3D reconstructions, 4D imaging and postprocessing with CT in musculoskeletal disorders: Past, present and future. Diagn Interv Imaging 2020 ; 101(11) : 693-705.](https://www.cnp-mn.fr/wp-content/uploads/2023/01/Les-fondamentaux-10.4-300x150.jpg)
Comparaison des techniques de rendu de volume (volume rendering technique [VRT]) et du global illumination dans un cas de plaie par balle.
A. VRT. B. Global illumination reconstruction. Noter la meilleure visibilité des lésions grâce à l'imagerie photoréaliste (B).
Source: Blum A, Gillet R, Rauch A, et al. 3D reconstructions, 4D imaging and postprocessing with CT in musculoskeletal disorders: Past, present and future. Diagn Interv Imaging 2020 ; 101(11) : 693-705.
La technique d'illumination globale, plus souvent appelée global illumination (imagerie photoréaliste), remplace progressivement la VRT grâce à une représentation plus réaliste de l'éclairage des objets (figures 10.4B et 10.5B) et à la possibilité d'utiliser des images avec une forte résolution spatiale, ce qui permet d'améliorer la détection et la perception des lésions (figures 10.6 et 10.7).
TDM en double-énergie du pied droit chez un patient suivi pour une goutte.
A. Caractérisation du tophus à partir d'une acquisition à basse énergie (80 kV) et haute énergie (135 kV) et la détermination de sa composition sur chacune de ces acquisitions. B. Global illumination fournissant une cartographie des multiples tophus de l'avant-pied droit.
Séquestration pulmonaire intralobaire chez un homme de 59 ans.
MPR oblique (A) et global illumination (B) après segmentation des vaisseaux et du poumon. La séquestration pulmonaire est une malformation congénitale du poumon où une partie du tissu pulmonaire n'est connecté ni à l'arbre bronchique, ni à la circulation vasculaire pulmonaire. Noter la séquestration (flèche jaune) et son artère nourricière qui naît de l'aorte thoracique descendante (flèche rouge).
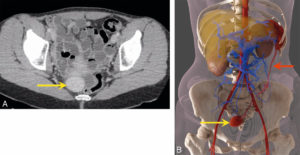
Ectopie splénique.
Coupe axiale en TDM (A) et global illumination après segmentation des vaisseaux et des différents organes (B). Noter la rate accessoire (flèche jaune) et son long pédicule vasculaire (flèche rouge) dont la topographie contribue au diagnostic. L'ectopie splénique ou « rate baladeuse » se définit comme la migration de la rate dans n'importe quel quadrant de l'abdomen. Elle peut être asymptomatique, de découverte fortuite ou responsable de douleurs abdominales en cas d'épisodes de torsion ou d'infarctus splénique.
Recalage, soustraction, fusion
L'appariement et le recalage d'images prennent une place croissante dans l'analyse des données car ces opérations fournissent une analyse simultanée de deux acquisitions différentes d'un même patient :
- soit d'une même modalité à des temps différents ; par exemple TDM sans puis avec injection ; suivi de la réponse au traitement par chimiothérapie d'une tumeur au cours du temps ;
- soit de deux modalités différentes ; par exemple : TDM et TEP pour superposer l'information anatomique et fonctionnelle ; TDM et IRM.
Les opérations de recalage sont le préalable à la fusion ou à la soustraction des images.
Recalage
Pour pouvoir efficacement comparer deux images, les structures étudiées doivent avoir la même position. Or, lorsque les images ont été acquises sur deux appareils différents ou lorsque le patient a bougé entre deux acquisitions sur un même appareil, la mise en correspondance des images nécessite une opération appelée recalage. Les tailles du champ de vue et des pixels n'étant pas nécessairement les mêmes pour les deux images, la première étape du recalage consiste en un reformatage des images dans une base commune. La seconde étape repose sur des transformations rigides ou élastiques des objets de l'image afin de les faire correspondre :
- transformations rigides, lorsque l'objet ne s'est pas déformé mais a simplement bougé, qui consistent en de simples translations et rotations ;
- transformations élastiques, lorsque l'objet se déforme comme lors des mouvements respiratoires ou des battements cardiaques. Ces opérations sont plus complexes et altèrent potentiellement les mesures de signal.
Soustraction
La soustraction est utilisée depuis longtemps en angiographie numérisée. Une première acquisition est réalisée sans injection de produit de contraste, suivie d'une deuxième acquisition avec injection. Les deux séries sont ensuite soustraitées numériquement ; la différence correspond alors aux zones où se localise le produit de contraste, notamment dans les vaisseaux et les tissus hypervascularisés qui sont ainsi mieux visualisés. Cette technique est désormais élargie aux images en coupe ; elle est notamment appliquée en TDM et en IRM de perfusion pour l'analyse de la cinétique de rehaussement d'une tumeur.
Fusion
La fusion met en concordance dans le même espace numérique des images de même nature ou de nature différente. En médecine nucléaire (tomoscintigraphie, TEP-TDM, TEP-IRM) comme en IRM fonctionnelle, elle combine des informations fonctionnelles et morphologiques pour améliorer la valeur diagnostique des examens (figure 10.8).
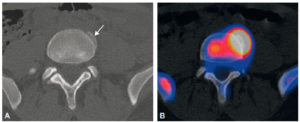
Tomoscintigraphie avec TDM (A) et image de fusion d'une tomoscintigraphie osseuse et TDM (B) d'un syndesmophyte dans le cadre d'une spondylarthrite ankylosante.
La TDM montre l'anomalie morphologique (flèche). L'image de fusion montre l'activité ostéoblastique qui lui est associée.
Réalité augmentée
L'imagerie médicale est essentielle pour la planification préopératoire, mais elle peut également être utilisée pendant l'intervention pour en améliorer la précision et la sécurité. Le principe de la réalité augmentée consiste à superposer au monde réel et en temps réel des objets issus d'images médicales (TDM, IRM, etc.). Cette technique fait appel aux principes de segmentation, de recalage et de fusion de données multimodales. La réalité augmentée est une des processus nécessaires à la chirurgie assistée par ordinateur (CAO).
Conclusion
Les performances accrues de l'informatique permettent de faire appel à des techniques de reconstruction d'image plus nombreuses et plus performantes. Elles autorisent également des opérations combinées des données acquises et la manipulation en temps réel des différentes informations.
Essentiel à retenir
- Les modalités d'imagerie en coupe permettent de produire des volumes numériques, auxquels de multiples traitements peuvent être appliqués : reconstructions dans tous les plans de l'espace, représentations tridimensionnelles, seuillage, segmentation, recalage et fusion.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 9 - Reconstruction tomographique
F. Ben-Bouallègue , E. Durand et D. Mariano-Goulart
Plan du chapitre
- Introduction
- Notion de projection
- En tomoscintigraphie
- En tomodensitométrie
- Problème direct – problème inverse
- Résolution du problème inverse en résolvant le système d'équations
- Rétroprojection
Objectifs
L'imagerie médicale repose schématiquement sur l'acquisition d'un signal physique, sur l'optimisation de ce signal (filtrages), sur sa mise en forme pour en faciliter l'utilisation médicale (reconstructions), puis sur son analyse (extraction d'éléments diagnostiques) qui fera l'objet du chapitre 10. Parmi les divers types de reconstructions possibles, la reconstruction tomographique joue un rôle central en tomodensitométrie (TDM), en imagerie par résonance magnétique (IRM) et en tomoscintigraphie d'émission. Elle fait l'objet de ce chapitre qui explique en quoi la reconstruction d'images tomographiques relève d'un problème linéaire mal conditionné et sur quels principes fonctionnent les algorithmes de rétroprojection filtrée et les techniques itératives de reconstruction. Il exclut tout formalisme mathématique, mais pourra servir d'introduction à l'approfondissement plus complet [1], mais aussi plus scientifique de la tomographie médicale.
Introduction
Avec W. Röntgen et H. Becquerel, puis la famille Curie, le XIXe siècle finissant avait vu éclore une physique des rayonnements ionisants qui permettait pour la première fois de visualiser les organes internes d'un patient de façon non invasive. Le développement de l'imagerie radiologique qui suivit très vite, puis de l'imagerie scintigraphique resta cependant longtemps cantonné à la production d'images de projections où les signaux issus des divers plans perpendiculaires au rayonnement incident se superposaient sur un plan unique, rendant complexe l'interprétation médicale. Les solutions théoriques qui permirent de résoudre cette difficulté et de disposer d'une imagerie volumique ou reconstruite en coupes existaient pourtant dès le début du XXe siècle, avec les travaux des mathématiciens J. Radon en 1917 et S. Kaczmarz en 1937.
Mais il fallut attendre l'intervention d'un ingénieur talentueux, G.N. Hounsfield, au tout début des années 1970, le développement des calculateurs numériques qui accompagna la conquête de la Lune, puis le parrainage financier d'une société d'édition musicale qui bénéficiait dans les années 1960 du succès phénoménal de quatre chanteurs à la mode venus de Liverpool pour que naisse la tomographie médicale et que les premiers scanners prennent peu à peu la place qu'on leur connaît de nos jours dans le diagnostic médical.
Notion de projection
D'une manière assez générale, on cherche à obtenir des images en trois dimensions (3D) mais les acquisitions se font généralement en deux dimensions (2D). C'est le cas aussi pour la vision : nous percevons sur notre rétine (2D) l'image 2D d'un monde en 3D ; on parle de projection (figure 9.1A). Cela s'applique aussi à la plupart des techniques d'imagerie médicale : TDM, tomoscintigraphie, TEP et, dans certains cas, à l'IRM3.
Projection.
A. Une figure 3D est projetée sur un plan et transformée en figure 2D, comme une ombre projetée. B. Projeter selon différentes directions conduit à différentes projections à partir d'un même objet.
Dessin : Emmanuel Durand.
Le fait de projeter entraîne une perte d'information : à partir de l'ombre d'un objet, on ne peut pas déterminer l'objet lui-même. En revanche, la combinaison de différentes projections permet d'avoir une meilleure idée de l'objet de départ (figure 9.1B). C'est le principe général de la reconstruction tomographique, objet de ce chapitre.
Du point de vue informatique, on considère qu'une image est composée d'une matrice de voxels, considérés comme homogènes et caractérisés chacun par la valeur du signal physique qu'il contient. En pratique, la projection selon un axe vertical ou horizontal consiste simplement à faire la somme de toutes les valeurs le long d'une ligne ou d'une colonne (figure 9.2A). Bien entendu, une projection selon une direction oblique est plus complexe, mais le principe est le même. Projeter une image 3D sur un plan 2D est difficile à représenter et plus complexe à écrire en équations. Dans tout ce qui suit, nous partirons donc d'une image en 2D pour la projeter sur une ligne en 1D, ce qui est plus simple à la fois à représenter et à modéliser en équations. Le principe reste strictement le même pour passer du 3D au 2D.
A. Projection d'une matrice de voxels en lignes ou en colonnes. B. Si l'on représente les nombres de la matrice de manière symbolique par ai,j, on peut facilement calculer les valeurs des projections, par exemple : p1 = a1 + a2 + a3 ou p4 = a1 + a4 + a7. C. Le calcul des projections obliques est plus compliqué, faisant appel à des sinus et cosinus, mais se fait sur le même principe, par exemple ici p10 ≈ 0,8 × a1 + 0,9 × a2 + 0,15 × a5.
Dessin : Emmanuel Durand.
En tomoscintigraphie
En tomoscintigraphie, lorsqu'on utilise un collimateur parallèle, le signal de chaque voxel correspond au nombre de photons gamma résultant de l'activité dans ce voxel, lui-même proportionnel à la concentration de radioactivité. Le nombre total de photons détectés sur un élément de détection de la gamma-caméra correspond exactement à la somme des signaux des voxels le long d'une perpendiculaire au détecteur4 (figure 9.3 et voir figure 9.2B). L'image captée par le détecteur (2D) est donc bien une projection de l'activité de l'ensemble des voxels (3D). Il en va de même en TEP avec la détection en coïncidence.
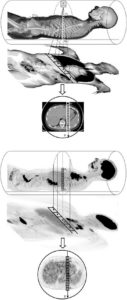
Projections et reconstructions en tomodensitométrie et en tomoscintigraphie.
Dessin : Denis Mariano-Goulart.
D'une manière générale, on peut exprimer la valeur de chaque projection comme :
pk = sum from {i} rk,i × ai (1)
où ai désigne le signal du voxel i, pk la projection k et les coefficients rk,i la proportion de volume du pixel i qui se projette effectivement dans la projection k. Dans l'exemple de la figure 9.2B, on aurait par exemple r1,1 = 1 ; r1,4 = 0 et r2,4 = 1. En faisant tourner la gamma-caméra autour du patient, on peut ainsi obtenir de très nombreuses projections sous des angles différents. En TEP, la détection en coïncidence permet d'obtenir simultanément des projections dans toutes les directions visibles du détecteur.
En tomodensitométrie
En TDM, on envoie un faisceau de rayons X d'intensité I0 ; après avoir traversé le patient, ce faisceau ressort de manière atténuée avec une intensité Ii. La loi générale d'atténuation est :
Ii = I0 × e-μL (2)
après la traversée d'une longueur L d'un milieu de coefficient d'atténuation μ (voir figure 9.3).
Si l'on considère la traversée des 3 voxels numérotés 1, 2 et 3 comme sur la figure 9.2B, en désignant par d la largeur du voxel, l'atténuation de la première ligne de projection sera donnée par :
I1 = I0 × e-µ1d × e-µ2d × e-µ3d = I0 × e-( µ1 + µ2 + µ3)d (3)
L'opération n'est donc pas une simple somme, comme dans la tomoscintigraphie. Cependant, en transformant l'équation 3, on aboutit facilement à :
ln(I0 /I1) / d = µ1 + µ2 + µ3 (4)
On est donc ramené exactement au problème précédent de la tomoscintigraphie où chaque projection est la somme des signaux des voxels. Dans le cas de la TDM, le signal d'un voxel correspond au coefficient d'atténuation. Comme en tomoscintigraphie, on fait tourner le tube et le détecteur autour du patient pour acquérir de très nombreuses projections sous différents angles.
Problème direct – problème inverse
L'acquisition de l'image consiste à mesurer l'ensemble des projections pk. La reconstruction de l'image consiste à en déduire l'ensemble des signaux des voxels ai qui sont des inconnues. Modéliser l'acquisition revient à déterminer l'ensemble des coefficients rk,i qui déterminent les projections. En gros, cela revient à être capable de modéliser l'acquisition des projections, c'est-à-dire, connaissant les valeurs des voxels ai, à être capable de prédire les projections pk. On appelle cela le problème direct. C'est finalement assez simple si l'on connaît la géométrie de l'acquisition.
Dans la « vie réelle », on ne connaît pas les valeurs des voxels ; c'est même justement ce qu'on cherche à déterminer à partir des projections qu'on a pu mesurer. On appelle cela un problème inverse. On dispose donc de données connues, les projections pk, d'un système d'équations linéaires du style de l'équation 1 : pk = sum ( rk,i × ai). Il suffit donc en théorie de trouver les inconnues ai en résolvant ce système.
Résolution du problème inverse en résolvant le système d'équations
Dans le cas simplifié représenté par la figure 9.4, on a un système de 4 équations à 4 inconnues (a,b,c et d).
Cas simplifié.
Dessin : Emmanuel Durand.
Il est donc en théorie relativement facile de le résoudre, en particulier si l'on dispose de calculateurs électroniques. En pratique, si l'on considère une image 3D en matrice 256 × 256 × 256, on a donc 16 777 216 inconnues ; il faut un nombre d'équations au moins égal pour pouvoir le résoudre. Cette résolution mathématique théorique nécessite alors beaucoup de calculs élémentaires et est mise en défaut par une propriété propre à la plupart des grands systèmes d'équations linéaires.
Pour l'illustrer, simplifions encore notre exemple en nous attachant à reconstruire une image constituée de deux pixels (a,b) seulement, au moyens de deux projections p1 et p2.
Les deux équations de projection s'écrivent :
D1 : p1 = r11 · a + r12 · b
D2 : p2 = r11 · a + r12 · b
Dans un graphe où l'on place en abscisse les valeurs possibles de a et en ordonnée celles de b, ces deux équations sont celles de deux droites D1 et D2 dont l'intersection est la solution (a,b) du système, donc la coupe recherchée. Si ces deux équations sont très différentes l'une de l'autre (figure 9.5A), une petite erreur sur la modélisation des coefficients rij ou sur la mesure des projections pi par l'appareil d'imagerie conduit à une erreur minime (a′,b′) sur l'estimation de l'intersection de ces deux droites, donc de l'image recherchée. En revanche, si les deux équations ont des coefficients proches, la moindre erreur sur le modèle (rij) ou sur les mesures de projections (pi) donnera un résultat complètement erroné pour la coupe, avec une solution (a′,b′) très éloignée de la vérité (figure 9.5B). En tomographie, où l'on acquiert beaucoup de projections très proches les unes des autres, cette seconde situation est malheureusement la règle.
A, B. Les droites grises en pointillées représentent des projections légèrement différentes des projections exactes, en traits pleins noirs.
On constate que si deux projections sont proches, une erreur importante sur l'estimation de l'image en coupe (a, b) peut subvenir si ces projections sont faiblement bruitées.
Dessin : Denis Mariano-Goulart.
Pour cette raison, la technique qui semble a priori la plus simple, résoudre un système d'équations par un algorithme standard (déterminant, pivot de Gauss, etc.), ne peut pas être utilisée. Cela va donc nécessiter l'utilisation d'algorithmes plus complexes que ceux classiquement utilisés en algèbre.
Rétroprojection
Pour comprendre comment se fait la reconstruction, nous avons besoin de décrire un nouvel opérateur appelé « rétroprojection ». Mathématiquement, la rétroprojection consiste à sommer, au sein d'un pixel image i, chacune des projections k auquel il participe, pondérées par le coefficient rk,i.
Projection : pk = sum from {i} rk,i × ai (5)
Rétroprojection : bi = sum from {k} <?> rk,i × pk (5)
Concrètement, il s'agit de « propager » la valeur projetée, dans la direction de la projection, sur tous les pixels concernés (figure 9.6), et de sommer le résultat pour toutes les projections. On voit ici que l'image de rétroprojection (normalisée) ne correspond pas vraiment à l'image de départ : la rétroprojection n'est donc pas l'opération inverse de la projection. Cependant, on constate des similitudes ; par exemple, le voxel central a la valeur la plus élevée sur les deux images ; l'angle supérieur gauche a la plus faible valeur dans les deux cas.
Principe de la rétroprojection.
On prend les projections verticales et on les rétroprojette verticalement en « propageant » chaque valeur sur toute la colonne ; on fait de même avec les projections horizontales, puis on ajoute l'ensemble des rétroprojections. On peut ensuite normaliser la rétroprojection en divisant par le nombre de rétroprojections (6 ici). N.B. : pour modéliser correctement une image de 3 × 3 = 9 pixels, il faudrait au moins 9 projections. On en a pris moins ici par souci de simplification.
Dessin : Emmanuel Durand.
L'application de cet opérateur de rétroprojection pour la reconstruction des images à partir de projections produit des images qui ressemblent à l'image originale, sans lui être identique (figure 9.7). Cela illustre encore le fait que la rétroprojection n'est pas l'opérateur inverse de la projection.
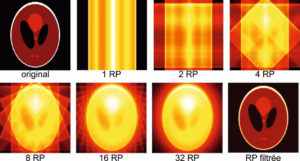
Rétroprojection.
À partir d'une image originale (simplifiée) dont on a déterminé les projections dans diverses directions, on construit les rétroprojections avec un nombre de projections allant de 1 à 32 ; on voit alors se dessiner progressivement une représentation imparfaite de l'image originale. Seule une opération de filtrage permettra de retrouver une représentation fidèle de l'image originale.
Dessin : Emmanuel Durand.
Rétroprojection filtrée
La simple opération de rétroprojection ne permet donc pas d'obtenir une image fidèle ; on voit en effet, sur les images reconstruites, des artefacts en étoile ou en halo correspondant aux traînées de rétroprojection (figure 9.8 et voir figure 9.7). On constate ainsi sur la figure 9.6 que le contraste entre le centre et les bords est plus faible sur l'image reconstruite par rétroprojection que sur l'image originale. Avant de rétroprojeter, il faut donc accentuer le contraste pour compenser cet effet. Ce filtrage, appelé « filtre rampe » et fondé sur des bases mathématiques solides, peut s'illustrer de la manière suivante : on va renforcer le contraste en changeant la valeur rétroprojetée ; au lieu de prendre la valeur obtenue par projection (voir figure 9.6), on prendra le double de cette valeur diminuée des deux tiers des valeurs des projections adjacentes.
Illustration des opérations de projection, de rétroprojection et de rétroprojection filtrée dans le cas d'une tomoscintigraphie cérébrale.
Dessin : Denis Mariano-Goulart.
Lorsqu'on multiplie le nombre de rétroprojections filtrées, on obtient une image fidèle à l'objet original (figure 9.9).
Rétroprojection filtrée.
Par rapport à la rétroprojection simple, au lieu d'utiliser la valeur de projection, on prend le double et on retranche les deux tiers de chaque projection voisine. Dans cet exemple simple, la reconstruction permet de trouver l'objet qu'on a projeté. En pratique, il faut généralement prendre davantage de projections pour obtenir une reconstruction correcte (ici, on n'a que 2 projections de 3 pixels, soit 6 valeurs numériques ; dans le cas général, il en faut davantage pour reconstruire une image de 3 × 3 = 9 pixels).
Dessin : Emmanuel Durand.
Reconstruction itérative
L'algorithme de rétroprojection filtrée ne nécessite pas de calculateurs électroniques puissants et a été universellement utilisé en TDM et en tomoscintigraphie jusqu'à la fin du XXe siècle. Dans les années 1970, exploitant des travaux initialement dus au mathématicien polonais S. Kaczmarz, une nouvelle famille d'algorithmes dits itératifs (ou algébriques) s'est peu à peu imposée en imagerie scintigraphique, puis en radiologie. Son développement, rendu possible par la puissance de calcul des ordinateurs modernes, a permis de réduire l'irradiation des patients en radiologie tout en se contentant, en particulier en TEP, de données de projections parfois incomplètes (ce que l'algorithme de rétroprojection filtrée ne permet pas). Ces techniques permettent en outre de mieux prendre en compte le mauvais conditionnement du problème tomographique (régularisation) et de mieux corriger certains artefacts inhérents aux acquisitions des projections (auto-atténuation en médecine nucléaire). Cette famille d'algorithmes a en commun de déterminer la coupe compatible avec les projections effectivement acquises en évaluant un écart entre celles-ci et des projections calculées à partir d'une estimation de la solution, puis en corrigeant l'estimation de la coupe au moyen de l'écart constaté.
En d'autres termes, on est capable d'acquérir des projections du corps humain en utilisant un appareil d'imagerie (TDM ou gamma-caméra). Comme nous l'avons vu, l'opération inverse n'est pas simple. En revanche, si l'on dispose d'une image informatique de l'objet, il est très simple d'en faire des projections au moyen d'un programme informatique. On peut alors comparer les projections de l'objet et les projections de son image. Le principe des techniques itératives est donc de trouver, par approximations successives, l'image qui donnera les mêmes projections que celles obtenues lors de l'acquisition (figure 9.10).
Principe des techniques itératives.
On ne peut pas simplement réaliser l'opération inverse de la projection, mais on peut projeter informatiquement l'image reconstruite, comme on peut projeter l'objet. La comparaison des projections permet de modifier l'image reconstruite pour la rendre plus proche de l'objet.
Dessin : Emmanuel Durand.
Le prototype de ce type d'algorithme itératif, ART (algebraic reconstruction technique), procède de la manière suivante : à partir d'une première coupe quelconque, l'algorithme ajuste étape par étape la coupe recherchée au moyen d'une rétroprojection normalisée par de l'écart entre les projections effectivement mesurées et celles déduites de la coupe en cours d'évaluation (figure 9.11).
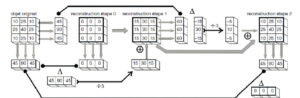
Reconstruction itérative : exemple simplifié.
On part d'une image vierge (composée de 0) et on la projette verticalement. On compare cette projection (0 ; 0 ; 0) à la projection de l'objet dans la même direction (45 ; 90 ; 45). On en fait la différence qu'on normalise en divisant par 3 (car somme sur 3 pixels). On obtient (15 ; 30 ; 15) qu'on va rétroprojeter dans la même direction verticale et l'ajoutant à l'image de départ. On obtient alors la reconstruction à l'étape 1. On va maintenant faire une projection de cette nouvelle image reconstruite dans une autre direction, ici horizontale ; on obtient (60 ; 60 ; 60) qu'on va comparer à la projection de l'objet dans la même direction (45 ; 90 ; 45). On normalise la différence en divisant par 3 pour obtenir (–5 ; 10 ; –5). On rétroprojette cette projection horizontalement et on l'ajoute à l'image précédemment reconstruite. Dans cet exemple simple, la reconstruction permet de trouver l'objet qu'on a projeté dès la deuxième itération. En pratique, il faut généralement prendre davantage de projections pour obtenir une reconstruction correcte.
Dessin : Emmanuel Durand.
L'algorithme itératif qui s'est imposé depuis les années 2000 opère itérativement comme ART, mais la correction est cette fois multiplicative et l'écart est évalué par le rapport entre projections acquises et estimées.
Plus précisément, cet algorithme fonctionne en multipliant chaque valeur inconnue de pixel i par la moyenne pondérée (par les coefficient ri,j) des rapports entre les projections j acquises et estimées qui concernent ce pixel i (voir figure 12). Il porte le nom de MLEM (pour maximum likelihood-expectation-maximisation), d'OSEM dans sa version accélérée ou de MAP-OSEM dans sa version régularisée.
6.6.Le lecteur pourra reprendre l'exemple de la figure 9.12 en initialisant la matrice à l'étape 0 avec autre chose que des 1. Il pourra alors constater qu'on aboutit à une convergence de l'algorithme sur une solution différente. Par exemple, une initialisation avec :
conduirait en une seule itération à la solution :
Cela illustre le fait qu'il peut y avoir plusieurs solutions au problème lorsque le nombre de projections est insuffisant.
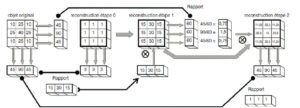
Algorithme itératif multiplicatif.
On part d'une image vierge composée de 1 qu'on projette dans une première direction (ici verticale) ; on compare la projection obtenue (3 ; 3 ; 3) avec la projection de l'objet dans la même direction (45 ; 90 ; 45). Le rapport (15 ; 30 ; 15) va être rétroprojeté dans la même direction (verticale) pour servir de facteur multiplicatif pour obtenir l'image reconstruite à l'étape 1. En partant de cette dernière image, on réalise une projection dans une autre direction et on continue sur le même principe. Dans cet exemple simple, la reconstruction permet d'atteindre une convergence dès la deuxième itération. Le résultat obtenu n'est pas tout à fait l'image de départ : en pratique, il faut généralement prendre davantage de projections pour obtenir une reconstruction correcte.
Dessin : Emmanuel Durand.
Essentiel à retenir
- Les images acquises en radiographie et en scintigraphie sont des images de projection.
- Reconstruire une image en coupe revient à résoudre un grand système mal conditionné d'équations linéaires.
- Les techniques de reconstruction incluent l'algorithme de rétroprojection filtrée (et autres techniques analytiques apparentées) et les techniques itératives (ou algébriques) parmi lesquelles MLEM et sa variante OSEM sont les plus utilisées.
- Les techniques itératives présentent divers avantages parmi lesquels la possibilité de reconstruire des coupes à partir de données de projection incomplètes, de diminuer l'irradiation du patient en TDM et de mieux corriger les artefacts d'atténuation en TEP et tomoscintigraphie.
- L'algorithme MLEM opère itérativement en multipliant chaque valeur de pixel j de la coupe par la moyenne pondérée (par les coefficient ri,j) des rapports entre les projections i acquises et estimées qui concernent ce pixel j.
Référence
[1] Mariano-Goulart D. Reconstruction tomographique en imagerie médicale. EMC (Elsevier Masson SAS, Paris), Radiodiagnostic - Principes et techniques d'imagerie. 35-105-A-10 ; 2015.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 8 - Imagerie par résonance magnétique
T. Tourdias et V. Lebon
Plan du chapitre
- Le phénomène de résonance magnétique nucléaire
- Principes de localisation du signal en IRM
- Les principales séquences d'IRM
- Agents de contraste en IRM
- Réalisation pratique d'un examen IRM
Objectifs
- Connaître les bases du phénomène de résonance magnétique nucléaire.
- Connaître les principes généraux permettant la localisation spatiale du signal en IRM.
- Connaître le principe général des principales séquences d'IRM.
- Connaître les règles d'utilisation des agents de contraste pour l'IRM.
- Savoir expliquer à un patient la conduite pratique d'un examen IRM.
Le phénomène de résonance magnétique nucléaire
Apparue à l'hôpital dans les années 1980, l'imagerie par résonance magnétique (IRM) exploite le phénomène de résonance magnétique nucléaire (RMN). Ce phénomène, qui met en jeu les particules élémentaires du noyau atomique, peut être décrit en toute rigueur par la mécanique quantique. Cependant, les phénomènes macroscopiques observés lors d'une expérience d'IRM peuvent être décrits à l'aide d'outils vectoriels plus simples. Cette description phénoménologique, qui repose sur un formalisme mathématique adapté au diplôme de formation générale en sciences médicales (DFGSM), sera utilisée dans ce chapitre.
Notions de source magnétique, de champ magnétique et d'aimantation
Une source magnétique est un système qui génère un champ magnétique , dont la valeur s'exprime en teslas (T). C'est par exemple une boucle de courant (courant électrique dans un circuit en forme de cercle : électro-aimant), ou bien une tige de métal aimantée comme l'aiguille d'une boussole (figure 8.1).
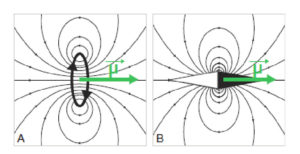
Exemples de sources magnétiques.
Une boucle de courant (A) ou une aiguille aimantée (B) génèrent un champ magnétique, représenté par les lignes de champ ; le moment magnétique µ est une représentation vectorielle de la source magnétique.
Cette source génère un champ magnétique, champ vectoriel qu'on peut représenter sous forme de lignes d'isochamp dans un plan particulier de l'espace. Une façon plus simple de représenter la source magnétique consiste à utiliser un vecteur, qu'on appelle « moment magnétique » et qu'on note . La norme du vecteur traduit l'intensité de la source magnétique et les coordonnées du vecteur traduisent l'orientation de cette source. La densité de moment magnétique (moment magnétique par unité de volume) est appelée « aimantation » et notée M.
Deux moments magnétiques interagissent entre eux via leurs champs magnétiques. Le champ magnétique B0 résultant d'un premier moment magnétique exerce un couple sur le second moment, c'est-à-dire qu'il tend à le faire tourner pour l'aligner dans la direction du champ magnétique (figure 8.2). La position d'équilibre d'une aimantation dans un champ magnétique est donc la position alignée par rapport à ce champ. C'est ainsi que le champ magnétique terrestre oriente l'aiguille des boussoles.
Interaction entre une aimantation μ et un champ magnétique statique B0: µ s'aligne parallèlement à B0.
Aimantation nucléaire
Les noyaux de certains atomes possèdent une aimantation intrinsèque. Par analogie avec la boucle de courant, on considère cette aimantation comme résultant du déplacement des particules élémentaires chargées qui tournent sur elles-mêmes ou en orbite. Le terme « spin » (qui signifie tourner en anglais) est parfois utilisé pour désigner l'aimantation d'une particule élémentaire qui tourne sur elle-même. En toute rigueur, le spin désigne un observable quantique dont la manipulation dépasse le cadre de cet ouvrage.
Les noyaux d'hydrogène – qui sont constitués d'un simple proton – font partie des noyaux possédant une aimantation intrinsèque. Ils présentent un intérêt majeur pour l'exploration du corps humain dans lequel l'hydrogène est très abondant, puisque les tissus biologiques sont principalement constitués d'eau et de triglycérides (graisse sous-cutanée et viscérale). L'IRM consiste à détecter l'aimantation des noyaux d'hydrogène et à la localiser pour reconstruire des images qui, en première approximation, sont des cartes de distribution de l'eau et de la graisse du corps humain.
Détecter les aimantations nucléaires n'a rien d'évident, pour deux raisons :
- en l'absence de champ magnétique, les aimantations microscopiques sont orientées aléatoirement (figure 8.3A), si bien que leur somme vectorielle est nulle. Cela reste vrai dans le champ magnétique terrestre dont l'intensité est trop faible pour modifier significativement l'orientation des aimantations microscopiques. Il faudra donc au préalable « polariser » ces aimantations, c'est-à-dire les orienter dans une direction privilégiée ;
- on ne sait détecter efficacement une aimantation peu intense (ce qui est le cas de l'aimantation nucléaire) qu'en la mettant en mouvement. Il faudra pour cela la mettre en résonance.
A, B. Polarisation des aimantations nucléaires.
En l'absence de champ magnétique, les aimantations des noyaux d'hydrogène sont orientées de manière aléatoire : leur somme vectorielle est nulle (A) ; en présence d'un champ B0, elles s'orientent le long du champ B0, en position parallèle ou antiparallèle. L'orientation parallèle étant majoritaire, il en résulte une aimantation macroscopique M0 parallèle à B0(B).
Les noyaux d'hydrogène sont donc porteurs d'une aimantation qui tend spontanément à s'aligner avec le champ magnétique B0.
Polarisation de l'aimantation par un champ magnétique B0
En présence d'un champ magnétique B0, les aimantations des noyaux d'hydrogène adoptent une orientation privilégiée. Par analogie avec les aimantations macroscopiques, on peut les représenter comme des vecteurs tendant à s'aligner parallèlement à B0. Mais, à l'échelle atomique, l'énergie d'interaction entre l'aimantation d'un noyau d'hydrogène et le champ B0 est quantifiée : elle ne peut prendre que deux valeurs discrètes. Cela implique que l'aimantation nucléaire ne peut adopter que deux orientations dans le champ magnétique B0: « parallèle » et « antiparallèle » (figure 8.3B). L'état parallèle est plus peuplé que l'état antiparallèle. Le surplus d'aimantations microscopiques orientées dans la même direction que B0 donne naissance à une aimantation nucléaire macroscopique M0.
M0 est reliée à B0 par la relation : M0 = x * B0. Le coefficient de proportionnalité χ est la susceptibilité magnétique qui caractérise la capacité d'un milieu de s'aimanter sous l'effet d'un champ magnétique externe. Dans un milieu homogène infini de susceptibilité χ, si l'on applique un champ magnétique B0, le milieu va s'aimanter et le champ magnétique résultant sera (1 + χ).. Selon le cas, on peut avoir :
- χ < 0 : le champ magnétique est diminué en présence du matériau qui est dit « diamagnétique » ;
- χ > 0 de faible valeur : le champ magnétique est renforcé en présence du matériau qui est dit paramagnétique ;
- χ > 0 de forte valeur : le champ magnétique est très renforcé en présence du matériau qui est dit ferromagnétique.
Une fois l'aimantation macroscopique M0 créée, il faut la mettre en mouvement pour la détecter.
Dans un fort champ magnétique, les aimantations des noyaux d'hydrogène s'alignent entre elles. La résultante est une aimantation globale de la matière alignée sur B0 qui va être à l'origine du phénomène de RMN.
Mise en résonance de l'aimantation par une excitation radiofréquence
En physique, la résonance désigne un phénomène physique qui permet de transférer de l'énergie à un système par un phénomène oscillatoire. Le transfert d'énergie n'est possible que s'il s'effectue à une fréquence propre au système dite fréquence de résonance. Si on soumet un système résonant à une excitation ponctuelle (impulsion), alors le système sera le siège d'oscillations amorties, sur une fréquence proche de sa fréquence propre, et retournera progressivement à son état stable. Ce phénomène existe dans de très nombreux domaines de la physique : en acoustique, en électricité ou en mécanique.
C'est ce principe de résonance qu'on utilise pour mettre en mouvement l'aimantation macroscopique M0. Pour transférer de l'énergie à une aimantation placée dans un champ magnétique B0, il faut lui appliquer une onde électromagnétique dont la fréquence f0 est donnée par la relation de Larmor : f0 = γ/(2π). La fréquence propre de l'aimantation f0 est appelée fréquence de Larmor. La constante γ est appelée rapport gyromagnétique. C'est une constante caractéristique de chaque noyau possédant une aimantation. Pour le noyau d'hydrogène, γ/(2π) = 42,57 mégahertz par tesla (MHz/T). Pour les champs magnétiques utilisés en IRM, l'ordre de grandeur de f0 est 100 MHz, ce qui correspond aux fréquences de la bande FM, d'où l'appellation « ondes radiofréquence » (RF). L'émetteur utilisé en IRM fonctionne selon les mêmes principes qu'un émetteur radio. Il s'agit d'une antenne d'émission de forme généralement cylindrique qui est intégrée dans le tunnel de l'IRM.
L'énergie transférée par l'onde RF se traduit par le basculement de l'aimantation qui s'écarte de sa position d'équilibre le long de B0 (figure 8.4A). Cela correspond à l'excitation radiofréquence. Pour décrire l'évolution temporelle de l'aimantation, on se place dans un repère (O,x,y,z) centré sur l'aimantation, dont la direction z est celle du champ magnétique B0 (direction du tunnel de l'IRM), qui est également la direction de l'aimantation à l'équilibre M0. On désigne z comme la direction longitudinale et le plan (x, y) comme le plan transverse. Le vecteur aimantation M peut se décomposer en une composante longitudinale (dont la projection sur z vaut Mz) et une composante transversale de norme Mxy (figure 8.4B). Ainsi, lorsque l'aimantation est à l'équilibre avec B0, à distance de toute excitation RF, on a : Mz = M0 et Mxy = 0. Juste après une excitation basculant l'aimantation de 90°, on a : Mz = 0 et Mxy = M0.
Excitation radiofréquence.
L'application d'une onde électromagnétique à la fréquence de Larmor f0 bascule l'aimantation vers le plan transverse (A) ; l'aimantation écartée de sa position d'équilibre peut être décrite par ses composantes transversale Mxy et longitudinale Mz (B).
L'excitation RF peut être caractérisée par l'angle dont l'aimantation bascule, qui est proportionnel à la durée d'application de l'onde RF et à l'intensité de cette onde. L'angle de bascule peut donc être choisi librement en jouant sur ces deux paramètres. En IRM, on utilise des émissions très courtes, de l'ordre de la milliseconde : on parle d'impulsions radiofréquences.
Sous l'influence d'une onde radio à une fréquence caractéristique (fréquence de Larmor), l'aimantation des noyaux d'hydrogène pivote et se retrouve perpendiculaire à B0. Initialement portée par l'axe longitudinal (parallèle à B0), l'aimantation se retrouve donc dans le plan transversal (perpendiculaire à B0)
Retour à l'équilibre de l'aimantation
Suite à l'impulsion RF, l'aimantation retourne à sa position d'équilibre le long de z, de la même manière que l'aiguille d'une boussole s'aligne sur le champ magnétique terrestre. Toutefois, le retour à l'équilibre de l'aimantation ne s'effectue pas selon une rotation vers l'axe z, mais selon une dynamique complexe combinant trois processus :
- la rotation de M autour de la direction de B0 (axe z) à la fréquence de Larmor f0 (figure 8.5A). Ce mouvement de rotation est désigné par le terme de précession libre, parce qu'il s'effectue en l'absence de toute excitation RF. Il faut noter que la précession s'effectue à une vitesse remarquablement élevée : dans un champ magnétique de 1,5 tesla, f0 vaut 63,9 MHz, ce qui signifie que M effectue 63 900 000 tours en une seconde. Ce mouvement de rotation correspond au signal d'IRM ;
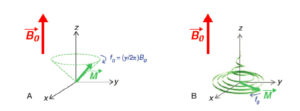
Retour à l'équilibre.
Après l'excitation RF, l'aimantation retourne à sa position d'équilibre selon un mouvement combinant une précession autour de l'axe z à la fréquence f0 (A), une décroissance exponentielle en T2 de la composante transversale Mxy et une récupération exponentielle en T1 de la composante longitudinale Mz ; la trajectoire parcourue par l'extrémité du vecteur M dessine une forme de « chapeau pointu » (B).
- la disparition de la composante transversale Mxy qu'on appelle la relaxation transversale : dès la fin de l'excitation RF, l'intensité de l'aimantation transversale décroît selon un processus exponentiel caractérisé par la constante de temps T2, décrit par l'équation : dMxy/dt = –1/T2 Mxy(t). Pour une impulsion RF de 90°, cette équation admet pour solution : Mxy(t) = M0 exp(–t/T2). La constante T2 est le temps de relaxation transversale. Il caractérise la persistance transversale de l'aimantation. Dans les tissus mous, le T2 de l'eau est de l'ordre de 0,1 seconde. Cette relaxation transversale correspond à l'épuisement du signal IRM ;
- la récupération de la composante longitudinale qu'on appelle la relaxation longitudinale : dès la fin de l'excitation RF, l'intensité de l'aimantation longitudinale croît selon un processus exponentiel caractérisé par la constante de temps T1, décrit par l'équation : dMz/dt = 1/T1 [M0–Mz(t)]. Pour une impulsion RF de 90°, cette équation admet pour solution : Mz(t) = M0.[1-exp(–t/T1)]. La constante T1 est le temps de relaxation longitudinale. Il caractérise la vitesse à laquelle l'aimantation retourne à sa valeur d'équilibre M0. Dans les tissus mous, T1 est de l'ordre de 1 seconde (aux valeurs de B0 utilisées pour l'IRM). Cette relaxation longitudinale correspond à la régénération de la réserve de signal.
Lors de la relaxation, les composantes transversale et longitudinale évoluent donc chacune selon leur propre dynamique, indépendamment l'une de l'autre. Cela traduit le fait que la relaxation n'est pas une rotation de M depuis le plan transversal vers l'axe z : ce n'est pas une « excitation à l'envers ». Ainsi, le module de M n'est pas conservé lors du retour à l'équilibre : le T2 de l'eau étant sensiblement plus court que le T1 dans les tissus biologiques, Mxy disparaît avant que Mz retrouve sa valeur d'équilibre M0. Ce phénomène est illustré sur la figure 8.5B où la trajectoire de l'extrémité du vecteur aimantation est tracée. La trajectoire représentée tient compte des trois processus participant au retour à l'équilibre de l'aimantation : la précession libre, la relaxation transversale et la relaxation longitudinale. L'enveloppe de cette trajectoire présente la forme d'un « chapeau pointu ». Plus le T2 est court par rapport au T1, plus les bords du chapeau apparaîtront plats et la pointe étroite. Le fait que T1 et T2 soient deux constantes indépendantes a une conséquence majeure en IRM : les images pondérées en T1 et en T2 ne sont pas redondantes et apportent des informations complémentaires sur les tissus biologiques.
La figure 8.6 représente l'évolution temporelle des projections de M sur z (composante longitudinale) et sur x (composante transversale) après une excitation de 90°. La composante longitudinale Mz évolue selon une exponentielle croissante en T1. Mz est insensible au mouvement de précession puisqu'il s'effectue autour de z. Ce n'est évidemment pas le cas de Mx qui est la projection du vecteur tournant Mxy. À la relaxation transversale en T2 s'ajoute donc une oscillation de Mx à la fréquence f0. Pour simplifier la représentation de la composante transversale, on la représente couramment dans un repère (O,x′,y′,z) tournant autour de z à f0, qu'on appelle repère de Larmor. Dans ce repère, Mx′ évolue selon une simple exponentielle décroissante en T2.
Évolution temporelle des projections de M sur z (composante longitudinale) et sur x (composante transversale) pendant et après une excitation RF de 90°.
Mx′ est la projection sur l'axe x′ du repère de Larmor qui tourne autour de z à la fréquence f0.
Nous verrons que, pour acquérir une image par résonance magnétique, il faut répéter un grand nombre d'excitations RF relativement rapidement. Le délai entre deux excitations RF successives est appelé temps de répétition (TR). La question se pose donc de savoir comment l'aimantation évolue lorsqu'on applique une seconde impulsion RF après un délai TR :
- court par rapport à T1, si bien que Mz est encore éloignée de sa valeur d'équilibre M0 après TR ;
- long par rapport à T2, si bien que Mx′ peut être considérée comme nulle après TR.
La figure 8.7A illustre le retour à l'équilibre de M dans cette configuration. Juste avant cette 2e impulsion :
Évolution temporelle des composantes Mz et Mx′ lorsqu'une 2e excitation de 90° est appliquée après un délai TR.
Juste après la 2e excitation, Mx′ décroît selon une exponentielle en T2 à partir de la valeur M0(1-e(-TR/T1)) (A) ; la relaxation transversale d'une répétition dépend donc de la relaxation longitudinale de la répétition précédente (B).
Mz = M0.[1–exp(–TR/T1)] et Mx′ = 0 ; l'aimantation est alignée sur z. La 2e impulsion de 90° la bascule vers le plan transverse (x′,y′). Juste après la 2e impulsion :Mz = 0 et Mx' = M0.[1–exp(–TR/T1)]. Mz relaxe ensuite en T1 : Mz(t) = M0.[1–exp(–t/T1)]. Mx′ relaxe en T2, mais à partir de la valeur initiale M0.[1–exp(–TR/T1)], ce qui donne : Mx′(t) = M0.[1–exp(–TR/T1)].exp(–t/T2). Ainsi, la composante transversale décroît exponentiellement en T2, mais son intensité dépend de T1.
La figure 8.7B représente Mz(t) pendant la 1re répétition et Mx′(t) pendant la 2e répétition. Cette représentation illustre plus directement le fait que la relaxation transversale d'une répétition dépend de la relaxation longitudinale de la répétition précédente.
Après l'excitation RF, l'aimantation retourne à son état d'équilibre avec un mouvement complexe : précession (rotation) autour de B0 qui est source du signal d'IRM et relaxation (disparition de la composante transversale et régénération de la composante longitudinale).
Détection de l'aimantation lors de son retour à l'équilibre
Lorsqu'une aimantation se déplace à proximité d'un circuit électrique en boucle, les lignes de champ qui traversent le circuit varient dans le temps : il y a variation du flux magnétique à travers le circuit. La loi de Faraday énonce que toute variation du flux magnétique traversant un circuit électrique induit une tension – aussi appelée force électromotrice – aux bornes du circuit. Ce phénomène d'induction électromagnétique est exploité dans de très nombreuses applications industrielles (production d'électricité, moteurs électriques, plaques à induction, recharge de téléphones sans fil, etc.).
En IRM, on place la boucle de circuit électrique à proximité du sujet pour détecter la tension induite par la précession de l'aimantation pendant son retour à l'équilibre (figure 8.8). En théorie, ce circuit peut être le même que celui utilisé pour l'excitation RF. En pratique, on utilise des circuits de plus petite taille placés près de la région anatomique à examiner, ce qui maximise le flux magnétique à travers le circuit et augmente la sensibilité de détection. On parle pour ces circuits d'antennes de réception (antenne tête, antenne rachis, antenne genou, etc.).
Le signal détecté en RMN est la tension induite aux bornes de l'antenne de réception par la précession de l'aimantation.
Signal RMN
Le signal détecté en RMN est la tension générée aux bornes de l'antenne de réception par la précession de l'aimantation. La loi de Faraday énonce que cette tension est proportionnelle à la vitesse à laquelle l'aimantation change. Comme illustré sur la figure 8.6, Mz et Mxy présentent des dynamiques temporelles très différentes lors du retour à l'équilibre : Mz passe de 0 à M0 en quelques secondes tandis que Mx passe de + M0 à –M0 plusieurs dizaines de millions de fois par seconde (63 millions de fois à 1,5 tesla). C'est donc la composante transversale Mxy qui génère le signal détecté. Ce signal est proportionnel à Mxy.
Après une impulsion de 90°, le signal détecté s'exprime donc sous la forme S(t) = S0·exp(–t/T2). Le terme S0 est proportionnel à M0 et dépend de nombreux facteurs instrumentaux (géométrie de l'antenne de réception, chaîne électronique de détection, etc.). Après une 2e impulsion de 90° appliquée au temps TR, on a :S(t) = S0·[1–exp(–TR/T1)]·exp(–t/T2).
Principes de localisation du signal en IRM
À ce stade, nous avons vu comment détecter les aimantations de l'eau et de la graisse des tissus biologiques : nous sommes capables de déterminer s'il existe de l'eau et de la graisse chez un sujet placé dans une IRM. Reste à localiser ces molécules au sein du corps humain, c'est-à-dire à obtenir une image par résonance magnétique.
Il est admis que la précision de localisation d'une onde électromagnétique est donnée par sa longueur d'onde. Cela explique que les rayonnements utilisés en imagerie médicale peuvent généralement être localisés avec une grande précision, comme les rayons X ou γ qu'on peut facilement focaliser ou collimater, alors que la résolution de la microscopie optique est limitée à une fraction de micromètre. Cependant, la longueur d'onde des impulsions RF utilisées en RMN est de l'ordre du mètre. On ne peut donc pas focaliser l'onde RF émise par l'antenne d'émission sur un point précis du corps humain : cette onde excite l'ensemble du volume de l'antenne d'émission. De même, le signal détecté par l'antenne de réception provient de l'ensemble du volume vu par l'antenne.
Le principe de localisation utilisé en IRM repose sur l'équivalence entre la fréquence de Larmor f0 et la position spatiale des aimantations. Dans le champ B0 de l'IRM, les aimantations ont toutes la même fréquence de Larmor. Pour introduire une dépendance entre la position spatiale et f0, il suffit de faire varier le champ B0 dans l'espace au moyen de gradients de champ magnétique.
Pour se repérer dans l'espace en IRM, on utilise un gradient de champ magnétique qui établit une relation linéaire entre espace et champ magnétique. Comme la fréquence de résonance est elle-même proportionnelle au champ magnétique, cela induit une relation linéaire entre fréquence de résonance et coordonnée d'espace. On repérera donc la position d'un objet par sa fréquence de résonance.
Notion de gradient de champ magnétique
Par définition, un gradient de champ magnétique G est une variation linéaire du champ selon une direction de l'espace. Par exemple, un gradient Gz appliqué selon z génère un champ magnétique Gz·z. Il en va de même pour x et y, comme illustré à la figure 8.9. En pratique, les gradients sont générés par des bobines enroulées dans le tunnel de l'IRM, dans lesquelles on fait circuler du courant pour établir le gradient.
Gradients de champ magnétique selon z (A), y (B) et x (C).
Principe de la sélection de coupe
La sélection de coupe consiste à exciter les aimantations d'un plan de coupe particulier du sujet placé dans l'IRM. Pour ce faire, il faut que l'onde RF d'excitation, qui se propage dans tout le sujet, ne bascule les aimantations que d'un plan de coupe. Dans le cas d'une coupe orthogonale à z (figure 8.10), cela est obtenu en appliquant un gradient Gz simultanément à l'excitation RF. En présence du gradient, le champ magnétique s'écrit : B0(z) = B0 + Gz · z. La fréquence de Larmor dépend ainsi de la position selon z : f0(z) = f0(0) + γ / (2π) · Gz · z . L'émission d'une onde à une fréquence donnée n'affectera que les aimantations résonant à cette fréquence : une onde de fréquence f0 basculera les aimantations situées à z = 0 (figure 8.10A), tandis qu'une onde de de fréquence f0(z1) = f0(0) + γ / (2π) · Gz · z1 basculera les aimantations situées à z = z1 (figure 8.10B).
Principe de la sélection de coupe en IRM.
L'application simultanée d'un gradient de champ Gz et d'une excitation RF permet d'exciter sélectivement un plan situé à z = 0 (A) ou z = z1 (B) selon la fréquence d'excitation utilisée.
La sélection de coupe consiste donc à appliquer un gradient de champ magnétique simultanément à l'émission RF pour exciter une coupe orthogonale à la direction du gradient. Le gradient appliqué est appelé gradient de sélection de coupe.
Lors de l'émission RF, l'application d'un gradient « de sélection » permet de sélectionner une coupe du corps qui sera la seule à émettre du signal.
Principe du codage par la fréquence
Après sélection de la coupe d'intérêt, il reste à déterminer la position des aimantations dans le plan de coupe pour obtenir une image. Une fois le gradient Gz et l'excitation RF éteintes, les aimantations du plan de coupe se retrouvent basculées dans le plan (x,y). Elles entament leur retour à l'équilibre selon la précession amortie décrite précédemment. L'application d'un gradient Gx pendant la précession permet de déterminer la position des aimantations selon x. Cette technique de localisation est appelée codage par la fréquence. Pour en expliquer le principe, prenons l'exemple d'un sujet dont la tête est globalement vide mais contient de l'eau au voisinage de l'oreille droite (à l'abscisse x1) et de l'oreille gauche (à l'abscisse x2). Dans cet exemple, on considère qu'il y a davantage d'eau en x1 qu'en x2 et on se place juste après l'excitation RF de 90° (figure 8.11B). On souhaite déterminer la distribution des aimantations M selon x (figure 8.11C). Pour ce faire, on applique un gradient Gx pendant la précession. En présence du gradient Gx, le champ magnétique s'écrit : B0(x) = B0 + Gx · x (figure 8.11A). La fréquence de Larmor dépend ainsi de la position x : F0(x) = f0(0) + γ / (2π) · Gx · x. Cela est mieux visualisé dans le plan transverse (figure 8.11D, E) : l'aimantation située en x2 précesse à une fréquence supérieure à celle de l'aimantation située en x1. Le signal S détecté en présence de Gx est la somme du signal basse fréquence généré par l'aimantation située en x1 et du signal haute fréquence généré par l'aimantation située en x2. On notera que le signal issu de x1 est plus intense que celui issu de x2 car il y a davantage d'eau en x1 qu'en x2. Après enregistrement du signal global, on lui applique une transformation de Fourier (TF). Cette opération mathématique permet de passer du domaine temporel au domaine fréquentiel. La TF représente les composantes fréquentielles du signal (figure 8.11F) : un signal intense à la fréquence f0(x1) et un signal moins intense à la fréquence f0(x2). On constate que la TF du signal représentée à la figure 8.11F est parfaitement superposable à la distribution des aimantations selon x (figure 8.11C) : la TF du signal détecté en présence du gradient Gx fournit la distribution des aimantations le long de x.
Principe du codage par la fréquence en IRM.
L'application d'un gradient Gx pendant le retour à l'équilibre de l'aimantation crée une équivalence entre la position x et la fréquence de précession f0 (A–E) ; la transformée de Fourier du signal enregistré en présence de Gx fournit la distribution fréquentielle des aimantations (F) qui correspond à leur distribution spatiale selon x (C).
Le codage par la fréquence consiste donc à appliquer un gradient simultanément à l'enregistrement du signal de précession pour localiser l'aimantation le long de la direction du gradient. Le gradient appliqué est appelé gradient de codage par la fréquence ou gradient de lecture.
Le codage par la fréquence fournit ainsi la projection des aimantations selon une direction du plan de coupe. Si on remplace Gx par un gradient Gy, on obtient la projection des aimantations selon y. En combinant les gradients Gx et Gy, on peut obtenir la projection des aimantations selon toute direction du plan (x,y). À partir de ces projections, il est possible de reconstruire l'image de la coupe par les méthodes de reconstruction tomographique classiques de type rétroprojection comme en TDM ou en tomoscintigraphie (voir chapitre 9). En pratique, on n'utilise plus que rarement cette approche en IRM mais un codage « par la phase ». Les principes sous-jacents au codage par la phase dépassent le cadre du DFGSM et ne seront pas détaillés ici, ce qui ne nuit en rien à la compréhension de l'IRM et de son utilisation pour la médecine (les images sont reconstruites par transformée de Fourier bidimensionnelle après double codage du plan de coupe par la fréquence et par la phase).
Pendant l'enregistrement du signal IRM, l'utilisation d'un gradient « de lecture » dans une autre direction permet de localiser le signal selon cette seconde direction. Différentes stratégies sont ensuite utilisables pour localiser le signal selon la troisième direction qui débordent le cadre de cet ouvrage.
Les principales séquences d'IRM
Une séquence d'IRM est une description chronologique des manipulations appliquées à l'aimantation (émission radiofréquence et gradients) et de la détection de l'aimantation (mesure du signal RMN).
Séquence d'écho de gradient
La figure 8.12 représente la séquence élémentaire de l'IRM – équivalente à la séquence d'écho de gradient – qui comprend la sélection de coupe et le codage par la fréquence. Le délai séparant l'excitation RF de la détection est appelé temps d'écho (TE). Cette séquence est couramment utilisée en IRM, mais présente un défaut majeur : les images qu'elle fournit peuvent être artefactées dans les régions où le champ B0 n'est pas parfaitement homogène.
Séquence d'IRM décrivant la chronologie de l'excitation sélective et le codage par la fréquence ; cette séquence comprend les éléments de base de la séquence d'écho de gradient.
Artefacts liés aux inhomogénéités de B0
Inhomogénéités de B0
En l'absence de patient dans l'IRM, le champ magnétique B0 est homogène, c'est-à-dire que l'ensemble du volume d'air situé dans l'IRM est soumis à la même valeur de B0 (1,5 T ou 3 T sur les IRM cliniques). Dès qu'on place un patient dans l'IRM, ce n'est plus vrai : le champ magnétique à l'intérieur des tissus biologiques n'est pas le même que celui dans l'air, car les tissus et l'air possèdent des susceptibilités magnétiques χ différentes. À noter que le champ varie également d'un tissu biologique à l'autre, mais ces variations peuvent être considérées comme négligeables par rapport à la différence avec l'air. Dès lors, dans les zones de transition entre l'air et les tissus, le champ n'est pas homogène. La figure 8.13 illustre ce phénomène pour une tête humaine placée dans une IRM à 3 T : le champ B0 est inhomogène au voisinage des cavités aériques de la tête (sinus de la face, fosses nasales, rochers).
Inhomogénéités du champ magnétique B0 dans un cerveau humain chez un sujet placé dans une IRM à 3 T.
Au voisinage des cavités aériques de la tête, B0 s'éloigne de la valeur de 3 T ; même très faibles, ces inhomogénéités peuvent causer des artefacts importants sur les images.
Source : N. Boulant, CEA/NeuroSpin.
Effet des inhomogénéités sur le signal d'écho de gradient
Pour décrire l'effet des inhomogénéités de B0 sur les images acquises par écho de gradient, il faut considérer un voxel situé au voisinage d'une cavité aérique, par exemple au-dessus des rochers (figure 8.14). Au sein du voxel, le champ magnétique est inhomogène. La figure 8.14A représente deux aimantations de ce voxel : l'une est soumise au champ B0 + δB0 et l'autre au champ B0. Après l'excitation RF, les deux aimantations précessent à des fréquences différentes (la relation de Larmor permet aisément de calculer leur écart fréquentiel δf0 = [γ/(2π)].δB0). Les aimantations se déphasent donc entre elles pendant le TE. L'aimantation Mx′y′ mesurée dans le voxel étant la somme vectorielle de toutes les aimantations, son intensité est d'autant plus atténuée que les aimantations sont déphasées. L'effet de ce déphasage s'ajoute à la relaxation en T2 – à l'origine de la diminution d'intensité des aimantations transversales pendant le TE (figure 8.14A) – si bien que l'intensité de Mx′y′ décroît plus rapidement dans un voxel à B0 inhomogène que dans un voxel à B0 homogène (figure 8.14B). La décroissance accélérée par l'inhomogénéité de B0 est caractérisée par la constante de temps T2* (« T2 étoile »). Le T2* reflète à la fois le T2 et l'inhomogénéité au sein du voxel : le T2* est toujours inférieur au T2.
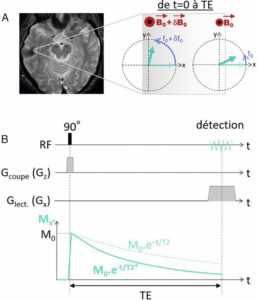
Évolution temporelle de l'aimantation transversale dans un voxel où B0 est inhomogène.
Les aimantations de ce voxel sont soumises à des champ magnétiques de valeurs différentes et précessent donc à des fréquences différentes (A) ; l'aimantation détectée à l'échelle du voxel étant la somme vectorielle de toutes les aimantations, elle est d'autant plus atténuée que les aimantations sont déphasées ; l'effet des déphasages s'ajoute à la relaxation en T2 et accélère la disparition de la composante transversale Mx′ qui décroît en T2* (B).
Comme l'illustre l'IRM cérébrale de la figure 8.14A, les inhomogénéités de B0 entraînent des hyposignaux au voisinage des cavités aériques sur les images d'écho de gradient. Dans certains cas, cela peut être mis à profit pour détecter des lésions qui génèrent des inhomogénéités locales de B0. C'est le cas des hémorragies ou des calcifications, car l'hémoglobine désoxygénée et le calcium perturbent B0 à leur voisinage. On utilisera donc des séquences d'écho de gradient à TE relativement long pour détecter les lésions hémorragiques ou calcifiées. En dehors de ces cas particuliers, on privilégiera une autre séquence qui corrige les déphasages liés aux inhomogénéités de champ : la séquence d'écho de spin.
Séquence d'écho de spin
Principe
L'écho de spin (ES) consiste à insérer au milieu de la séquence IRM une impulsion RF de 180°. La figure 8.15 illustre la manière dont cette impulsion corrige les déphasages liés aux inhomogénéités de champ. Pendant la 1re moitié de la séquence (t = 0 à TE/2), les deux aimantations du voxel se déphasent comme dans la séquence d'écho de gradient. À t = TE/2, on applique une impulsion RF de 180° autour de l'axe x.
Comme illustré figure 8.15A, cette impulsion inverse le déphasage accumulé pendant la 1re moitié de la séquence : elle transforme les avances de phase en retards de phase. L'aimantation qui précesse le plus vite (celle soumise à B0 + δB0) se retrouve donc en retard de phase par rapport à celle qui précesse le plus lentement (celle soumise à B0). Il suffit de laisser les aimantations évoluer librement pendant la durée TE/2 pour qu'elles compensent leur retard de phase et se retrouvent alignées le long de x. Au moment de la détection (à t = TE), les aimantations sont donc parfaitement rephasées : l'effet des inhomogénéités de B0 est annulé. Le signal du voxel détecté n'est affecté que par la décroissance en T2 qui a diminué l'intensité des aimantations pendant le TE.
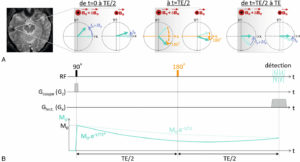
Principe de l'écho de spin.
Pendant la 1re moitié de la séquence, les aimantations du voxel se déphasent sous l'effet de l'inhomogénéité de B0 (A) ; à t = TE/2, on applique une impulsion RF de 180° qui inverse la phase des aimantations. Pendant la 2e moitié de la séquence, les aimantations du voxel se rephasent ; l'aimantation globale du voxel décroît en T2* pendant la 1re moitié de la séquence (B), puis retrouve une valeur correspondant à la décroissance en T2 au moment de la détection.
La figure 8.16 illustre l'intérêt de l'écho de spin (B) par rapport à l'écho de gradient (A) : les hyposignaux artéfactuels à proximité de la mastoïde et de l'ethmoïde de l'écho de gradient sont corrigés sur l'écho de spin.
IRM acquises par écho de gradient (A) et par écho de spin (B) chez le même sujet dans le même plan de coupe.
Les hyposignaux artefactuels de l'écho de gradient (cercles rouges) disparaissent en écho de spin.
Influence du TR et du TE et notion de séquences pondérées en T1 et T2
En jouant sur les valeurs des paramètres TE et TR de la séquence d'écho de spin, on peut contrôler l'influence des temps de relaxation T1 et T2 sur le signal de l'image, c'est-à-dire pondérer l'image en T1 ou en T2. On parle indifféremment de pondération ou de contraste en IRM. Pour comprendre comment le contraste est généré, il faut savoir que l'acquisition d'une image par IRM nécessite en général un grand nombre de répétitions. On peut représenter de nouveau (voir figure 8.7B) la récupération de l'aimantation longitudinale lors d'une 1re répétition (qui conditionne le contraste T1) et la décroissance de l'aimantation transversale lors de la répétition suivante (qui conditionne le contraste T2 – figure 8.17). À partir de la 2e répétition, le signal détecté par une séquence d'écho de spin s'écrit S = S0·[1–exp(–TR/T1)]·exp(–TE/T2).
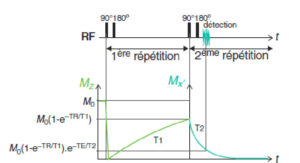
Effet du TR et du TE sur la pondération en T1 et en T2.
On retiendra que, dans une séquence en ES, il faut donc répéter la séquence élémentaire impulsion RF de 90° puis de 180° pour créer un signal dans le plan transversal et le mesurer. Le TR et le TE vont déterminer le contraste de l'image.
Concernant le TR :
- il correspond à l'intervalle séparant deux répétitions (deux impulsions de 90°) ;
- l'aimantation longitudinale récupère pendant ce temps en fonction des caractéristiques de T1 des tissus ;
- le TR conditionne donc le contraste en T1 ;
- si le TR est suffisamment long, tous les tissus peuvent avoir le temps de récupérer leur aimantation longitudinale, même si certains récupèrent plus vite que d'autres, et les tissus seront donc mal séparés.
Donc, plus on allonge le TR, et plus on diminue la pondération (le contraste) en T1 (figure 8.18A) ;
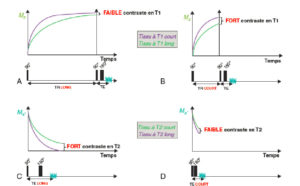
Influence du TR et du TE sur la pondération T1 et T2.
A. Si le TR est long, bien que certains tissus aient des vitesses de relaxation longitudinale (T1) plus rapides que d'autres, tous les tissus auront récupéré et le contraste T1 sera faible. B. Si le TR est court, les tissus ayant des vitesses de relaxation longitudinale (T1) différentes seront bien séparés et le contraste T1 sera important. C. Si le TE est long, les tissus ayant des vitesses de décroissance de l'aimantation transversale (T2) différentes auront le temps d'être bien séparés et le contraste T2 sera important. D. Si le TE est court, bien que certains tissus aient des vitesses de décroissance de l'aimantation transversale (T2) plus rapides que d'autres, ces différences n'auront pas le temps de s'exprimer et le contraste T2 sera faible.
- à l'inverse, pour un TR court, on pourra séparer les tissus ayant une récupération plus rapide (un T1 plus court) qui seront plus intenses que ceux ayant une récupération plus lente. Donc, plus on raccourcit le TR, plus la pondération (le contraste) en T1 est forte (figure 8.18B).
Concernant le TE :
- il correspond à l'intervalle entre la bascule dans le plan transversal et la mesure du signal au moment de l'écho (l'impulsion de 180° est appliqué au temps t = TE/2) ;
- l'aimantation transversale décroît pendant ce temps en fonction des caractéristiques de T2 des tissus ;
- le TE conditionne donc le contraste en T2 ;
- plus le TE est long, plus les différences de vitesse de décroissance de l'aimantation transversale apparaîtront sous la forme de différence de signal. Donc, plus on allonge le TE, plus on augmente la pondération (le contraste) en T2 (figure 8.18C) ;
- à l'inverse, si le TE est trop court, les différences de vitesse de décroissance n'auront pas le temps de s'exprimer et les tissus seront donc mal séparés. Donc, plus on raccourcit le TE, plus on diminue la pondération (le contraste) en T2 (figure 8.18D).
Ainsi, dans une séquence pondérée en T1 :
- le TR est court pour maximiser le contraste en T1 (différences liées à la relaxation longitudinale) ;
- le TE est court pour minimiser le contraste en T2 (différences liées à la décroissance transversale) ;
- les tissus avec les T1 les plus courts donneront plus de signal.
Dans une séquence pondérée en T2 :
- le TR est long pour minimiser le contraste en T1 ;
- le TE est long pour maximiser le contraste en T2 ;
- les tissus avec les T2 les plus courts donneront le moins de signal.
Pour illustrer ces notions, on peut prendre l'exemple du contraste au sein du système nerveux central. Les propriétés des tissus cérébraux sont telles que la récupération de l'aimantation longitudinale est plus rapide au sein de la substance blanche (SB) qu'au sein de la substance grise (SG), qui est elle-même plus rapide qu'au sein du liquide cérébrospinal (LCS). Autrement dit, T1SB < T1SG < T1LCS (en pratique, au bout d'un temps T1, 1 – 1/e = 63% de la récupération longitudinale a été récupérée). Un tissu dont l'aimantation longitudinale récupère vite a généralement une aimantation transversale qui décroît vite. Ainsi, la décroissance de l'aimantation transversale est plus rapide au sein de la SB qu'au sein de la SG, qui est elle-même plus rapide qu'au sein du LCS. Autrement dit, T2SB < T2SG < T2LCS (en pratique, au bout d'un temps T2, l'aimantation transversale a décru à 1/e, soit 37 % de sa valeur initiale).
Ainsi, en séquence pondérée T1 (TR court et TE court ; figure 8.19A), le contraste est dit anatomique :
- la SB est blanche, la SG est grise, le LCS est noir (hypo-intense).
En séquence pondérée T2 (TR long, TE long ; figure 8.19B), le contraste est inversé :
- la SB est la plus noire, la SG a un signal intermédiaire, le LCS est blanc (hyperintense).
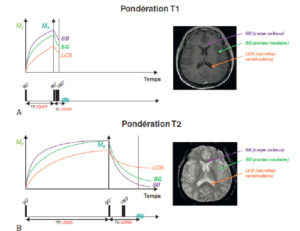
Influence des séquences pondérées T1 et T2 sur le contraste au sein du système nerveux central.
A. En séquence T1 (TR court pour pondérer T1 et TE court pour limiter la pondération T2), le contraste est anatomique : la substance blanche est blanche, la substance grise est grise et le LCS est hypo-intense. B. En séquence T2 (TR long pour limiter la pondération T1 et TE long pour pondérer T2), le contraste est inversé : la substance blanche est plus hypo-intense que la substance grise et le LCS est hyperintense.
La majorité des phénomènes pathologiques s'accompagnent d'une augmentation du contenu en eau, ce qui augmente les temps de relaxation T1 et T2 et ce qui apparaît donc en hyposignal sur les séquences pondérées T1 et en hypersignal sur les séquences pondérées T2 (figure 8.20A). Certaines modifications pathologiques impactent différemment les temps de relaxation. Par exemple, un saignement au bout de quelques jours (stade de méthémoglobine) va raccourcir le T1 et le T2, ce qui apparaît donc en hypersignal sur les séquences pondérées T1 et en hyposignal sur les séquences pondérées T2 (figure 8.20B). L'hyposignal sera encore plus marqué sur les séquences T2*, dans lesquelles on ne corrige pas les inhomogénéités de B0 comme expliqué précédemment.
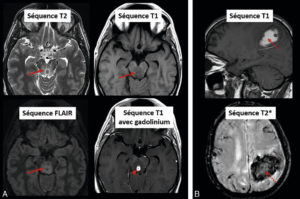
Exemples de modifications du signal induites par des conditions pathologiques au sein de l'encéphale.
A. Abcès mésencéphalique. L'abcès, visualisé après injection de gadolinium (tête de flèche), est entouré d'œdème apparaissant en hypersignal T2 et FLAIR et en hyposignal T1 (flèches) car cette augmentation du contenu en eau allonge les temps de relaxation T1 (relaxation plus lente, d'où hyposignal) et T2 (décroissance plus lente, d'où hypersignal). B. Hématome subaigu. La présence de sang au stade de méthémoglobine (flèche pointillée) raccourcit les temps de relaxation T1 (récupération plus rapide, d'où hypersignal) et T2 (décroissance plus rapide, d'où hyposignal).
Module d'inversion récupération (FLAIR et STIR)
Avant d'acquérir l'image avec une séquence d'écho de spin ou d'écho de gradient, il est possible de « préparer » l'aimantation pour modifier le contraste. Parmi les techniques utilisées pour une telle préparation, on compte notamment l'« inversion-récupération ». En faisant précéder l'impulsion initiale de 90° d'une impulsion de 180°, on obtient une séquence de type inversion-récupération. L'impulsion de 180° va inverser l'aimantation longitudinale qui passe alors de +Mz0 à –Mz0. Initialement, cette inversion ne s'accompagne pas d'aimantation transversale (Mxy = 0). À l'arrêt de l'impulsion de 180°, il s'ensuit une récupération (d'où le nom inversion-récupération) de l'aimantation longitudinale par retour dans le sens du champ magnétique principal de façon plus ou moins rapide en fonction du T1 des tissus. Au bout d'un temps appelé temps d'inversion ou TI (équivalent du TR dans une séquence ES classique), on bascule dans le plan transverse (impulsion de 90°) pour faire la mesure en écho de spin ou en écho de gradient.
Les séquences d'inversion-récupération offrent plusieurs avantages. Tout d'abord, le contraste T1 peut être amélioré par rapport à une séquence ES standard, car la relaxation longitudinale qui a lieu pendant le TI se fait sur une « une plus grande distance » (de –Mz0 à +Mz0), ce qui majore la possibilité de séparer des tissus ayant des T1 différents par rapport à une récupération qui va de 0 à +Mz0 dans une séquence ES classique. Il est donc possible d'utiliser ce schéma (en ajustant le TI et le TE) pour obtenir des images très anatomiques avec un très fort contraste T1. Pour l'exploration du cerveau, on utilise notamment ces séquences T1–IR (T1 inversion récupération) pour explorer de façon fine le ruban cortical dans un bilan d'épilepsie.
Par ailleurs, dans une séquence en inversion récupération, le signal de tous les tissus passe par 0 lors de la récupération de l'aimantation longitudinale (pour TI = T1 × ln2 ≅ 0,69 T1 du tissu considéré). Donc, si le TI est centré sur le moment où le signal d'un tissu croise le 0 lors de la récupération, alors le signal de ce tissu sera annulé.
L'eau des compartiments liquides (comme le LCS) a une aimantation longitudinale qui relaxe lentement (T1 long ; voir signal du LCS dans la figure 8.19). En utilisant un TI long (= 0,69 × T1eau ≈ 2500 ms à 1,5 T), on peut annuler le signal du LCS. Il s'agit de la séquence FLAIR (fluid-attenuated inversion recovery). Avec un TE suffisamment long, on exprime un contraste T2 dans le FLAIR au sein duquel le contraste entre la SB et la SG est donc identique à celui d'un T2, mais avec le LCS noir au lieu d'être hyperintense. Les lésions cérébrales (qui s'accompagnent très souvent d'un allongement du T2 par excès d'eau ; voir plus haut « Influence du TR et du TE et notion de séquences pondérées en T1 et T2 ») restent hyperintenses en séquence FLAIR comme sur un T2 standard (car les lésions ne correspondent pas à de l'eau libre – figure 8.20A), mais l'annulation du LCS facilite leur délimitation, par exemple pour les lésions inflammatoires de sclérose en plaques de topographie périventriculaire (figure 8.21A).
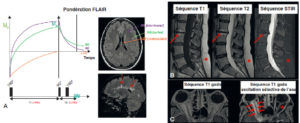
Illustration des séquences FLAIR, STIR et autre méthode d'annulation de la graisse.
A. En séquence FLAIR, le TI est long, centré sur le moment où le signal de l'eau croise le zéro. Du fait d'un TE long, il s'agit d'une séquence pondérée T2 mais sur laquelle le LCS est annulé, ce qui facilite la distinction entre des lésions hyperintenses parenchymateuses périventriculaires et le LCS comme dans la sclérose en plaques (flèches pointillées). B. En séquence STIR, le TI est court, centré sur le moment où le signal de la graisse croise le zéro. Le signal de la graisse sous-cutanée (astérisques, hyperintense en T1 et T2) est annulé, de même que la dégénérescence graisseuse des plateaux vertébraux de L2-L3 (flèches). C. Sur une séquence T1 après injection de chélate de gadolinium centrée sur les orbites, on distingue mal une éventuelle prise de contraste (hyperintense) du signal graisseux de l'orbite. En saturant le signal de la graisse (astérisque, annulation de la graisse orbitaire), on démasque bien une prise de contraste importante de la gaine du nerf optique (flèches). Ici, la méthode STIR ne peut pas être utilisée car le T1 de la graisse et le T1 de cette infiltration rehaussée sont proches. Une méthode d'excitation sélective de l'eau a été utilisée pour annuler le signal de la graisse.
La graisse a une aimantation longitudinale qui relaxe rapidement (T1 court). En utilisant un TI court (= 0,69 × T1graisse ≈ 150 ms à 1,5 T), on peut annuler le signal de la graisse. Il s'agit de la séquence STIR (short-TI inversion recovery). On utilise fréquemment cette séquence pour annuler le signal graisseux de la moelle osseuse au niveau rachidien (figure 8.21B), ou encore le contenu graisseux de l'orbite pour mieux apprécier le nerf optique et les muscles oculomoteurs. Un des inconvénients de la séquence STIR est l'annulation possible des tissus dont le T1 est proche de celui de la graisse. Par exemple, lorsqu'on utilise un agent de contraste à base de chélate de gadolinium (voir plus bas), le T1 des tissus au sein desquels le gadolinium s'accumule va diminuer (d'où l'hypersignal T1 post-gadolinium des lésions rehaussées). Il ne faut donc pas utiliser une séquence STIR après injection de gadolinium au risque de masquer les lésions rehaussées. Il existe d'autres méthodes de saturation du signal de la graisse (saturation spectrale, excitation sélective de l'eau) qu'on utilisera après injection de gadolinium si on recherche un rehaussement dans un environnement graisseux (figure 8.21C).
Autres séquences
Les acquisitions en écho de spin et écho de gradient décrites ci-dessus peuvent servir de briques élémentaires pour de nombreuses autres séquences sur lesquelles il est ajouté d'autres « modules », de façon à être sensible à un substratum biologique plus ou moins spécifiquement. En particulier, l'IRM peut être sensible aux mouvements de l'eau à différentes échelles (du microscopique au macroscopique), ce qui est exploité dans les séquences de diffusion, de perfusion et d'angiographie.
Séquence de diffusion
Les séquences précédemment décrites sont sensibles au contenu en eau. Les séquences pondérées en diffusion explorent un autre paramètre qui est l'importance des mouvements microscopiques des molécules d'eau. Il s'agit de mouvements browniens liés à l'agitation thermique (l'eau bouge dans les cellules et entre les cellules).
Pour pondérer une séquence en diffusion, on ajoute deux impulsions de gradient de diffusion de part et d'autre de l'impulsion de 180° d'une séquence T2 ES (figure 8.22A). Cela signifie que, sur la base d'une imagerie T2, on ajoute un module qui est sensible à la diffusion microscopique des molécules d'eau. En pratique, ces impulsions de gradient de diffusion induisent une chute de signal d'autant plus importante que l'eau bouge plus librement. Plus en détail, la première impulsion induit une chute de signal (déphasage). Si les molécules d'eau sont immobiles, la seconde impulsion (parfaitement symétrique par rapport à la première) compense la perte de signal initiale (rephasage) et le signal va donc être intense sur la carte de diffusion. En revanche, si les molécules d'eau sont mobiles, la seconde impulsion ne compense pas parfaitement la perte de signal induite par la première (rephasage d'autant plus incomplet que les mouvements d'eau sont importants) et le signal chute sur la carte de diffusion (figure 8.22A, B).
Principe de la séquence de diffusion.
A. Deux impulsions de gradient de diffusion sont appliquées de façon symétrique par rapport à l'impulsion de 180° d'une séquence T2. Ces impulsions induisent une chute de signal sur l'image résultante d'autant plus importante que l'eau est plus mobile. En bleu : parenchyme sain ; eau à mobilité normale = chute de signal. En orange : infarctus cérébral ; eau à mobilité restreinte (œdème intracellulaire) = peu de chute de signal. Noter que l'infarctus cérébral n'est pas visible sur la séquence T2 sans les impulsions de gradient de diffusion car la quantité d'eau n'est pas augmentée, mais le déficit énergétique induit par l'infarctus entraîne un transfert d'eau du milieu interstitiel vers le milieu intracellulaire où sa mobilité est plus restreinte. B. Le coefficient apparent de diffusion (ADC) quantifie la chute de signal en diffusion de manière absolue. En bleu : parenchyme sain ; chute de signal = ADC élevé. En orange : infarctus cérébral ; chute faible de signal = ADC bas.
On retient donc que les régions à diffusion restreinte apparaissent généralement en hypersignal sur la carte de diffusion (peu de chute de signal) et que les régions à diffusion accélérée apparaissent généralement en hyposignal sur la carte de diffusion (chute de signal). Pour quantifier l'information de diffusion, on utilise le coefficient apparent de diffusion (ou ADC pour apparent diffusion coefficient en anglais).
L'ADC quantifie directement la chute de signal induite par les gradients de diffusion. En pratique, la force des impulsions de gradient de diffusion (et donc l'importance de la pondération en diffusion) dépend de leur amplitude, de leur durée d'application et de leur éloignement dans le temps, ce qu'on quantifie de façon globale par le facteur « b ». Le facteur b s'exprime en s/mm2. En pratique, on collecte une première image sans gradient de diffusion (b = 0 s/mm2 ; ce qui est équivalent à un T2) et une seconde image avec l'utilisation du gradient (typiquement, b = 1000 s/mm2 en routine clinique). La chute de signal entre les images à b0 et les images à b1000 est d'autant plus grande que la force des gradients et l'ADC sont élevés : ln(I1000/I0) = –b × ADC). Autrement dit, sur la courbe de la chute de signal après application des gradients (en fonction de b), l'ADC représente la pente des droites (figure 8.22B).
À retenir sur les régions à diffusion restreinte
Les régions à diffusion restreinte :
- induisent une faible chute de signal après application des gradients de diffusion ;
- apparaissent en hypersignal sur l'image pondérée en diffusion ;
- présentent des valeurs d'ADC basses (pente faible traduisant une faible chute de signal) ;
- peuvent traduire, selon le contexte :
- un œdème intracellulaire (aussi appelé cytotoxique) comme à la phase aiguë de l'ischémie cérébrale (ballonisation cellulaire entraînant des obstacles à la diffusion de l'eau),
- une hypercellularité, par exemple au sein d'un lymphome (encombrement membranaire par excès de cellules gênant la diffusion de l'eau),
- un contenu épais, par exemple dans le cadre d'un abcès à pyogènes (contenu visqueux diminuant la diffusion de l'eau).
À retenir sur les régions à diffusion accélérée
Les régions à diffusion accélérée :
- induisent une forte chute de signal après application des gradients de diffusion ;
- apparaissent en hyposignal sur l'image pondérée en diffusion ;
- présentent des valeurs d'ADC hautes (pente élevée du fait d'une chute de signal importante) ;
- peuvent traduire, selon le contexte :
- un œdème extracellulaire (aussi appelé vasogénique), comme autour d'une tumeur cérébrale (excès d'eau interstitielle par ouverture de la barrière hémato-encéphalique refoulant les obstacles cellulaires à la diffusion de l'eau),
- une destruction tissulaire, par exemple au sein d'une lésion démyélinisée de sclérose en plaques (perte membranaire facilitant la diffusion de l'eau),
- un contenu nécrotique, par exemple au centre d'une tumeur (contenu « pseudo-liquidien » facilitant la diffusion de l'eau).
Concernant l'exploration cérébrale, on note aussi que, dans chaque voxel de l'image, ces mouvements microscopiques de l'eau ne sont généralement pas identiques dans toutes les directions de l'espace, mais se font dans une direction préférentielle. On parle de diffusion anisotrope, par opposition à la diffusion isotrope. En fait, l'eau diffuse plus facilement le long des faisceaux de substance blanche (SB) que perpendiculairement à ces faisceaux (figure 8.23A). Ainsi, en collectant l'information de diffusion dans plusieurs directions (au minimum 6 directions, le plus souvent 64 directions ou plus), on peut identifier, voxel à voxel, la direction préférentielle des mouvements microscopiques de l'eau qui reflète indirectement la direction des fibres de SB et qui permet de reconstruire virtuellement le trajet des faisceaux de SB (principe de la tractographie ; figure 8.23B).
Phénomène d'anisotropie en diffusion.
A. L'eau diffuse préférentiellement le long des fibres de substance blanche et peu perpendiculairement aux fibres. Ainsi, quand on étudie les mouvements d'eau dans la direction haut/bas, la diffusion est restreinte dans le corps calleux (bleu) car on est perpendiculaire à ce dernier, mais accélérée le long des faisceaux pyramidaux (rouge) car on est dans le sens des fibres. À l'inverse, quand on étudie les mouvements d'eau en droite/gauche, la diffusion est accélérée dans le corps calleux et restreinte le long des faisceaux pyramidaux. Quand on étudie les mouvements d'eau en antéropostérieur, la diffusion est restreinte dans le corps calleux et les faisceaux pyramidaux. La moyenne géométrique de ces trois directions annule ces effets d'anisotropie et seul l'infarctus du thalamus (astérisque) qui est en restriction quelle que soit la direction reste en hypersignal. B. En multipliant les directions des gradients de diffusion, on peut identifier la direction des fibres et les reconstruire : ici, reconstruction du faisceau arqué qui est projeté sur une imagerie T1 pour étudier ses rapports avec une tumeur cérébrale (pointillés rouges).
Séquences de perfusion
L'imagerie de perfusion permet d'estimer le volume sanguin et les paramètres de microcirculation dans les tissus. Il existe de nombreuses méthodes pour mesurer la perfusion en IRM. Nous prendrons ici l'exemple de l'étude de la perfusion cérébrale en séquence T2 après injection de gadolinium.
On utilise pour cela la propriété du gadolinium de raccourcir les temps de relaxation T2 lorsqu'il est concentré au sein de la microcirculation, car il se comporte alors comme un agent paramagnétique accélérant le déphasage (= chute de signal) des vecteurs d'aimantation dans les voxels qu'il traverse et au-delà (figure 8.24A).
Principe de la séquence de perfusion.
A. Six voxels sont schématisés dont certains sont traversés par un vaisseau (proportions non respectées). Les vecteurs d'aimantation se déphasent lors de l'arrivée du gadolinium (chute du signal en T2 au sein des vaisseaux). Le déphasage induit par le gadolinium se propage aux voxels voisins, même si le gadolinium reste intravasculaire, ce qui accentue la chute du signal en T2. B. Courbe de variation de signal en fonction du temps de passage d'un bolus de gadolinium. Sont représentés, le temps au pic (TAP), le temps de transit moyen (TTM) et l'aire sous la courbe (bleue) qui représente le volume sanguin cérébral (VSC). C. Cartes paramétriques sur lesquelles les valeurs quantitatives issues de l'analyse des courbes de premier passage sont représentées voxel par voxel sur une échelle couleur, DSC étant le débit sanguin cérébral.
En pratique, on collecte une séquence T2 couvrant tout l'encéphale (le plus souvent T2 écho de gradient) de façon très rapide (1 à 2 secondes) et on répète cette séquence 45 à 60 fois durant l'injection d'un bolus de gadolinium. Ainsi, dans chaque point de l'image (x,y,z), on a 45 à 60 valeurs correspondant aux répétitions des acquisitions lors du passage de produit de contraste. Il s'agit d'une imagerie dite « au premier passage ». Sur les premiers volumes, le signal est stable car le gadolinium est encore en périphérie (veines périphériques, cœur, poumons), puis le signal chute quand le gadolinium arrive dans la circulation artérielle cérébrale et le signal remonte une fois que le gadolinium quitte la circulation cérébrale (figure 8.24B).
À partir de ces courbes de variation du signal lors du passage du gadolinium qui sont obtenues dans chaque voxel de l'image, il est possible de créer des cartes paramétriques dans lesquelles les valeurs d'un paramètre calculé au sein de ces courbes sont représentées au sein de l'image sur une échelle couleur (figure 8.24B, C). On calcule ainsi des cartes de temps (temps entre l'injection et la chute maximale de signal = temps au pic ; ou largeur à mi-hauteur = temps de transit moyen). On calcule aussi dans chaque point de l'image l'aire sous la courbe qui est d'autant plus importante que plus de gadolinium est arrivé et qui représente donc le volume sanguin cérébral. Ayant le volume sanguin cérébral et le temps de transit, il est possible de calculer des cartes de débit sanguin cérébral via la formule : débit = volume/temps (figure 8.24C).
Ces cartes de perfusion cérébrale peuvent être utilisées dans l'exploration d'un infarctus cérébral pour identifier l'étendue de la région hypoperfusée (allongement des paramètres de temps) qui peut être plus large que la région déjà infarcie de façon irréversible sur la séquence de diffusion (c'est le concept de la pénombre ischémique utilisé pour sélectionner les patients éligibles à un traitement de revascularisation dans des délais prolongés). Ces cartes de perfusion peuvent aussi être utilisées dans l'exploration d'une tumeur cérébrale pour identifier les régions hypervascularisées (augmentation du volume sanguin cérébral du fait d'une néo-angiogenèse liée au caractère agressif d'une tumeur gliale, par exemple).
Il existe d'autres méthodes de perfusion qui couplent l'injection de gadolinium avec la répétition de séquences T1 pour explorer d'autres organes. On peut aussi faire de la perfusion sans injecter de produit de contraste, mais en générant du signal au sein des protons du sang circulant qui est alors utilisé comme traceur endogène (technique dite par marquage de spins artériels).
Séquences d'angio-IRM
Il existe de nombreuses méthodes pour explorer les vaisseaux en IRM. Une des méthodes les plus utilisées est l'angio-IRM après injection de gadolinium. On utilise ici la propriété du gadolinium de réduire le T1 des tissus dans lesquels il est présent et donc de réduire le T1 du sang lors de son transit vasculaire. Ainsi, lorsque l'injection du gadolinium en bolus (utilisation d'un injecteur automatique) est couplée avec une séquence T1 rapide, acquise lorsque le gadolinium transite dans le système artériel, alors les artères riches en gadolinium apparaissent en hypersignal. Cette méthode est très efficace grâce au développement de séquences fortement pondérées T1 (TR et TE très courts), qui peuvent être acquises très rapidement et grâce à une bonne synchronisation de l'acquisition et du passage artériel du bolus. La réalisation d'une séquence avant l'arrivée du contraste est parfois utilisée pour servir de masque pour une éventuelle soustraction avec les séquences injectées. Les acquisitions sont aussi parfois répétées de façon dynamique après injection de façon à obtenir plusieurs phases (temps artériel, temps capillaire, temps veineux) pour l'exploration de certaines affections dans lesquelles le transit d'une phase à l'autre est perturbé (par exemple malformation artérioveineuse qui s'accompagne d'une opacification veineuse dès la phase artérielle). Pour visualiser ces imageries, on utilise généralement un post-traitement appelé MIP (maximal intensity projection) qui consiste à projeter dans chaque coupe uniquement les voxels les plus intenses (correspondant aux voxels vasculaires riches en gadolinium). En multipliant ces projections avec des angles différents, on obtient plusieurs images vasculaires 2D qu'on peut faire tourner et visualiser sous toutes les incidences comme une véritable image 3D (figure 8.25A).
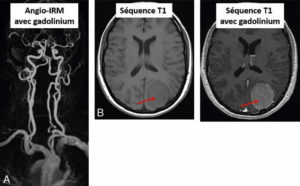
Exemples d'utilisation de chélates de gadolinium.
A. Angio-IRM des troncs supra-aortiques et des artères du cercle artériel du cerveau (polygone de Willis) après injection de gadolinium. B. Méningiome pariétal gauche (flèche) se rehaussant fortement après injection de gadolinium.
Il existe aussi plusieurs alternatives pour explorer les vaisseaux sans injecter de gadolinium en utilisant des propriétés des vecteurs d'aimantation circulants de pouvoir générer du signal sous certaines conditions (séquence en temps de vol dite TOF pour time of flight, séquence en contraste de phase). Ces méthodes ont l'avantage de ne pas nécessiter d'injection de produit de contraste, mais ont d'autres contraintes.
Agents de contraste en IRM
Les agents de contraste en IRM sont des agents exogènes (médicaments) injectés le plus souvent par voie veineuse pour augmenter le contraste entre un tissu pathologique et un tissu sain ou entre deux structures anatomiques (vaisseaux et parenchyme). Les agents de contraste les plus utilisés en IRM sont les chélates de gadolinium (agent paramagnétique à effet T1). Dans des indications particulières, on utilise parfois des nanoparticules de fer (agent super-paramagnétique à effet T2).
Propriétés physicochimiques et pharmacocinétiques des chélates de gadolinium
Le gadolinium (Gd3+) est un ion métallique de la famille des lanthanides qui possède 7 électrons célibataires sur sa couche périphérique. L'ion gadolinium libre est toxique et il est toujours utilisé sous forme chélatée soit au sein d'un macrocycle (chélate de gadolinium macrocyclique), soit au sein d'une chaîne linéaire (chélate de gadolinium linéaire). Les électrons célibataires accélèrent la relaxation de l'aimantation des tissus au sein desquels le gadolinium est présent. En effet, le retour des vecteurs d'aimantation dans le sens du champ magnétique principal après l'impulsion RF (voir plus haut) nécessite une restitution d'énergie (issue de l'impulsion RF) vers l'environnement (relaxation spin-réseau) qui est facilitée par ces électrons célibataires. Ainsi, le gadolinium est surtout utilisé comme agent T1 puisqu'il entraîne un hypersignal T1 des tissus au sein desquels il est présent. Lorsque le gadolinium est concentré, le champ magnétique local créé autour de lui (effet paramagnétique) accélère la relaxation transversale (chute du signal en T2 et T2* ; voir imagerie de perfusion de la figure 8.24A), mais cet effet est généralement moindre que l'effet T1.
D'un point de vue pharmacocinétique, les chélates de gadolinium se comportent de façon proche des produits de contraste iodés utilisés en scanner. Après injection intraveineuse, ils ont une biodistribution vasculaire puis rapidement interstitielle. Ils sont éliminés majoritairement par voie urinaire (certains ont une élimination biliaire surajoutée, ce qui est utilisé pour explorer certaines affections hépatobiliaires). Leur demi-vie est de l'ordre de 90 minutes chez les patients à fonction rénale normale.
Tolérance et effets secondaires des chélates de gadolinium
La tolérance de ces agents diagnostiques est très bonne.
Il existe des réactions d'hypersensibilité allergique ou non allergique qui sont peu fréquentes et souvent d'intensité légère à modérée et de nature transitoire (nausées, vomissements, prurit, manifestations respiratoires, etc.). De façon très rare, il a été décrit des états de choc anaphylactique.
Des cas de fibrose systémique néphrogénique (atteinte fibrosante cutanée avec une extension viscérale) ont été décrits avec des chélates linéaires, mais ne sont plus rencontrés maintenant que ces produits à risque ne sont plus utilisés chez les insuffisants rénaux sévères (débit de filtration glomérulaire [DFG] < 30 mL/min/1,73 m2). Les chélates de gadolinium ne sont pas néphrotoxiques, contrairement aux produits de contraste iodés utilisés en TDM. Compte tenu de l'absence de néphrotoxicité et du risque quasi nul de fibrose néphrogénique systémique avec les produits macrocycliques qui sont actuellement autorisés, il est possible d'injecter du gadolinium chez le patient insuffisant rénal (en se limitant uniquement à une dose toutes les 7 jours si le DFG est < 30 mL/min/1,73 m2).
La rétention intracérébrale (notamment au sein des noyaux dentelés) d'une faible partie du gadolinium injecté a été décrite, notamment lorsque les injections sont répétées (par exemple pour la surveillance d'une maladie chronique). Ces phénomènes de passage et de rétention cérébrale sont plus marqués avec les chélates linéaires. Il n'y a pas, à ce jour, de niveau de preuve suffisant pour associer ces phénomènes de rétention à des effets secondaires cliniques. Néanmoins, les chélates macrocycliques sont maintenant privilégiés et les injections répétées doivent être bien justifiées par un bénéfice clinique. Certaines maladies chroniques sont maintenant surveillées, autant que possible, sans injection de chélate de gadolinium pour limiter ces phénomènes.
Il existe peu de données cliniques sur l'utilisation des produits de contraste gadolinés pendant la grossesse. Ces produits n'ont pas d'effet tératogène ou mutagène. Néanmoins, par mesure de précaution, les produits de contraste à base de gadolinium ne doivent être injectés pendant la grossesse qu'en cas de stricte nécessité, en utilisant uniquement les plus stables et à la plus petite dose nécessaire pour le diagnostic. Le passage dans le lait maternel est minime et l'allaitement peut être poursuivi sans précaution si le produit a été injecté chez une femme allaitante.
Indications des produits de contraste en IRM
Utilisation des chélates de gadolinium
Les chélates de gadolinium sont très largement utilisés en couplage avec des acquisitions T1 pour augmenter le contraste entre des tissus normaux et pathologiques (processus tumoraux, inflammatoires, infectieux) au sein desquels le gadolinium s'accumulera (voir figures 8.20A et 8.25B).
L'injection est aussi utilisée, en couplage avec une acquisition T1 au temps artériel (et/ou veineux), pour collecter des images d'angio-IRM (voir figure 8.25A).
On exploite l'effet T2 (et T2*) en imagerie de perfusion au premier passage (voir plus haut) où l'injection en embole compacte est couplée à des acquisitions dynamiques en T2 (T2*) pour suivre le transit de l'embole qui entraîne une chute de signal (voir figure 8.24).
Autres agents de contraste IRM
Il existe d'autres agents de contraste à base d'oxyde de fer super-paramagnétique qui font essentiellement chuter le signal en T2 au sein des tissus où ils s'accumulent. En pratique clinique, ces agents sont utilisés pour l'exploration du foie car ils sont captés par le système réticulo-endothélial et induisent donc une chute de signal T2 au sein du foie (et de la rate) sain ; le tissu « extra-hépatique » (par exemple une métastase) apparaissant alors en contraste négatif (pas de chute de signal).
Réalisation pratique d'un examen IRM
Contre-indications
Avant tout examen IRM, il est impératif de s'assurer de l'absence de contre-indication. Les contre-indications sont en rapport avec la présence de matériel métallique qui peut entraîner un échauffement des tissus, un dérèglement du dispositif électronique ou une migration du matériel métallique avec risque de lésion des tissus de voisinage.
Les contre-indications à la pratique d'une IRM sont donc les suivantes :
- patient porteur d'un pacemaker non compatible IRM ;
- patient porteur d'un défibrillateur cardiaque non compatible IRM ;
- patient porteur d'une valve cardiaque mécanique ancienne non compatible IRM ;
- patient porteur d'une pompe implantée (pompe à insuline, pompe à baclofène, etc.) ;
- patients ayant des éclats métalliques intra-orbitaires (origine accidentelle, meulage, travail du métal, bricolage, etc.) ;
- patient porteur de tout éclat métallique dans le corps d'origine accidentelle (limaille, balle, éclats d'obus, etc.).
D'une manière générale, tous les implants doivent être vérifiés avant la réalisation de l'examen (valves et dérivations ventriculaires, neurostimulateur, clamps artériels carotidiens, clips anévrismes, coils, stents, filtres, prothèses et valves cardiaques, implants oculaires, implants cochléaires, implants péniens, etc.). Les dispositifs récents peuvent généralement permettre la réalisation de l'examen IRM (y compris les pacemakers récents), mais en respectant des précautions spécifiques au matériel concerné. Ces précautions concernent la valeur maximale du champ magnétique utilisable (1,5 T, 3 T), la puissance maximale des gradients utilisable, le taux d'absorption spécifique maximal (dépôt d'énergie au tissu du fait des impulsions RF).
Ainsi, chez un patient qui présente un dispositif implanté, la compatibilité doit être vérifiée par l'équipe d'imagerie en utilisant les données des constructeurs afin de s'assurer que le matériel est : 1) IRM compatible (= examen possible), 2) IRM compatible sous condition (= examen possible, mais en respectant des conditions de réalisation qui vont concerner le type de machine utilisable, le type de séquence utilisable, la durée maximale de l'examen, etc.), ou 3) IRM non compatible (= examen impossible, nécessitant d'utiliser une autre modalité, comme le scanner).
La présence de matériel orthopédique (broches, vis, prothèses orthopédiques), à l'exception des fixateurs externes, n'est pas une contre-indication, mais pourra générer un artefact métallique si le matériel est dans le champ d'exploration. Il s'agit du même problème pour le matériel d'orthodontie. On peut aussi être amené à attendre quelques semaines après réalisation d'un tatouage car certaines encres contiennent des pigments ferromagnétiques.
Les patients claustrophobes peuvent avoir des difficultés à supporter l'examen du fait de l'étroitesse du tunnel de l'aimant. Une prémédication ou l'utilisation de l'hypnose peuvent permettre de réaliser l'examen chez ce type de patients. Dans des cas particuliers (pédiatrie, claustrophobie sévère, mouvements anormaux incontrôlés, patient très agité ou non coopérant) où l'examen est indispensable, on peut être amené à réaliser l'IRM sous sédation ou sous anesthésie générale (via du matériel spécifique IRM compatible).
Le patient sera interrogé à la recherche d'antécédent d'allergie au chélate de gadolinium si une injection est nécessaire.
Les patientes en âge de procréer seront interrogées sur une éventuelle grossesse. On peut pratiquer une IRM pendant la grossesse, mais uniquement si l'examen est indispensable, sans attendre l'accouchement et généralement sans utilisation de produit de contraste (sauf nécessité diagnostique absolue, voir plus haut).
Déroulement pratique de l'examen
La demande d'un examen IRM doit faire l'objet d'une demande écrite.
Le patient est accueilli par un manipulateur en électroradiologie. Tous les objets métalliques (bijoux, lunettes, clés) ou susceptibles d'être sensibles aux lignes de champs (téléphone portable, cartes de crédit) sont retirés en dehors de la salle d'examen. En effet, même si l'acquisition n'a pas encore commencé, le champ magnétique principal (B0) est permanent et il existe un risque de projection de tous les matériaux ferromagnétiques (brancards, pieds de perfusion, lits). Le patient est ensuite allongé sur la table et le manipulateur met en place des protections auditives (casque, bouchons d'oreille) car l'examen est bruyant. Le manipulateur met aussi en place les antennes permettant d'émettre les impulsions RF et de recueillir le signal (antennes émettrices et réceptrices) en fonction de la région anatomique étudiée (antenne tête pour le crâne, antenne de surface pour l'abdomen par exemple). L'acquisition en IRM est plus longue qu'en TDM, de l'ordre de 10 à 45 minutes pour chaque région anatomique étudiée. Pendant toute la durée de l'examen, le patient ne doit pas bouger et peut communiquer avec le manipulateur présent dans la salle de commande via un microphone. Le patient pourra être perfusé par le manipulateur si une injection de produit de contraste est nécessaire.
Les séquences utilisées sont prescrites par le médecin radiologue selon la question clinique qui est posée. En fonction des constatations sur les premières séquences, le radiologue peut ajuster le choix des séquences à réaliser (soit en raccourcissant le nombre de séquences si la réponse clinique est rapidement obtenue, soit à l'inverse en ajoutant d'autres acquisitions pour aider à mieux comprendre les constatations faites sur les premières images). Le radiologue analyse l'ensemble des séquences sur une console d'imagerie dédiée et il intègre ses observations avec le contexte clinique et biologique pour faire une synthèse dans un compte rendu qui est rendu au médecin demandeur et expliqué au patient. Le compte rendu pourra soit affirmer un diagnostic, soit proposer plusieurs hypothèses qui nécessiteront d'autres examens pour conclure sur un diagnostic unique.
Essentiel à retenir
- L'IRM consiste à détecter l'aimantation des noyaux d'hydrogène et à la localiser pour reconstruire des images. Pour ce faire, on utilise le champ magnétique intense de la machine IRM appelé B0 (aimant supraconducteur) qui va polariser les aimantations nucléaires, c'est-à-dire les aligner entre elles et sur B0 en induisant une aimantation macroscopique appelée M0.
- La détection de cette aimantation macroscopique est fondée sur sa mise en mouvement via une onde de radiofréquence délivrée par l'antenne d'émission permettant de faire pivoter l'aimantation des noyaux d'hydrogène par rapport à B0.
- Le retour à l'équilibre de M0 qui se réaligne sur B0 après l'excitation radiofréquence constitue la base du signal IRM. Ce retour à l'équilibre se fait selon des caractéristiques propres à chaque tissu sous la forme de : 1) la récupération de la composante longitudinale alignée sur B0 selon une exponentielle croissante en T1, et 2) la décroissance de la composante transversale perpendiculaire à B0 selon une exponentielle décroissante en T2.
- Ce sont les antennes de réception qui vont détecter la tension induite par ce retour à l'équilibre de l'aimantation qui correspond au signal IRM. Pour localiser ce signal IRM dans le volume exploré et ainsi obtenir une image, on utilise trois gradients de champ magnétique qui se superposent au champ magnétique principal B0 et qui permettent de coder la position du signal.
- La description chronologique de ces manipulations de l'aimantation constitue une séquence IRM qui peut favoriser le contraste induit par des différences de récupération de l'aimantation longitudinale (pondération T1) ou par des différences de décroissance de l'aimantation transversale (pondération T2).
- L'ajout de modules spécifiques au sein d'une séquence IRM peut aussi permettre d'annuler un signal tissulaire spécifique (eau libre, graisse) ou de sensibiliser le signal aux phénomènes de diffusion ou de perfusion.
- Des agents de contraste IRM, dont les plus utilisés sont les chélates de gadolinium, permettent d'accentuer le contraste des tissus au sein desquels ils s'accumulent.
- L'examen IRM est sans risque, à condition que le patient ne soit pas porteur de dispositif métallique implanté pouvant migrer, se dérégler ou entraîner un échauffement des tissus.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 7 - Échographie
F. Patat et M. Ronot
Plan du chapitre
- Notion d'onde mécanique
- Principes de l'échographie
- Bases sémiologiques du mode B
- Modes Doppler
- Agents de contraste échographiques
- Bases technologiques
- Conclusion
Objectifs
Les objectifs de ce chapitre sont de présenter les techniques ultrasonores en allant de la compréhension des principes physiques jusqu'aux bases sémiologiques des images obtenues. Dans ce parcours, il est nécessaire d'aborder la nature des interactions des ondes ultrasonores avec les tissus du corps humain et les bases techniques du fonctionnement des systèmes employés aujourd'hui. Ce descriptif est délibérément court et limité à la stimulation de l'intuition des phénomènes, sans calcul donc, hormis la connaissance de l'unité géométrique du champ acoustique, à savoir la longueur d'onde. La description des principaux modes Doppler qui, aujourd'hui, font partie de tout examen approfondi est également envisagée. Une synthèse des caractéristiques de l'échographie et les perspectives d'évolution des outils ultrasonores en médecine clôtureront ce chapitre.
Notion d'onde mécanique
Les ondes mécaniques sont des phénomènes très fréquents : les sons dans l'air, les vagues à la surface de l'eau, les tremblements de terre ou les vibrations d'une corde instrumentale. Pour en donner une définition plus générale et abstraite, on considère un milieu matériel quelconque (solide, liquide ou gazeux), au repos pour simplifier ; il est possible de modifier localement la position d'une partie du milieu par l'application de forces. Cette perturbation de l'équilibre local engendrera des forces de voisinage qui créeront alors un mouvement. Ce phénomène de déplacements induits de proche en proche est décrit par le concept d'onde mécanique sous-tendu par un autre mot clé, celui de propagation. Lorsque les ondes mécaniques peuvent être perçues par l'ouïe d'un être vivant sous forme de sons, on parle d'ondes acoustiques. L'acoustique est donc la science qui étudie les sons.
Propriétés du milieu de propagation
Certaines propriétés dites « mécaniques » du milieu conditionnent la façon dont les ondes s'y propagent. Une onde entraîne des déformations du milieu qui mettent en jeu ses différentes propriétés élastiques intrinsèques. Pour désigner ces propriétés, on utilise le terme de « module ». Dans un milieu isotrope, toutes les directions sont équivalentes ; il n'existe que deux modules élastiques indépendants : en compression (changement de volume mais pas de forme) et en cisaillement (changement de forme).
Les modules élastiques s'expriment en Pascal (Pa) ; ils correspondent à la contrainte mécanique nécessaire pour obtenir une certaine déformation. Pour définir le module élastique en compression, on utilise le coefficient K qui gouverne la loi de la pression P nécessaire pour obtenir un changement relatif donné de volume V :
ΔP= -K * ΔV / V
La variation relative de volume est bien ΔV / V et le signe – nous indique que, pour une pression positive, ΔP, on obtient bien une diminution de ce volume. K est le coefficient de proportionnalité entre la contrainte mécanique (la pression) et la déformation obtenue.
Pour l'eau, K = 2,25 GPa = 2,25 109 Pa. Il faut une pression de 22,5 MPa pour comprimer un volume d'eau de 1 %. C'est la pression qui règne par exemple à une profondeur de 2250 mètres.
La dynamique de la mise en mouvement de la matière dépend de son inertie, c'est-à-dire de sa masse volumique ρ. Pour l'eau, on a ρ = 1000 kg/m3. On définit, enfin, une caractéristique essentielle du milieu vis-à-vis des ondes : la vitesse de propagation, aussi appelée célérité. Il faut bien distinguer la célérité, qui est la vitesse du phénomène « onde », et la vitesse des molécules du milieu. Prenons l'exemple des vagues sur la mer : un objet flottant, qui représente le mouvement des molécules d'eau, a un mouvement essentiellement vertical, montant et descendant au passage des vagues. Celles-ci, en revanche, se propagent horizontalement beaucoup plus vite. La célérité d'une onde est rapide si le milieu a une forte élasticité, c'est-à-dire s'il est raide, difficile à déformer. Inversement, elle est plus lente si le milieu présente une masse volumique importante. On démontre que la célérité c est déterminée par célérité2 = coefficient élastique/masse volumique soit :
c2 = K / ρ
La célérité du son dans l'air vaut 340 m/s et correspond au mur du son en aéronautique. Dans l'eau, elle est encore plus importante et vaut 1500 m/s, soit 5400 km/h : le son d'un caillou jeté dans le port de Brest pourrait en théorie s'entendre à New York une heure plus tard ! Les caractéristiques intrinsèques du milieu que sont ses coefficients élastiques et sa masse volumique déterminent la célérité des ondes ultrasonores.
On distingue les ondes à polarisation transverse où le mouvement est perpendiculaire à la direction de propagation (c'est typiquement le cas avec notre exemple du bouchon flottant et des vagues) et les ondes à polarisation longitudinale où le déplacement de matière est parallèle au vecteur de propagation. Les ondes habituellement utilisées en échographie sont des ondes de compression qui se propagent dans des milieux (les tissus biologiques) dont la consistance est proche de celle de l'eau ; il s'agit d'ondes longitudinales.
Les ondes de cisaillement ne sont pas utilisées en échographie conventionnelle. Le module de cisaillement peut toutefois être utilisé afin de déterminer la « dureté » (rigidité) d'une zone prédéfinie. On parle d'élastographie ultrasonore. En effet, la vitesse de propagation des ondes de cisaillement est directement reliée à la rigidité du milieu. La mesure de cette vitesse est réalisée selon des modalités différentes de celles utilisées en échographie conventionnelle. Il s'agit d'une technologie d'introduction plus récente, mais qui se généralise.
On définit par ailleurs une autre quantité importante appelée impédance acoustique qui est le produit de la masse volumique par la célérité de l'onde : Z = ρ·c. Nous verrons plus loin en quoi Z est une caractéristique déterminante dans le comportement des ondes acoustiques lorsqu'elles changent de milieu. L'unité donnée à Z est le Rayl (1 Rayl = Pa· s/m) en hommage au grand physicien britannique J.W. Rayleigh (1842–1919), fondateur de l'acoustique moderne. Le tableau 7.1 donne les caractéristiques de l'air et de l'eau.
Tableau 7.1 - Propriétés mécaniques de l'air et de l'eau à 25 °C.
|
Milieu |
Masse volumique (kg ∙ m–3) |
Coefficient élastique (Pa) |
Célérité (m/s) |
Impédance Z (Rayl) |
|
Air |
1,3 |
1,5 105 |
340 |
442 |
|
Eau |
1000 |
2,25 109 |
1500 |
1,5 106 |
Ondes sinusoïdales
De nombreuses formes temporelles peuvent se propager sous forme d'onde. Un type fréquent dans la nature et très commode sur le plan mathématique est représenté par les fonctions sinusoïdales. Une telle onde pourra être décrite par la formule suivante où l'on décrit la pression p qui dépend à la fois du temps t et de la distance x :
p(X,t) = A ⋅ sin [2 π { (x/λ) - (t/T) } ] = A ⋅ sin [2π/λ V⋅ (x - c ⋅t)] = A ⋅ sin [2 π f { (x/c) - t } ]
A est l'amplitude, f la fréquence, T la période et λ la longueur d'onde. Le motif de l'onde se répète à intervalle régulier dans le temps – c'est la période T – et à intervalle régulier dans l'espace : il suffit de photographier le phénomène pour voir λ, la longueur d'onde. Le lien entre ces grandeurs est facile à retrouver : au bout d'un temps T, l'onde voyageant à la vitesse c se sera déplacée de la quantité c·T = λ. On a par ailleurs : T = 1/f et c = λ·f.
À noter que le signe – entre les variables temporelles et spatiales implique une propagation dans le sens des x positifs ; le signe + inverserait le sens (figure 7.1).
Représentation sur l'échelle des fréquences des principaux domaines des ondes mécaniques.
Chez les humains, les sons sont définis par la gamme de fréquences audibles par un sujet jeune, typiquement 20 Hz à 20 kHz. Au-delà, on parle d'ultrasons et les fréquences essentiellement utilisées en imagerie médicale sont dans la gamme 2 MHz à 20 MHz, ce qui correspond à des périodes temporelles entre 500 et 50 ns. Il est important d'avoir en tête les longueurs d'onde dans les tissus mous où la célérité est très proche de celle de l'eau ; une onde à 1,5 MHz dans un milieu où c vaut 1500 m/s a une longueur d'onde de 1 mm :
λ = c / f = {1500 m⋅s-1} / {1,5⋅106 s-1} = 10-3 m
Une onde de 15 MHz aura une longueur d'onde dix fois plus petite, soit un dixième de millimètre. Cette notion de longueur associée à l'onde est essentielle car c'est l'étalon selon lequel doivent être analysés tous les phénomènes subséquents, notamment les interactions ultrasons-tissus. C'est aussi le juste ordre de grandeur de la résolution que l'on peut attendre des images échographiques.
L'amplitude des ondes acoustiques peut s'exprimer dans différentes variables comme la pression p de l'onde (à ne pas confondre avec la pression ambiante du milieu qui est fixe) ou la vitesse v des molécules du milieu. On peut d'ailleurs noter que ces quantités sont proportionnelles et que le coefficient qui les relie est précisément l'impédance acoustique Z.
On a ainsi p = Z·v de la même manière qu'en électricité la loi d'Ohm U = R·I traduit le lien entre tension électrique et courant, la résistance R étant le coefficient de proportionnalité reliant ces deux grandeurs.
Propriétés acoustiques des tissus
Les propriétés acoustiques des tissus biologiques sont résumées dans le tableau 7.2. On voit très clairement sur ce tableau que l'ensemble de ce qu'on appelle les tissus mous en échographie, c'est-à-dire tous les organes, à l'exception du squelette et des organes à contenu gazeux, possèdent une impédance acoustique voisine de 1,6 MRayl et une célérité à peine supérieure à celle de l'eau. Cela reflète le fait que nos tissus contiennent une grande quantité d'eau et que, mécaniquement, à l'échelle des ondes ultrasonores, ils se comportent comme un milieu liquide épais aqueux très riche en lipides, protéines et glucides. Toutes ces molécules, essentielles à la vie, changent peu la masse volumique et la faible compressibilité (due à l'eau) de ces milieux. De façon similaire, la gamme des célérités des ondes acoustiques dans les tissus mous est assez restreinte au voisinage de 1550 m/s. Cette situation est extrêmement favorable et permet aux faisceaux d'ultrasons d'avoir des trajectoires presque droites, comme on va le découvrir ensuite. Il est important aussi de noter que ces propriétés, célérité de l'onde et impédance acoustique, sont indépendantes de la composition fréquentielle de l'onde propagée.
Tableau 7.2 - La célérité en m/s et l'impédance acoustique Z de différents milieux du corps humain.
|
Tissu |
Célérité (m/s) |
Z : impédance (MRayl) |
|
Air |
340 |
0,0004 |
|
Eau |
1480 |
1,48 |
|
Poumon |
650 |
0,06-0,26 |
|
Sang |
1566 |
1,65 |
|
Os cortical |
3000–4000 |
4,2-8 |
|
Foie |
1560 |
1,65 |
|
Graisse |
1450 |
1,38 |
|
Muscle |
1550–1630 |
1,65-1,74 |
|
Rein |
1570 |
1,65 |
|
Cerveau |
1550 |
1,6 |
|
Peau |
1600 |
1,84 |
|
Polyamide |
2340 |
2,9 |
Atténuation
Schématiquement, l'intensité d'une onde acoustique se modifie (le plus souvent diminue) au cours de sa propagation ; on parle d'atténuation. Deux phénomènes en rendent compte : l'absorption et la dispersion.
Pour traiter de l'absorption, il faut se souvenir qu'une onde acoustique transporte de l'énergie à la fois sous forme cinétique (avec la vitesse des molécules mises en mouvement) et sous forme potentielle (avec l'énergie élastique de déformation du milieu). Comme tout mouvement, ceux induits par le passage de l'onde entraînent des frottements et une partie de l'énergie est ainsi soustraite sous forme de chaleur. C'est le phénomène d'absorption qui contribue largement à atténuer l'énergie des faisceaux ultrasonores utilisés. Classiquement, la part d'énergie absorbée est proportionnelle à l'énergie en transit ; on retrouve donc la loi classique dans bien des domaines (optique ou rayons X) d'atténuation exponentielle. Si x est la distance parcourue et I(x) l'intensité au point d'abscisse x, alors où α est le paramètre d'atténuation dont la dimension est l'inverse d'une longueur, en cm–1 par exemple.
Deux points sont importants à retenir :
- aux fréquences qui nous intéressent en échographie, le coefficient α est assez élevé ; les faisceaux sont rapidement absorbés lorsqu'ils atteignent les régions anatomiques profondes. Les échographes comportent donc des systèmes d'amplification puissants pour les signaux rétrodiffusés distants ;
- dans les tissus, le coefficient α est proportionnel à la fréquence : α = β·f et comme il intervient dans l'exposant de l'exponentielle, l'accroissement de la fréquence augmente sensiblement l'absorption.
Il serait théoriquement préférable de réaliser des explorations échographiques à la plus haute fréquence possible de manière à utiliser de courtes longueurs d'onde, interagissant à une échelle très fine avec l'anatomie tissulaire et permettant ainsi d'obtenir les meilleures résolutions spatiales possibles. La recherche d'un compromis est nécessaire car les plus hautes fréquences sont trop vite absorbées. Cela explique pourquoi elles sont réservées à l'exploration des tissus superficiels. Concrètement, on utilise des sondes de basse fréquence pour explorer des organes profonds (bonne pénétration des ondes au prix d'une résolution spatiale moindre), a fortiori pour des patients en surpoids, et des sondes haute fréquence (excellente résolution spatiale mais absorption rapide) pour les investigations superficielles ou endocavitaires.
En ce qui concerne la dispersion, nous verrons ensuite qu'il est possible de manipuler les faisceaux ultrasonores ; ceux-ci sont rarement des ondes planes (c'est-à-dire des plans se propageant de façon perpendiculaire à la direction de propagation), mais plus souvent des ondes divergentes ou convergentes. L'énergie totale de l'onde, constante, se répartit ainsi sur des surfaces d'onde qui varient au cours de la propagation. Dans une zone où l'onde est divergente, la surface d'onde s'accroît et l'intensité locale diminue. Inversement, il est possible, comme nous le verrons dans le paragraphe « Bases technologiques », de focaliser les faisceaux, c'est-à-dire de concentrer l'énergie au voisinage d'un point focal. On peut par ce biais augmenter l'intensité locale.
Il faut retenir que, pour les appareils diagnostiques, l'absorption est, de loin, le phénomène dominant.
Interface entre milieux de propagation
Les variations intratissulaires d'impédance acoustique conditionnent la manière dont une onde ultrasonore interagit avec ce tissu. Ces interactions peuvent être catégorisées en considérant trois phénomènes : la transmission, la réflexion et la diffusion.
Considérons la situation schématisée sur la figure 7.2. Deux milieux de célérités différentes c1 et c2 sont séparés par une interface plane. Chacun des milieux étant homogène, les ondes acoustiques se propagent en ligne droite mais, à l'interface, les équations de propagation ne peuvent plus être satisfaites par une seule onde. Il se passe le même phénomène qu'en optique ; deux ondes supplémentaires par rapport à l'onde incidente prennent naissance : une onde réfléchie et une onde transmise, appelée aussi onde réfractée.
Interactions à l'interface de deux milieux (1 et 2) de célérité différente (c1 et c2).
Onde incidente (flèche noire), réfléchie (flèche bleue) et transmise (flèche verte) avec leur angle par rapport à la normale : θi, θr et θt.
Les valeurs de célérité gouvernent les lois des angles θ selon les lois de Snell-Descartes : θi = θr et c2· sin θi = c1· sin θt.
Remarque : Si sin θi ≥ c1/c2, il y a réflexion totale, c'est-à-dire une absence d'onde transmise.
Les célérités des milieux gouvernent les angles de réflexion et réfraction. En revanche, ce sont les impédances qui vont conditionner la puissance des ondes réfléchies et réfractées. Prenons le cas plus simple d'une incidence normale à l'interface (figure 7.3).
Deux milieux de caractéristiques acoustiques différentes séparés par une interface plane avec un triplet d'ondes incidente, réfléchie et transmise perpendiculaires à l'interface.
Si on définit par R et T les coefficients de réflexion et de transmission :
- R = puissance de l'onde réfléchie/puissance de l'onde incidente ;
- T = puissance de l'onde transmise/puissance de l'onde incidente.
Les lois de continuité à l'interface permettent de montrer que :
R = (Z1 - Z2)2 / (Z1 + Z2)2
et
T = (4 · Z1 · Z2) / (Z1 + Z2)2
On peut vérifier que R + T = 1, ce qui est logique puisque la puissance incidente est totalement répartie entre le faisceau transmis et le faisceau réfléchi.
La réflexion aux interfaces peut devenir très importante si les impédances sont très différentes et, dans ce cas, l'énergie transmise peut être considérablement réduite. C'est le cas des interfaces entre la sonde et l'air, puis entre l'air et la peau du patient. Pour éviter des pertes considérables à ces deux interfaces, il est nécessaire d'appliquer un gel entre la sonde et la peau du patient. Les fortes différences d'impédance entre tissus mous et air et entre tissus mous et os expliquent aussi l'impossibilité des explorations échographiques si le faisceau rencontre l'os ou des structures contenant des gaz (poumon, tube digestif).
L'interface plane a une surface très grande comparée à la longueur d'onde. Considérons maintenant le cas opposé d'un milieu constellé de petites hétérogénéités d'impédance dont la forme importe peu, puisqu'elles sont très petites à l'échelle de l'onde acoustique incidente, c'est-à-dire en comparaison avec sa longueur d'onde (figure 7.4).

Diffusion d'onde plane (en bleu) par une collection d'hétérogénéités d'impédance (en jaune).
Chacune des hétérogénéités est la source d'une microréflexion. Elle donnera lieu à une onde secondaire de forme sphérique, car issue d'une origine quasi ponctuelle. Ces ondes sphériques ainsi engendrées en très grand nombre sont incohérentes si les sources sont dispersées aléatoirement dans l'espace. Le faisceau incident est ainsi transformé en un ensemble d'ondelettes incohérentes sans direction privilégiée. Ce phénomène appelé diffusion est familier en optique (c'est l'explication du brouillard ou de l'aspect des nuages qui sont des assemblages de microgouttelettes d'eau liquide en suspension qui diffusent la lumière visible). Les tissus des organes observés en échographie sont constitués de cellules qui contiennent des noyaux ayant une plus grande impédance acoustique, séparées par de nombreuses interfaces entre elles et avec la microvascularisation, les fibres des tissus de soutien, etc. Chacune de ces microstructures contribue ainsi au caractère plus ou moins diffusant d'une région échographique.
Principes de l'échographie
Le principe sur lequel repose l'échographie est celui de l'écholocalisation. Il est utilisé, on le sait, dans le monde animal, notamment par les chauves-souris et certains mammifères marins. Le Sound Navigation And Ranging (SONAR), qui est une invention du XXe siècle, repose sur le même principe. Il a tout d'abord été utilisé à des fins militaires dans la guerre sous-marine, puis a été diffusé aux domaines de la pêche et du monde médical après 1945.
Ligne échographique
En échographie, tout commence avec la production d'ondes ultrasonores pulsées de courte durée, typiquement une période de la fréquence centrale, transmises au patient par la face avant de la sonde.
Le schéma de la figure 7.5 montre un système d'émission-réception d'onde ultrasonore pulsée. L'émetteur est ce que l'on appelle une sonde (à gauche du schéma). La sonde est tenue dans la main lorsque l'on réalise un examen échographique. Il en existe de très nombreux modèles, ayant des tailles et des formes différentes. Ces caractéristiques permettent de produire des ondes à des fréquences variées. Elles ont toutes en commun de pouvoir à la fois émettre et recevoir des ondes acoustiques et les transformer en signaux électriques. L'onde émise est supposée voyager sous forme d'un faisceau assez fin le long de la ligne pointillée en rouge. L'émission est pulsée sur le plan temporel (représentée par l'onde rouge sur le schéma). En pratique, elle oscille brièvement pendant une ou deux périodes, puis est stoppée. La sonde, après avoir émis l'onde initiale, se place en mode « écoute » et enregistre tous les signaux qui viennent frapper sa surface sensible. L'onde émise voyage (vers la droite sur le schéma) au sein du milieu à explorer et engendre, lorsqu'elle rencontre une rupture d'impédance acoustique, un couple onde réfléchie-onde transmise, comme nous l'avons vu. L'onde réfléchie retourne alors vers la sonde. On parle alors d'écho (qui donne son nom à l'échographie). L'onde transmise poursuit, quant à elle, son trajet dans la même direction, mais avec une puissance moins grande. La perte de puissance est faible si les ruptures d'impédance acoustique sont faibles, ce qui est souvent le cas dans les tissus mous. L'énergie qu'elle transporte peut ainsi provoquer de nouveaux échos en raison des contrastes d'impédance situés un peu plus loin en profondeur. Ces échos sont recueillis par la sonde après un délai t qui dépend de la durée du trajet aller-retour de l'onde ultrasonore. Si la source de l'écho est à la profondeur d, celui-ci arrivera avec le retard 2 d/c par rapport à l'instant d'émission. La détection d'un écho permet donc d'en déduire la profondeur à laquelle il a été généré. En écoutant suffisamment longtemps, la sonde recueille plusieurs échos successifs, générés à des profondeurs croissantes. Ainsi, avec une seule émission d'onde, on peut obtenir des renseignements sur l'anatomie acoustique le long de toute une ligne.
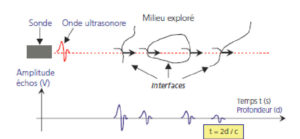
Schéma d'émission-réception d'une onde pulsée mettant en évidence l'interaction de l'onde transmise avec le milieu exploré.
En dessous, le diagramme amplitude-temps délais montre les délais d'arrivée des échos croissant avec la profondeur.
À noter que ces échos sont de moins en moins puissants en raison des phénomènes d'atténuation que subit l'onde durant son trajet aller puis retour. Des amplificateurs de signaux sont utilisés pour augmenter le signal au fur et à mesure que le temps (et donc la profondeur de l'écho) s'écoule à partir de l'instant d'émission. Cela porte le nom de « correction de gain en fonction de la profondeur » ou encore time gain control (TGC).
Enfin, il faut bien garder à l'esprit que le temps nécessaire à l'émission-réception des échos successifs est très court, permettant d'obtenir l'information désirée en très peu de temps. À titre d'exemple, calculons le temps nécessaire pour construire une ligne échographique dans une exploration sur une profondeur de 15 cm. Le temps nécessaire pour l'arrivée des échos les plus profonds est :
t = 2d / c donc t = 2 · 0,15 m / 1500 m·s-1 = 200 . 10-6 s = 200 μs
Réalisation d'une image en mode B
La fabrication d'une image numérique consiste à obtenir suffisamment d'informations pour attribuer une valeur à chaque pixel. Nous venons de voir que la réalisation d'un tir puis l'analyse des échos permettaient de collecter les valeurs d'échogénicité pour chaque profondeur située le long de la ligne de tir. Si l'on multiplie les émissions de façon incrémentale le long de la sonde, on réalise un balayage par les lignes de tir d'une surface plane à l'intérieur du patient (une coupe) (figure 7.6).
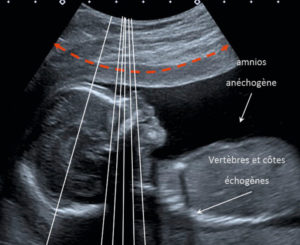
Image échographique et représentation schématique des lignes d'acquisition (lignes blanches) ayant effectué le balayage figuré par la double flèche rouge.
L'image obtenue (coupe sagittale d'un fœtus) correspond à l'ensemble de ce qui a été balayé par les tirs ultrasonores.
Par convention, la lecture d'une image échographique est toujours la même (voir chapitre 2) :
- la sonde est située en haut de l'image ;
- la forme de la sonde détermine celle de la partie haute de l'image échographique. Sur la figure 7.6, il s'agit d'une sonde courbe, ce qui explique la courbure du haut de l'image. Si la sonde avait été droite, le haut de l'image aurait été rectiligne ;
- les échos les plus profonds sont en bas de l'image ;
- si la sonde est placée de façon à obtenir un plan de coupe transversal, la droite réelle (du patient) est située à gauche de l'image et la gauche réelle est placée à droite de l'image. Si la sonde est dans une position sagittale ou oblique, les régions les plus crâniales se trouvent sur la gauche de l'image, et les régions les plus caudales sur la droite de l'image. Cela permet à chacun de comprendre l'orientation de la sonde en regardant l'image.
Comment sont créés les niveaux de gris dans une image échographique ? Très simplement, on représente, après la correction de gain en fonction de la profondeur, l'amplitude de chaque écho reçu par un niveau de gris et on attribue ce niveau au pixel correspondant à la localisation de l'écho. Les échos faibles sont par convention représentés par un gris presque noir et les échos puissants sont représentés par des niveaux de gris plus proches du blanc. La gamme d'amplitude possible des échos étant extrêmement vaste, on ne peut pas la représenter entièrement car son étendue dépasse les capacités de la vision humaine (qui ne peut distinguer guère plus de 20 à 30 niveaux de gris différents sur une même image). On utilise donc, comme le font nos sens naturels d'ailleurs, une conversion via une échelle logarithmique avant de représenter l'image en échelle de gris. Ces paramètres de conversion sont bien entendu accessibles à travers les réglages de la machine. Typiquement, on représente sur une même image une gamme d'échos, appelée aussi gamme dynamique, d'au moins 60 dB (décibels), c'est-à-dire une amplitude 1000 fois plus forte pour l'écho qui sature le blanc que pour l'écho donnant le premier niveau de gris. On appelle cette image une échographie en mode B, B pour brillance.
Finalement, une échographie en mode B est une cartographie du plan de coupe choisi, représentant les contrastes d'impédance acoustique des tissus rencontrés. Ces variations d'impédance sont liées à des changements, de faible ampleur, de la masse volumique ou de l'élasticité des tissus. Elles sont assez fortement corrélées à l'anatomie et on parle donc d'écho-anatomie pour traduire l'aspect des organes explorables sur ces images. Pour être précis, notons aussi que l'image obtenue se situe dans le plan de coupe passant par la sonde et formé par l'ensemble des faisceaux acoustiques ; d'où le terme d'échotomographie que l'on rencontre parfois, fondé sur la racine grecque « tomo » pour coupe.
Le balayage des lignes acoustiques produit une coupe. Le nombre d'images produites par seconde est appelé « cadence image ». À quelle cadence obtient-on les images du mode B ? Reprenons l'exemple précédent où l'acquisition d'une ligne nécessitait 200 μs. On peut donc disposer de 5000 lignes par seconde. Considérons qu'une image de qualité se compose de 200 lignes échographiques. On peut réaliser 5000/200, soit 25 images par seconde. Cette technique possède donc des cadences proches de celle du cinéma ou de la vidéo, et permet ainsi une acquisition dite en « temps réel ». C'est un avantage majeur de ce type d'imagerie.
Mode temps-mouvement (TM)
Ce mode appelé TM fut d'emblée inventé pour l'exploration cardiaque avant même la généralisation du mode B. Le cœur étant, par définition, une structure mobile, il est possible d'explorer les mouvements des parois ou des valves à l'aide d'une seule ligne immobile traversant des structures mobiles le long de cette ligne d'exploration.
Comme on le voit sur la figure 7.7, on utilise maintenant le mode B pour bien positionner la ligne du mode TM (pointillée). À la demande, le balayage est arrêté et on voit défiler le temps sur l'axe horizontal, ce qui permet d'analyser finement la dynamique temporelle des mouvements antéropostérieurs des structures croisant la ligne TM.
Sur cette copie d'écran, on voit en haut une image mode B du cœur qui a servi à positionner la ligne du mode TM (flèche).
Le résultat apparaît en bas, le temps en abscisse et la profondeur en ordonnée. Ce mode permet de mesurer notamment l'épaisseur des parois et le diamètre de la cavité ventriculaire gauche en systole et en diastole.
Mode 3D
L'opérateur peut déplacer le plan de coupe du mode B à sa guise et explorer ainsi l'anatomie de la région d'intérêt en trois dimensions, mais la représentation tridimensionnelle n'existe alors que dans le cerveau de l'échographiste. Cela demande une compétence forte et ne laisse pas de trace objective. On a donc imaginé piloter les faisceaux ultrasonores dans toutes les directions de façon à proposer une acquisition tridimensionnelle. La première méthode fut de placer une sonde barrette bidimensionnelle ordinaire dans un boîtier équipé d'un moteur faisant pivoter cette sonde lentement. Les acquisitions planes ainsi accumulées et mises en mémoire permettent ensuite de reconstituer un volume 3D et de proposer des visions selon différents angles. Avec cette technique, le caractère temps réel de la technique est perdu.
D'autres technologies ont vu le jour plus récemment, notamment pour les besoins de l'échocardiographie et de l'échographie obstétricale, comme dans l'exemple de la figure 7.8. Elles utilisent des sondes plus complexes, formées de capteurs ayant une structure matricielle de plus de 3000 éléments indépendants. Elles sont ainsi capables d'envoyer des tirs ultrasonores dans un volume. Des électroniques de pilotage adaptées ont été développées et permettent de saisir des volumes 3D avec un bon niveau de résolution spatiale et une cadence image satisfaisante.
Technologie 3D, extraction de la surface cutanée in utero d'un fœtus (âge gestationnel : 35 semaines d'aménorrhée).
Bases sémiologiques du mode B
Comme nous l'avons indiqué au paragraphe « Réalisation d'une image en mode B », l'affichage des images suit les règles classiques de l'imagerie médicale. La gauche du patient est à droite de l'image et, pour les coupes sagittales, le haut du patient est à gauche de l'image. Par ailleurs, le nez de sonde au contact avec le patient est positionné classiquement en haut de l'écran.
Échogénicité
Rappelons que l'image échographique en mode B est la représentation de l'intensité des échos ayant pris naissance tout au long de la propagation des faisceaux. On parle d'échogénicité. Si on revient à l'origine physique, c'est une carte des différences d'impédance acoustique de la zone explorée. Cela explique une caractéristique fondamentale de ces images : les zones parfaitement homogènes ne produisent pas d'écho. Elles sont dites anéchogènes, c'est-à-dire sans écho. Elles apparaissent en noir. Les structures vraiment homogènes sont les liquides purs. Les tissus, a contrario, sont parcourus de travées de collagènes, de microvaisseaux, de cellules, qui elles-mêmes possèdent un noyau et des microstructures internes responsables d'une diffusion plus ou moins forte des ultrasons. Les liquides donnant lieu à des plages anéchogènes sont donc le liquide amniotique (voir figure 7.6), la bile, l'urine, le liquide cérébrospinal (LCS) visible en échographie transfontanellaire (à travers les fontanelles des nouveau-nés) en pédiatrie. Les épanchements pleuraux, péricardiques ou péritonéaux, les kystes simples sont aussi des zones anéchogènes et cela contribue d'ailleurs à leur identification. Le cas du sang est à distinguer : ce n'est pas un liquide à proprement parler car il contient 4 à 5 millions d'hématies par millimètre cube. Aux fréquences usuelles de 2 à 12 MHz, cela entraîne une diffusion extrêmement faible par rapport aux échos provenant des autres tissus. La conséquence est que le sang apparaît en noir sur les réglages usuels. Le repérage des gros vaisseaux, ainsi clairement identifiables, constitue d'ailleurs une des bases de l'échoanatomie. Néanmoins, cette diffusivité acoustique du sang donne des signaux, certes faibles, mais qui permettent la construction des modes Doppler (voir plus loin). Notons aussi que les globules rouges sont parfois regroupés en amas de rouleaux voyageant ensemble ; c'est le cas lorsque le cisaillement de l'écoulement est faible. Le centre diffuseur est alors beaucoup plus efficace et plus échogène ; le sang devient visible en échographie classique, par exemple dans la veine cave inférieure ou au sein d'un atrium gauche dilaté.
Les fortes ruptures d'impédance acoustique entraînent des échos très puissants qui sont codés en blanc sur les images. Les interfaces ayant un coefficient de réflexion proche de 100% entraînent une réflexion totale du faisceau : le faisceau émis ne poursuit pas l'exploration à des profondeurs plus grandes. On obtient alors un écho saturé en blanc, hyperéchogène, et en arrière une zone sans écho ou contenant des artefacts. Les structures osseuses et les organes à contenu gazeux (poumons et tube digestif) produisent de telles situations et constituent donc une limite à l'exploration échographique.
Cône d'ombre et renforcement postérieurs
Nous avons vu que l'amplitude des échos recueillis sur la sonde décroît avec la profondeur et que ce phénomène est compensé par une amplification à gain électronique croissant. Mais cela n'est juste qu'en moyenne. Plus spécifiquement, en arrière d'une zone plus atténuante, les échos sont de plus faible amplitude que leurs homologues de même profondeur et apparaissent avec une brillance affaiblie sous forme de cône d'ombre postérieur à la zone hyper-atténuante (figure 7.9). À l'inverse, un milieu moins atténuant (derrière une structure liquidienne comme un kyste) laisse passer un faisceau plus intense et les échos postérieurs paraîtront avec une brillance plus grande. On parle dans ce cas de renforcement postérieur.
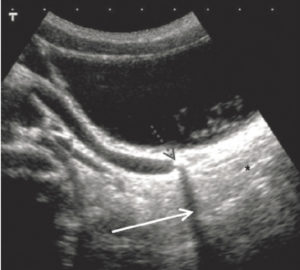
Formation d'artefacts.
Renforcement postérieur à droite de l'image (astérisque) en arrière de la zone liquidienne (vessie en réplétion). Cône d'ombre (flèche) situé en arrière d'un calcul de l'uretère (flèche pointillée).
Modes Doppler
Effet Doppler
L'effet Doppler, ainsi nommé d'après le nom du physicien autrichien Christian Doppler (1803–1853), traite des modifications de la fréquence des ondes perçues selon la vitesse relative de l'émetteur et du récepteur. Ce phénomène n'est pas limité aux ondes acoustiques ; c'est par exemple un moyen de mesure de la vitesse d'éloignement des galaxies par observation des décalages des spectres optiques.
Sur la figure 7.10, on a imaginé une situation banale : un véhicule se déplace en émettant un son à une certaine fréquence. Deux observateurs entendent le son du moteur, le premier, Mlle K., voit la machine s'éloigner, tandis que M. J. la voit se rapprocher de lui. On a noté T0 la période du son et λ0 sa longueur d'onde lorsque la moto est au repos. V est la vitesse de déplacement horizontal. Les cercles qui sont dessinés en gris représentent les fronts d'onde (ou zone équiphase). Ils ne sont pas concentriques. En effet, le cercle le plus petit est le plus récent ; en revanche, le cercle le plus grand est plus ancien, c'est-à-dire qu'il a été émis auparavant, ce qui explique qu'il a eu le temps de grandir par propagation. Mais au moment de l'émission du plus grand cercle, la moto était plus à gauche ; le centre du grand cercle est donc décalé vers la gauche, et ce d'autant plus que l'engin se déplace vite. Le résultat est visible sans démonstration sur la figure 7.10 : M. J. perçoit des fronts d'onde tassés vers lui et donc la longueur d'onde qu'il entend est plus courte, ce qui correspond à une fréquence plus élevée : le son est plus aigu. Inversement, Mlle K. perçoit des fronts d'onde écartés ; elle entend un son plus grave. Cela décrit une expérience auditive courante quand nous sommes au bord d'une route et écoutons passer des véhicules à forte vitesse ; ils s'approchent avec un bruit plus aigu et s'éloignent avec un bruit plus grave. On peut facilement calculer de combien sont raccourcis ou écartés deux fronts d'onde successifs : le temps écoulé entre deux fronts est T0 et la distance parcourue par la moto est V.T0. Si, par convention, la vitesse V est comptée positive en situation de rapprochement et négative en situation d'éloignement, la longueur d'onde perçue par Mlle K. et M. J. est calculée par la même équation : λ = λ0 – V·T0. mais λ0 = c·T0 et donc λ = (1 – V/c)·λ0.
On voit sur ce schéma une source de son en déplacement, le moteur de la moto, et deux observateurs, Mlle K. et M. J.
Pour calculer la fréquence, il suffit de considérer que f = c/λ. Si V/c est petit devant 1, le calcul se simplifie et aboutit en première approximation à f = f0· (1 + V/c).
On voit que f est égal à f0 additionné d'un petit terme égal à f0· V/c. C'est ce que l'on appelle le décalage Doppler de fréquence fD. La fréquence Doppler fD est la différence entre la fréquence perçue par l'observateur avec celle émise par l'émetteur. De façon simple, elle répond à l'équation suivante :
fD / f0 = V / C
Le rapport des fréquences (Doppler et originelle) est égal au rapport des vitesses (objet et onde). À cause de la simplification effectuée dans le calcul, cette loi n'est valide que pour les vitesses V petites devant c. La fréquence fD a le même signe que V : positif en rapprochement et négatif en situation d'éloignement.
Mode Doppler continu
Le décalage de fréquence lié à la vitesse de déplacement est mis à profit pour effectuer à distance des mesures de vitesse, avec les radars par exemple. En médecine, ce décalage est surtout utilisé pour mesurer la vitesse du sang.
Sur la figure 7.11, on voit le principe de fonctionnement d'un système Doppler continu. La sonde émet un faisceau en permanence à la fréquence f0, d'où l'appellation Doppler à émission continue, et capte simultanément les ondes rétrodiffusées. Les ondes rétrodiffusées par les globules rouges subissent deux fois l'effet Doppler, une première fois lorsque les hématies sont éclairées par le faisceau en s'en éloignant (comme sur la figure) et une seconde fois lorsqu'elles deviennent à leur tour émettrices en direction de la sonde. Cela explique le facteur 2 que l'on trouve dans le calcul. La vitesse relative entre la sonde et les hématies n'est pas la même que la vitesse du sang car le vaisseau est oblique par rapport à la sonde. La vitesse « vue » par la sonde est donc la projection de la vitesse réelle des hématies sur la ligne du faisceau ultrasonore. Elle se calcule en multipliant V (la vitesse réelle des hématies) par le cosinus de l'angle θ entre le vaisseau sanguin et la ligne de tir ultrasonore. De façon réciproque, lorsqu'on veut utiliser l'effet
Doppler pour mesurer une vitesse de circulation sanguine, on mesure fD connaissant f0 et cos θ et on déduit V grâce à :
V = (fD / f0) * c / {2⋅ cos θ}
Schéma de fonctionnement du mode Doppler continu.
Une sonde engendre un faisceau ultrasonore dessiné en bleu qui croise un vaisseau sanguin sous l'angle θ. La vitesse de circulation est indiquée par le vecteur V.
On comprend donc que si le vaisseau sanguin est strictement perpendiculaire à la sonde (angle θ = π/2), il n'existe pas de signal Doppler (cos θ = 0 donc fD = 0). À l'inverse, si le vaisseau est exactement dans l'axe du faisceau ultrasonore et donc perpendiculaire à la sonde, cos θ vaut 1 et la fréquence Doppler est maximale.
Mode Doppler pulsé
L'inconvénient majeur du Doppler à émission continue est qu'il n'existe pas de discrimination en fonction de la profondeur. Ces systèmes sont donc très simples et faciles à utiliser pour des vaisseaux superficiels facilement repérables en fonction des repères anatomiques. On peut par exemple très aisément utiliser un petit appareil portatif aux urgences pour contrôler la perméabilité des axes vasculaires des membres en cas de suspicion de thrombose.
En revanche, si l'on veut apprécier l'hémodynamique d'une artère rénale ou d'un tronc porte en un point précis, il est nécessaire d'utiliser l'imagerie échographique en mode B pour positionner une zone dans laquelle on désire mesurer la fréquence Doppler (selon les mêmes principes que ceux exposés pour le Doppler continu). Cela est obtenu en utilisant une émission pulsée produite de façon à analyser précisément une profondeur donnée en utilisant le délai nécessaire aux ondes acoustiques pour parcourir un aller-retour. Tout ce qui est situé en dehors de cette zone Doppler d'intérêt n'est pas analysé. La multiplication des tirs permet d'obtenir l'évolution temporelle des vitesses dans cette zone.
Si le signal Doppler pulsé permet une parfaite localisation du flux en profondeur, il a l'inconvénient d'être limité dans la fréquence mesurable. En effet, les allers-retours successifs des impulsions ultrasonores se font à une fréquence forcément limitée. Cette fréquence d'échantillonnage limite la fréquence Doppler mesurable et donc les vitesses d'écoulement sanguin mesurables. Cette limitation s'accroît en profondeur et avec la fréquence des ultrasons utilisés. Le Doppler continu, lui, n'a pas de limitation en fréquence et permet de mesurer toutes les vitesses d'écoulement.
Représentation du signal Doppler
La nature faisant bien les choses, en utilisant les fréquences habituelles de l'échographie (quelques MHz) et avec le rapport V/c vitesse du sang sur vitesse des ultrasons typiquement compris entre 1/10 000 et 1/1000, la fréquence des signaux Doppler est dans la gamme du kHz et donc bien adaptée à notre audition. Le signal Doppler s'écoute donc, ce qui permet d'ajuster finement le positionnement manuel de la sonde et de la zone de mesure.
Par ailleurs, il existe des dizaines de millions d'hématies circulantes possédant des vitesses différentes et engendrant donc tout un spectre de fréquences Doppler. Cela peut être rendu très explicite en utilisant l'outil mathématique de la transformée de Fourier qui décompose les différentes fréquences contenues dans un signal pendant une durée d'analyse définie. On obtient ce que l'on appelle un spectre Doppler représentant la part respective des différentes vitesses contenues dans le signal de la zone d'intérêt. C'est l'analyse dite « spectrale ». C'est ce mode qui est représenté sur la figure 7.12.
Analyse de spectre d'un signal Doppler, ici obtenu sur une artère fémorale.
Le temps est en abscisse, les fréquences positives ou négatives en ordonnée et l'échelle de gris montre la puissance du signal Doppler pour chaque pixel. L'hémodynamique est bien restituée en termes de fluctuation temporelle des vitesses. GR : globules rouges.
Un apport intéressant de l'analyse spectrale est qu'elle met parfaitement en évidence les vitesses maximales circulantes, le plus souvent au centre du vaisseau. Elles donnent lieu aux fréquences les plus élevées, en positif ou en négatif, et le contour du spectre permet de parfaitement suivre l'hémodynamique, même lorsque le rapport signal sur bruit est faible dans l'exploration des vaisseaux profonds.
Mode imagerie Doppler
En combinant la technique de l'imagerie qui permet un balayage d'un plan de coupe et la capacité du Doppler pulsé de réaliser des mesures de vitesse sur une zone restreinte et assez bien résolue (de l'ordre de quelques longueurs d'onde), il est possible de créer un mode cartographique en temps réel des vitesses circulatoires sur une zone d'exploration définie par l'opérateur. Les vitesses de circulation sont représentées en couleur avec pour convention : nuances de rouge pour les flux se rapprochant de la sonde et nuances de bleu pour les flux s'en éloignant. On parle communément de mode Doppler couleur. Cette carte de couleurs peut être actualisée avec une cadence assez rapide (typiquement 5 à 30 fois par seconde) tout en la superposant à l'affichage de l'image en l'échelle de gris du mode B (figure 7.13).
On voit sur la figure 7.13 une image figée résumant une acquisition couplant trois modes. Le mode B permet de repérer la lumière des vaisseaux carotidien et jugulaire interne. Le mode couleur représente la circulation sanguine dans la zone d'intérêt (cadre oblique) et le signal Doppler pulsé est affiché en dessous sous forme d'analyse spectrale où l'on distingue cinq cycles cardiaques. Elle donne la distribution des vitesses au point d'intersection des lignes blanches dans l'artère carotide. Le contour spectral montre les vitesses maximales des hématies circulantes dans la zone de mesure positionnée au centre de l'artère. On remarque que les tirs ultrasonores pour les modes Doppler ont été inclinés par rapport au capteur situé en haut de l'image mode B au contact de la peau (la ligne blanche et la boîte Doppler sont obliques). Cela permet de diminuer l'angle entre l'axe des vaisseaux et les tirs Doppler, et ainsi d'obtenir une valeur plus grande du cosinus de cet angle, permettant une évaluation plus fidèle des vitesses. Par convention, la tête du patient est du côté gauche de l'image ; le sang artériel carotidien circule de la droite vers la gauche, se rapprochant donc de la sonde. Cela explique le codage en rouge du flux carotidien.
Aspect habituel d'une image associant les modes B, imagerie Doppler et spectre du Doppler pulsé.
Le signal Doppler pulsé a été recueilli dans la fenêtre de mesure au centre de l'artère carotide commune encodée ici en rouge orangé. L'écoulement se fait de la droite vers la gauche de l'image, donc en situation de rapprochement de la sonde. Le codage en bleu au centre correspond pour quelques pixels à un artefact de sous-échantillonnage.
Agents de contraste échographiques
Principes des microbulles
Les échographistes disposent depuis les années 2000 d'agents de contraste injectables en intraveineux. Il s'agit de suspensions de microbulles de gaz stabilisées de diamètre de 1 à 5 μm. Ces agents restent en circulation une dizaine de minutes. En revanche, à la différence des agents de contraste utilisés en TDM et en IRM, les microbulles de gaz ne diffusent pas dans le tissu interstitiel. Ce sont des agents strictement intravasculaires. Après plusieurs minutes, les bulles sont détruites et le signal décroît. Le gaz contenu dans les bulles est éliminé par voie respiratoire.
Sous l'effet du faisceau ultrasonore qui les frappe, les microbulles entrent en résonance, c'est-à-dire qu'elles se contractent et se dilatent selon la fréquence de résonance. Ce faisant, elles se comportent chacune comme un petit émetteur/amplificateur local. La somme de tous les petits signaux créés par chaque bulle produit un signal non linéaire. De manière très simple, les bulles qui entrent dans le champ de vue du faisceau ultrasonore « brillent » de manière très intense, produisant un contraste marqué entre les zones où elles sont situées (vaisseaux) et les zones où elles ne le sont pas. Aux niveaux d'énergie habituellement utilisés pour réaliser une échographie morphologique, les bulles se dilatent trop et éclatent instantanément ; l'énergie du faisceau est donc diminuée. La conséquence est qu'il n'est pas possible de réaliser une échographie morphologique avec ce mode. Sur les échographes modernes, il est possible d'afficher sur l'écran à la fois une image morphologique de repérage et l'échographie de contraste pour naviguer dans les deux à la fois.
L'analyse d'une échographie de contraste prend en compte la manière avec laquelle les structures d'intérêt sont modifiées par l'arrivée du produit de contraste : augmentation de la brillance (rehaussement ou, en langage commun, « prise de contraste »), comparaison entre deux structures proches, évolution dans le temps.
Effets indésirables et contre-indications
Les produits de contraste ultrasonore sont très bien tolérés. Ils ne sont pas néphrotoxiques et peuvent être utilisés en cas d'insuffisance rénale. Ils ne sont pas autorisés pendant la grossesse. Ils ne doivent pas être utilisés en cas d'infarctus du myocarde récent ou d'insuffisance respiratoire sévère.
Bases technologiques
Capteurs ou sondes d'échographie
Comme collecteurs de signaux, les sondes (ou capteurs) sont des éléments déterminants de la qualité des images obtenues. Ce sont aussi les objets que les échographistes tiennent dans leur main et appliquent sur les patients. Voyons ci-après le type de capteurs qui est à la base du développement des imageurs modernes : il s'agit de sondes à barrette de transducteurs. Elles sont schématisées dans la figure 7.14.
Un alignement ou barrette de transducteurs indépendants est piloté par le même nombre de systèmes électroniques émetteur-récepteur qui déterminent l'ordre temporel d'émission (retard).
On peut ainsi combiner à volonté les ondes élémentaires créées par chaque transducteur et modeler la forme et la direction du faisceau ultrasonore.
On peut ainsi combiner à volonté les ondes élémentaires créées par chaque transducteur et modeler la forme et la direction du faisceau ultrasonore.
D'une manière générale, on appelle transducteur un dispositif capable de convertir un signal physique en un autre. Dans le cas de l'échographie, les transducteurs sont formés d'un matériau piézoélectrique capable de transformer une impulsion électrique en un microdéplacement conduisant à la création d'une onde acoustique. Réciproquement, une onde sonore frappant la surface d'un transducteur est transformée en une impulsion électrique. Une sonde d'échographie est formée par l'association de nombreux transducteurs de base, indépendants les uns des autres. Pour piloter à volonté les faisceaux ultrasonores, à la fois en termes de focalisation et d'orientation, on adresse à chaque transducteur d'une barrette un signal adéquat qui l'active. Chaque transducteur produit alors une petite onde et c'est la combinaison cohérente de toutes les ondes créées par les transducteurs qui forme le faisceau ultrasonore final. En modifiant l'amplitude et le retard avec lesquels chaque transducteur est activé, il est possible de déterminer le point où les ondes se rejoignent et se recombinent. On parle de point focal. De même, en déplaçant, comme on peut le voir sur la figure 7.14, le groupe actif de transducteurs, il est possible d'obtenir une translation du faisceau explorant les tissus. La polyvalence de ces barrettes permet, via l'électronique de pilotage, la genèse d'impulsions brèves, la focalisation de l'énergie acoustique sur quelques longueurs d'onde et le balayage de la ligne d'exploration. Ce sont les ingrédients nécessaires à la réalisation des images mode B 2D et 3D.
Conclusion
Caractéristiques générales de l'échographie
Les éléments déterminant les aspects spécifiques de l'échographie peuvent être résumés de la façon suivante.
- Avantages :
- investigation non ionisante sans limitation de dose ;
- exploration en temps réel ; l'opérateur est en situation de piloter la sonde dans l'espace anatomique 3D du patient ;
- cadence élevée de renouvellement des images, précieuse en cardiologie ou pour les explorations dynamiques de l'appareil musculosquelettique ;
- excellente résolution spatiale ;
- examen au contact du patient, prolongement naturel de l'examen clinique du patient ;
- technique légère et mobile, qui peut être réalisée facilement au lit du patient ou au bloc opératoire ;
- guidage des actes de biopsie percutanée ou de ponction vasculaire ;
- coût d'investissement moindre que la TDM, l'IRM ou la scintigraphie.
- Limites :
- exploration limitée par les structures contenant des gaz (digestives, pulmonaire) et le squelette ;
- exploration limitée dans l'espace, différente en ce sens des autres techniques d'imagerie en coupe où l'on acquiert un volume anatomique prédéfini mais large ;
- demande un long apprentissage (courbe d'apprentissage) pour acquérir la coordination main-regard-analyse des images ;
- variabilité de la qualité des images en fonction des patients. L'échographie cardiaque d'un patient obèse et porteur d'une bronchopathie chronique obstructive est de moins bonne qualité que celle d'un jeune sportif de 60 kg ;
- il existe, comme pour toutes les modalités d'imagerie, des artefacts qu'il faut connaître et interpréter ;
- une exploration échographique est moins réinterprétable en différé que les images en coupe, car plus dépendante de la qualité de l'acquisition et du stockage des données. Cet aspect est moins problématique depuis la généralisation des systèmes de stockage d'images (PACS) et la possibilité d'acquérir et de stocker des boucles vidéo.
Perspectives d'avenir
Les technologies à l'œuvre dans la conception et la fabrication des échographes ont continuellement évolué depuis l'époque des pionniers de l'échographie des années 1960 et 1970. Les progrès de la miniaturisation et de la micromécanique permettent de produire des sondes de plus en plus performantes. Par ailleurs, les composants électroniques actuels permettent de s'approcher très près des limites théoriques du rapport signal sur bruit. Les machines sont numériques depuis la fin des années 1980 et celles d'aujourd'hui comportent des microprocesseurs extrêmement puissants qui supportent les algorithmes très sophistiqués de traitements de signaux et d'image qui interviennent dans les calculs d'optimisation.
Les usages se diversifient : il est commode et sécurisant de disposer d'un outil échographique dans de nombreux lieux comme les réanimations, les urgences, les salles d'anesthésie locorégionale, les lieux de biopsie ou de prélèvement de tissus.
En termes de sécurité, nous disposons d'un recul suffisant (en particulier avec des millions d'échographies anténatales) permettant d'affirmer qu'il s'agit d'une méthode sans danger. Toutefois, les ultrasons interagissent avec les tissus et, à forte intensité, peuvent créer des effets biologiques significatifs. Un nouveau secteur est aujourd'hui en plein développement ; il s'agit de l'utilisation des ultrasons à but thérapeutique. Des machines sont déjà commercialisées qui permettent une ablathermie ou destruction localisée des tissus via l'échauffement jusqu'à 60 à 90 °C de la cible pendant quelques secondes, cela grâce à un faisceau ultrasonore fortement focalisé et de haute intensité. Les lésions prostatiques ou les fibromes utérins constituent deux exemples des premières applications validées. Le traitement du glaucome chronique et le traitement de cibles tumorales font l'objet d'essais cliniques de grande ampleur. D'autres voies de recherche visent à augmenter de manière très sensible la biodisponibilité locale d'agents anticancéreux, ouvrant la possibilité de limiter les effets toxiques sur l'ensemble des organes.
Enfin, les années à venir verront la généralisation des échographes ultraportables qui tiennent dans la poche d'une blouse ou ont la dimension d'une tablette informatique. Le défi associé à cette diffusion n'est pas technologique ou commercial, mais celui de la formation des futurs utilisateurs.
Essentiel à retenir
- Les ondes ultrasonores utilisées en médecine sont des ondes mécaniques de 2 à 20 MHz dont la longueur d'onde au sein des tissus est de quelques dixièmes de millimètre.
- La célérité et la masse volumique des tissus mous varient très légèrement et cela suffit à créer des modifications d'impédance acoustique génératrices d'échos acoustiques.
- La mise en forme et le traitement numérique des échos recueillis permettent la reconstitution d'images et de cartographies de vitesses grâce à l'effet Doppler.
- Les modes associés à l'effet Doppler apportent une information fonctionnelle à l'exploration en montrant les mouvements du sang circulant.
- La vitesse du son dans les tissus est suffisamment rapide pour permettre une production d'images en temps réel.
- En tenant la sonde en main, l'échographiste est en situation de pilotage des plans de coupe qu'il va explorer au sein de son patient.
- Les systèmes échographiques bénéficient des dernières technologies en matière de science des matériaux pour les sondes et de puissance de calcul pour le traitement des signaux.
 |
Chapitre suivant |
 |
Retour au sommaire |
