Les fondamentaux - Chapitre 6 - Notions de radioprotection
G. Bonardel et J.-F. Chateil
Plan du chapitre
- Fondements de la radioprotection
- Mise en œuvre pratique de la radioprotection
- Informations à délivrer aux patients
- Conclusion
Objectifs
- Connaître les fondements de la radioprotection.
- Mise en œuvre pratique : justification, optimisation, exposition professionnelle dans le cadre de l'imagerie médicale.
- Savoir quelle information délivrer au patient.
Fondements de la radioprotection
La radioprotection correspond à l'ensemble des mesures mises en œuvre pour se protéger des effets néfastes reconnus ou potentiels des rayonnements ionisants (RI). En médecine, ces mesures concernent tout d'abord les patients et les personnels exposés professionnellement, et s'étendent également au public et à l'environnement. En plus de la gestion du risque physique, la radioprotection s'attache également à prendre en compte la dimension psychologique pour ne pas entretenir l'anxiété liée à l'exposition aux RI mais, au contraire, la diminuer.
Nature et effets des rayonnements ionisants (RI)
Les RI sont des rayonnements d'énergie suffisante pour éjecter un électron de l'orbite électronique d'un atome. Il existe des RI naturels et artificiels, ces derniers étant utilisés en médecine soit à titre diagnostique, soit à titre thérapeutique. Ils sont électromagnétiques dans le cas des photons X ou γ, alors de masse nulle (utilisés respectivement en radiologie et en médecine nucléaire), ou particulaires lors de l'émission de corpuscules de masse non nulle : rayonnement β+ (utilisé en tomographie par émission de positons [TEP]), β– ou α (utilisés en médecine nucléaire à visée thérapeutique – radiothérapie vectorisée). Les autres techniques de radiothérapie font appel à des rayonnements puissants (photons de haute énergie, électrons, protons) focalisés pour détruire une tumeur.
L'énergie générée par les RI peut entraîner des modifications de la matière vivante, au niveau cellulaire où ces rayonnements sont susceptibles d'induire des lésions, notamment de l'acide désoxyribonucléique (ADN). Ces effets sur l'organisme varient en fonction de la dose reçue et de différents facteurs : la source (activité ou intensité de fonctionnement, nature, énergie), le mode d'exposition (temps, débit) et la cible (tissus ou organes touchés, âge de l'individu – les enfants étant plus vulnérables –, radiosensibilité individuelle).
Il existe deux types d'effets des rayonnements ionisants (figure 6.1) :
- les effets précoces (déterministes) sont dus à l'effet physique de l'irradiation et sont la conséquence de la mort cellulaire induite par le rayonnement. Ils sont quantifiables en fonction de la dose absorbée (voir plus loin). C'est l'effet qui est recherché en cancérologie lors de l'emploi de la radiothérapie. Ils apparaissent toujours au-delà d'une dose-seuil connue (qui dépend de l'organe et n'est pas inférieure à 300 mSv) et leur gravité augmente avec la dose reçue. Ils peuvent engager le pronostic vital en cas d'irradiation globale et peuvent avoir des conséquences fonctionnelles lourdes en irradiation partielle (alopécie, brûlures). Seules la radiologie interventionnelle (acte thérapeutique guidé par l'imagerie) et la radiothérapie interne vectorisée en médecine nucléaire exposent le patient à des doses suffisantes pour créer un risque déterministe. Le traitement des lésions tardives (fibrose, cataracte) étant difficile et peu efficace, il faut donc tout mettre en œuvre pour les prévenir, par la connaissance et le respect des doses limites, ce qui nécessite une dosimétrie précise lors des gestes réalisés ;
- les effets tardifs (aléatoires ou stochastiques) sont liés à des mutations ponctuelles radio-induites de l'ADN et peuvent aboutir à la survenue d'affections malignes. Le risque de survenue est apprécié à partir de l'impact biologique supposé, exprimé en sievert (Sv). Le délai d'apparition après l'exposition est de plusieurs années. Une tumeur radio-induite n'a pas de signature particulière reconnue : absence de marqueur biologique permettant de différencier, par exemple, un cancer pulmonaire dû au tabac d'un cancer pulmonaire radio-induit. La probabilité d'apparition d'un cancer radio-induit est fonction de la dose de l'irradiation, selon une relation linéaire au-dessus de 100 mSv, mais elle est très débattue pour les doses plus faibles.
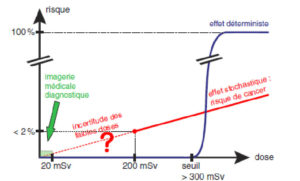
Effets déterministes et effets stochastiques en fonction de la dose.
Grandeurs et unités utilisées en dosimétrie, radiobiologie et radioprotection
Les unités employées en radioprotection dérivent du système international (SI). Il est important de savoir utiliser l'unité pertinente pour chaque grandeur mesurée.
Grandeurs physiques : reflet des interactions physiques des RI avec la matière
- La dose absorbée est la quantité d'énergie délivrée par un rayonnement par unité de masse de tissu ; elle s'exprime en gray (1 Gy = 1 J/kg).
- L'activité d'un radionucléide est le nombre de transitions nucléaires spontanées par seconde, avec émission d'un rayonnement ionisant. Elle est mesurée en becquerel (Bq ou s–1). L'activité spécifique d'une substance correspond à l'activité par unité de quantité de matière : celle du corps d'un adulte de 140 Bq/kg, celle de l'eau de mer de 12 Bq/L et celle du granit de 7000 Bq/kg.
Grandeurs dosimétriques : évaluation du risque pour la santé des RI
Les grandeurs dosimétriques se classent en deux familles :
- d'une part, les grandeurs de protection qui sont la base des limites imposées par les textes réglementaires, notamment pour la protection des travailleurs, de la population générale. Elles ne sont pas directement mesurables et reflètent le préjudice pour la santé du fait d'une exposition interne et/ou externe aux RI. Elles comprennent :
- la dose équivalente à l'organe, qui correspond à la dose reçue par un organe pondérée d'un facteur d'efficacité biologique du rayonnement selon sa nature (photons, électrons, neutrons, etc.) ;
- la dose efficace sur le corps entier qui est calculée par une pondération sur les différents organes pour tenir compte de leurs sensibilités différentes aux rayonnements. Le Sievert (Sv) est l'unité de mesure utilisée en radioprotection pour mesurer l'effet d'un rayonnement sur un organisme vivant. Cette unité permet donc de comparer l'effet d'une même dose délivrée par des rayonnements de nature différente à des organismes, des organes ou des tissus qui n'ont pas la même sensibilité aux rayonnements.
- d'autre part, les grandeurs opérationnelles, permettant d'avoir des unités simples à utiliser lors de la pratique quotidienne : en radiodiagnostic, on utilise des grandeurs dosimétriques spécifiques telles que le produit dose × surface (PDS) pour l'imagerie de projection, qui s'exprime en mGy·cm2, l'index de dose scanographique (IDS ou computed tomography dose index [CTDI]) qui tient compte du profil de coupe en tomodensitométrie (TDM ou scanner) sans refléter la dose totale reçue par le patient, cette dernière étant exprimée par le produit dose × longueur (PDL) qui permet de représenter l'exposition en affectant la dose au volume exploré ; le PDL s'exprime en mGy·cm. PDS et PDL permettent, en prenant en compte les organes exposés, de calculer ou d'estimer la « dose efficace », elle-même exprimée en Sv.
Épidémiologie des effets en rapport avec les RI
Rappelons tout d'abord que l'exposition aux RI s'effectue dans un contexte d'exposition globale de la population humaine. Cette exposition se distingue habituellement en deux sources dont les effets s'additionnent :
- l'exposition naturelle (ensemble des sources extérieures à toute activité humaine et existant indépendamment de celle-ci : irradiation cosmique, tellurique et corporelle) estimée en moyenne à 2,9 mSv par an en France ;
- et l'exposition artificielle, très largement liée à l'activité médicale, qui est d'environ de 1,6 mSv par an et par individu. Il ne faut pas oublier que la dose cumulée annuelle pour un individu donné varie en fonction des situations d'exposition (lieu d'habitation, modes de vie, tabagisme, etc.) et peut, de ce fait, être inférieure ou très supérieure à cette valeur moyenne. L'exposition artificielle a augmenté durant les dernières décennies, notamment en raison du développement des explorations par TDM.
Les études épidémiologiques ont montré avec certitude que le risque de cancer augmente de manière significative chez les personnes ayant reçu une dose de RI supérieure à 200 mSv. Les RI à forte dose et débit de dose élevé ont un effet cancérogène indubitable, mais relativement faible par rapport aux autres cancérogènes naturels ou artificiels, ce qui rend difficile leur individualisation dans une population donnée, en sachant que le risque de cancer global « vie entière » est actuellement estimé à 25 % dans la population générale. Les effets sur le génome, éventuellement transmissibles à la descendance, ne sont pas établis chez l'être humain et sont probablement négligeables par rapport au nombre d'altérations génétiques spontanées.
Pour les faibles doses, à l'heure actuelle, les effets sur la santé humaine d'une exposition à des doses inférieures à 100 mSv font l'objet de débats scientifiques. C'est d'ailleurs pourquoi cette valeur de 100 mSv a été choisie pour définir schématiquement le domaine des « faibles doses ».
Une relation linéaire décrit convenablement la relation entre la dose et l'effet cancérogène pour les doses supérieures à 200 mSv (suivi des grandes populations irradiées par les bombes atomiques en 1945). Bien que ce risque n'ait été véritablement démontré et accepté par l'ensemble des chercheurs que pour les fortes doses, il est considéré, par principe, que les effets stochastiques peuvent survenir après toute irradiation, même si ce risque n'est véritablement démontré que pour les fortes doses. En radioprotection, pour estimer l'ordre de grandeur du risque encouru par les travailleurs et dans une optique sécuritaire maximale, un modèle volontairement pessimiste, dit de « relation linéaire sans seuil » (RLSS), est utilisé. Il donne la certitude de ne pas sous-estimer ce risque, s'il existe. Cette RLSS constitue un risque plafond utilisé à des fins de radioprotection pour les travailleurs exposés, mais elle ne peut en aucun cas être utilisée pour calculer la probabilité d'induction d'effets stochastiques des faibles doses dans la population générale.
En dehors des procédures de radiologie interventionnelle, les doses délivrées par la plupart des examens radiologiques et de médecine nucléaire excèdent rarement 10 mSv. Les expositions subies par les travailleurs ou les personnes habitant les régions où l'irradiation naturelle est élevée sont également de cet ordre. Le seul risque à prendre en compte en imagerie médicale diagnostique, pour le patient (toujours faibles doses < 100 mSv) et pour le personnel ou le public (très faibles doses < 10 mSv), concerne donc essentiellement le risque aléatoire de cancérogenèse radio-induite, même si ce dernier est actuellement essentiellement théorique.
Mise en œuvre pratique de la radioprotection
L'amélioration continue de la protection radiologique des professionnels et du public a permis de constater ces dernières années que les personnes les plus exposées dans notre société étaient maintenant les patients.
La transposition en droit français des directives européennes, en particulier la dernière en date (directive 2013/59 Euratom) fixant les normes de base relatives à la protection sanitaire contre les dangers liés à l'exposition aux RI, a modifié de façon importante la prise en compte de la radioprotection dans la pratique médicale. Ces modifications portent sur la radioprotection des patients et des personnels, la réglementation de la conception et de l'installation des locaux et des dispositifs utilisant des RI, ainsi que sur les procédures de contrôle de qualité ; il a également été instauré une obligation de formation initiale et continue pour tous les utilisateurs de RI, applicable à tous les médecins, justifiant ce chapitre dans cet ouvrage.
L'usage des RI dans le domaine du diagnostic médical ne peut se voir appliquer de limites réglementaires individuelles pour la dose, car le bénéfice qu'il apporte est très supérieur au risque qu'il peut engendrer, à condition que l'examen soit justifié et d'une qualité suffisante pour le diagnostic, introduisant ainsi les grands principes régissant la radioprotection dans le domaine médical.
Le premier de ces principes, la justification des examens d'imagerie, consiste à établir le bénéfice net d'un examen par rapport au préjudice potentiel lié à l'exposition aux RI. Pour permettre son application, le Code de la Santé Publique stipule « qu'aucun acte exposant aux RI ne peut être pratiqué sans un échange préalable d'information écrit entre le demandeur et le réalisateur de l'acte. Le demandeur fournit au réalisateur les informations nécessaires à la justification de l'exposition demandée dont il dispose. Il précise notamment le motif, la finalité, les circonstances particulières de l'exposition envisagée, notamment l'éventuel état de grossesse, les examens ou actes antérieurement réalisés ». Le Guide du bon usage des examens d'imagerie médicale (gbu.radiologie.fr) édicté par la Société française de radiologie (SFR) et la Société française de médecine nucléaire (SFMN), sous l'égide de l'Autorité de sûreté nucléaire (ASN) et de la Haute autorité de santé (HAS), constitue un document support important pour la mise en œuvre de ce principe. La connaissance des indications des principaux examens d'imagerie en fonction de la situation clinique est fondamentale pour tout médecin. L'application du principe de justification doit également tenir compte d'une possible substitution par un examen non irradiant, telles l'échographie ou l'IRM, en cas de performance diagnostique égale.
Le deuxième principe concerne l'optimisation des pratiques par l'opérateur utilisant les RI. Celle-ci consiste à réaliser un acte irradiant en utilisant la dose la plus faible possible pour une performance diagnostique ou thérapeutique maximale, pour maintenir la dose à un niveau aussi bas que raisonnablement possible selon l'acronyme anglais ALARA (as low as reasonably achievable). L'optimisation s'applique pour l'ensemble des patients et des examens irradiants, en particulier pour les jeunes enfants compte tenu de leur plus grande radiosensibilité. L'application de ce principe passe par l'obligation de maintenance et d'assurance de qualité des matériels, l'obtention d'un diplôme attestant du suivi d'une formation à la radioprotection des patients et la prise en compte des niveaux de référence diagnostique (NRD) ; ces derniers ayant pour but de décrire l'exposition observée pour les examens les plus courants et de permettre à chacun, par comparaison, une évaluation de ses pratiques. Il est obligatoire de stipuler, dans le compte-rendu d'examen d'imagerie, tous les éléments nécessaires à l'évaluation de la dose délivrée au patient : PDS en radiographie standard ou interventionnelle, PDL en TDM en précisant le champ exploré, nature du radiopharmaceutique et activité injectée en médecine nucléaire.
Le troisième principe concerne les personnels professionnellement exposés et fait appel au contrôle et à la limitation des doses reçues. Chaque professionnel doit être conscient de son environnement technique et responsable des personnels qui l'accompagnent. Se protéger est un gage de sérénité autant qu'une obligation réglementaire. La démarche d'optimisation pour le patient bénéficie également directement aux personnels. Sur le plan réglementaire et dans le cadre de la médecine du travail, les personnels exposés aux RI bénéficient d'une réglementation propre aux lieux et conditions de travail ainsi que d'un suivi et d'une catégorisation professionnelle avec une limitation annuelle fixée à 20 mSv en dose efficace annuelle délivrée au corps entier pour la catégorie A et à 6 mSv pour la catégorie B. Dans le cadre de cette catégorisation, la dose maximale au public a été fixée à 1 mSv/an, alors même que l'irradiation naturelle moyenne en France se située entre 2 et 5 mSv. Enfin, nous rappelons que cette limitation de dose ne concerne pas les patients, pour lesquels le bénéfice attendu est très nettement supérieur au risque théorique.
Informations à délivrer aux patients
La population générale a un faible niveau de connaissances concernant les effets des RI et plus généralement les données scientifiques qui y sont rattachées. Dans le cadre du devoir d'information du patient, il faut rappeler qu'en imagerie médicale aucune procédure diagnostique n'atteint 100 mSv, ce qui signifie que ces procédures sont réalisées dans une plage de doses pour laquelle aucun effet déterministe n'est usuellement attendu. L'augmentation « à la marge » de l'incidence de cancers pour une exploration donnée reste très discutée, issue de modèles statistiques présomptifs ou portant sur des données d'études rétrospectives épidémiologiques souvent de type « cas-témoin » d'interprétation parfois difficile.
Il convient avant tout de rassurer les patients et leurs familles en ne faisant pas l'amalgame entre risques réels et risques supposés, et en centrant cette information sur la balance bénéfices (avérés objectifs des RI en médecine)/risques (théoriques des RI aux faibles doses).
La connaissance des doses efficaces moyennes délivrées par tel ou tel examen comme rappelées dans le Guide du bon usage des examens d'imagerie médicale et surtout leur comparaison avec les niveaux d'exposition naturelle annuelle (2,9 mSv en France, variant dans le monde de 1 à 150 mSv – Inde, Iran) permettent de relativiser concrètement l'exposition médicale et son niveau de risque (tableau 6.1).
Tableau 6.1 - Exemples de doses efficaces délivrées
|
Radiographie des poumons |
20 μSv |
|
Vol transatlantique |
50 μSv |
|
Irradiation naturelle moyenne en France/an |
2,9 mSv |
|
Scintigraphie osseuse |
5 mSv |
|
TDM abdominopelvienne |
10 mSv |
|
Limite d'exposition des travailleurs/an |
20 mSv |
|
Seuil au-delà duquel les effets stochastiques sont prouvés |
200 mSv |
|
Seuil de myélotoxicité |
1 Sv |
|
Seuil de toxicité digestive |
5 Sv |
|
Seuil d'apparition des radiodermites |
10 Sv |
|
Seuil de neurotoxicité |
20 Sv |
|
Dose d'une radiothérapie ciblée sur une tumeur |
50 Sv |
Ordres de grandeur de doses efficaces délivrées et seuils de tolérance : ces doses, valables en 2021, varient en fonction des appareils et des réglages et sont susceptibles d'évoluer avec les progrès techniques.
Prendre garde aux unités : μSv, mSv, Sv permettant de prendre de la mesure des « échelles de dose ».
En médecine nucléaire diagnostique, où le patient va émettre lui-même pendant quelque temps de très faibles doses de RI en rapport avec le radiopharmaceutique injecté, aucune mesure d'éviction particulière n'est recommandée pour l'entourage et les sujets contacts, y compris les enfants en bas âge et les femmes enceintes, les doses cumulées étant toujours très inférieures à 1 mSv, et très souvent équivalentes à celles délivrées par l'irradiation naturelle de certaines régions sur quelques jours.
En radiologie interventionnelle, les patients doivent être informés de la nécessité d'un suivi cutané, certaines procédures pouvant délivrer de fortes doses (3 Gy ou plus à la peau).
Enfin, la grossesse constitue un cas particulier tant il apparaît que la relation entre exposition médicale et grossesse est fortement empreinte d'angoisse et de subjectivité. Pourtant, comme pour les autres situations, la présentation objective des risques réels et des effets possibles permet d'éliminer toute forme d'angoisse à ce sujet en centrant le discours sur la balance bénéfices/risques. Il convient de rappeler que les malformations congénitales radio-induites relèvent des effets déterministes à seuil et ne peuvent pas survenir en deçà de 100 mSv, alors que le risque « naturel » de survenue d'une malformation congénitale est de 3 %. Cela n'empêche pas d'appliquer les deux grands principes de radioprotection que sont la justification et l'optimisation, tout particulièrement chez les femmes enceintes ou susceptibles de l'être. La période la plus radiosensible correspond à la phase d'organogenèse (7 à 60 jours de grossesse), pendant laquelle l'irradiation doit être particulièrement minimisée. La recherche préalable d'une éventuelle grossesse avant toute exposition aux RI, chez toute femme en capacité de procréer, est souhaitable par l'interrogatoire, voire par un dosage de la β HCG plasmatique si nécessaire. Une fois l'indication posée, l'optimisation et la connaissance de la dose délivrée permettent de donner à la patiente une information objective et rassurante.
Conclusion
Le champ de la radioprotection, qui n'incluait à l'origine que les travailleurs, s'est élargi au public puis aux personnes exposées pour raison médicale. Son concept global est exprimé de la manière suivante : assurer un niveau de protection adéquate pour l'homme, sans pénaliser indûment les pratiques bénéfiques exposant aux rayonnements ionisants (RI). Les mesures de protection ne doivent donc pas être disproportionnées par rapport au risque, ni limiter inutilement les activités bénéfiques pour l'individu ou la société. La radioprotection est constituée d'un ensemble d'éléments, scientifiques et objectifs, associant physique, biologie, réglementation et, avant tout, un certain état d'esprit, c'est-à-dire une préoccupation permanente associée à l'activité professionnelle. Cette préoccupation repose essentiellement sur des principes de justification des examens, d'optimisation des pratiques, notamment lorsque l'on a affaire à des femmes enceintes et des enfants en bas âge. Elle intègre une connaissance des bases élémentaires de physique et de radiobiologie permettant de relativiser le risque encouru, notamment en imagerie médicale diagnostique exposant le patient à de faibles doses de rayonnements, a fortiori les professionnels et l'entourage (pour l'imagerie nucléaire) à de très faibles doses. En effet, aux doses telles que celles délivrées par un seul examen d'imagerie médicale standard, aucun effet déterministe ne peut survenir et le risque stochastique de cancer radio-induit est infinitésimal, essentiellement spéculatif. La répétition et le cumul des explorations dans un intervalle de temps court ne doivent toutefois pas être négligés, la justification de chaque acte restant la pierre angulaire de la démarche médicale.
Essentiel à retenir
- La connaissance des différentes unités Bq, Gy, Sv et de leur utilisation respective est essentielle.
- Les effets biologiques se divisent en effets déterministes (radiologie interventionnelle, radiothérapie) et en effets stochastiques (carcinogenèse à long terme).
- Les doses délivrées en imagerie diagnostique font partie des faibles doses, inférieures à 100 mSv, sans détriment sanitaire observé.
- Les principes de radioprotection reposent en médecine sur la balance bénéfique/risque, déterminant la justification des actes, puis sur l'optimisation des pratiques.
- L'information du patient est essentielle afin de lever toute angoisse inutile.
- L'enfant et la femme enceinte doivent faire l'objet d'une attention particulière.
- La radioprotection en milieu médical concerne également le personnel exposé.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 5 - Médecine nucléaire
V. Lebon
Plan du chapitre
- Introduction
- Médicaments radiopharmaceutiques (MRP)
- Instrumentation
Objectifs
- Comprendre les spécificités de l'imagerie scintigraphique par rapport aux autres techniques d'imagerie.
- Comprendre la constitution d'un médicament radiopharmaceutique (MRP), en connaître les principales caractéristiques.
- Savoir quels sont les MRP les plus couramment utilisés en scintigraphie conventionnelle et en tomographie par émission de positons (TEP).
- Comprendre le principe de détection des photons γ par des cristaux scintillants couplés à des photomultiplicateurs.
- Comprendre le principe de localisation par collimation des gamma-caméras.
- Comprendre le principe de localisation par détection en coïncidence des caméras TEP.
- Connaître les principaux points communs et les différences entre une gamma-caméra et une caméra TEP.
Introduction
La médecine nucléaire regroupe l'ensemble des applications médicales reposant sur l'administration au patient d'une substance radioactive en source non scellée. Elle comprend des applications diagnostiques, principalement par imagerie et des applications thérapeutiques (radiothérapie interne vectorisée - voir chapitre 16).
Les images acquises en médecine nucléaire, en localisant un médicament radiopharmaceutique (MRP) préalablement administré au patient, sont le reflet de l'activité moléculaire, métabolique et fonctionnelle spécifique à certaines lésions ou structures de l'organisme. Les radionucléides le plus souvent utilisés sont émetteurs de photons gamma (γ). Ces photons traversent l'organisme en interagissant peu avec les tissus avant d'être détectés à l'extérieur du patient. La détection reposant sur un phénomène de scintillation, on parle de scintigraphie pour désigner l'imagerie effectuée en médecine nucléaire. On peut aussi utiliser des émetteurs β+ qui donnent secondairement naissance à des photons γ.
La scintigraphie appartient aux techniques d'imagerie d'émission (les photons sont émis par le patient), par opposition à l'imagerie de transmission dans laquelle les photons transmis sont ceux qui n'ont pas été absorbés par le patient et qui vont permettre de réaliser les images, rendant ainsi compte de la densité des milieux traversés. Il s'agit là des techniques de radiologie conventionnelle ou de la tomodensitométrie, plus communément appelée scanner.
En comparaison avec les images radiologiques, les images scintigraphiques ont une qualité morphologique médiocre, d'une part, car le MRP s'accumule spécifiquement sur certaines structures, si bien que la plupart des organes restent invisibles à la scintigraphie, d'autre part, car la résolution spatiale en médecine nucléaire est moins bonne qu'en radiologie. L'intérêt de l'imagerie scintigraphique tient à son caractère moléculaire, métabolique et fonctionnel ; elle apporte une information spécifique du MRP administré au patient. Pour illustrer cette particularité de la médecine nucléaire, il suffit de se représenter les images qu'on obtiendrait chez un patient en arrêt cardiorespiratoire : quel que soit le MRP utilisé, on obtiendrait une scintigraphie « blanche » correspondant à l'absence de signal.
Ce chapitre présente tout d'abord une description des MRP utilisés en médecine nucléaire. Les caractéristiques de ces molécules sont décrites et les principaux MRP utilisés pour l'imagerie sont présentés. L'utilisation de MRP pour la thérapie est également évoquée. La seconde partie de ce chapitre est consacrée à l'instrumentation en médecine nucléaire. Elle explique comment les rayonnements émis par les MRP sont détectés et localisés par les deux types de caméras utilisées en médecine nucléaire : les gamma-caméras et les caméras TEP.
Médicaments radiopharmaceutiques (MRP)
Généralités
L'imagerie scintigraphique repose sur l'administration d'un MRP, composé d'une très faible quantité de matière d'un principe actif (quantité nettement inférieure à la nanomole, le principe actif ne perturbant donc pas le métabolisme de l'organisme), dont le comportement ou la distribution dans l'organisme est similaire à une substance endogène (la substance tracée), marqué par un radionucléide artificiel (ce qui permet de le détecter).
Lorsque le MRP s'accumule localement, on parle d'hyperfixation (ou d'hypofixation lorsqu'il y a défaut d'accumulation). La terminologie d'hyper- et d'hypofixation est couramment utilisée en médecine nucléaire, même si elle ne correspond pas toujours à l'établissement d'une liaison irréversible : le MRP peut également être métabolisé ou transiter par un espace du corps (appelé compartiment).
La combinaison principe actif/radionucléide peut être déclinée pour explorer un grand nombre d'aspects du fonctionnement d'un même organe, ce qui explique la très grande diversité des examens de médecine nucléaire. On peut citer l'exemple du cerveau pour lequel la médecine nucléaire offre des molécules permettant de visualiser la perfusion cérébrale, le métabolisme glucidique, le métabolisme des acides aminés, la neurotransmission dopaminergique ou encore la concentration de plaques amyloïdes (voir chapitre 23).
Si la majorité des MRP sont utilisés à visée diagnostique (imagerie), certains sont utilisés en thérapie pour irradier des tissus ou des cellules pathologiques (voir chapitre 16).
Critères de choix du MRP pour l'imagerie
Le MRP est constitué d'un radionucléide lié à un vecteur (figure 5.1). La fonction du radionucléide est d'émettre un rayonnement détectable à l'extérieur du patient ; celle du vecteur est de se fixer sur une structure particulière de l'organisme qui peut être un organe ou tissu, un compartiment (espace de l'organisme comme le sang) ou une lésion. Pour l'imagerie, le MRP « idéal » doit posséder les trois caractéristiques suivantes : il doit pouvoir être suivi dans le temps, se comporter comme la substance tracée et il ne doit pas perturber le système dans lequel il est introduit.
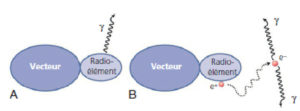
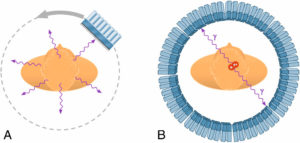
Les MRP utilisés en médecine nucléaire sont constitués d'un radionucléide lié à un vecteur : la scintigraphie conventionnelle utilise des émetteurs γ (A), la TEP utilise des émetteurs de positons qui s'annihilent avec un électron pour émettre une paire de photons γ (B).
Dessin : Cyrille Martinet.
Propriétés physiques du radionucléide
La médecine nucléaire propose deux techniques d'imagerie : la scintigraphie dite « conventionnelle » et la TEP.
La scintigraphie conventionnelle détecte les MRP émetteurs de photons gamma (γ). Les photons γ sont produits suite à la désintégration de certains noyaux atomiques. Comme les photons X, ils sont une forme de rayonnement électromagnétique mais en diffèrent par leur origine : les X viennent du réarrangement du cortège électronique des atomes, tandis que les γ viennent des transformations radioactives des noyaux ; ils présentent généralement une énergie plus élevée que celle des X (> 100 keV). Ces photons ont ainsi une faible probabilité d'interaction avec la matière et sont peu irradiants pour le patient. En revanche, du fait de leur masse, les rayonnements particulaires, du type β– ont une probabilité d'interaction forte et sont donc irradiants. En outre, les électrons ont un parcours trop limité dans les tissus pour être détectés en externe. Aussi, pour la scintigraphie conventionnelle et pour des raisons de radioprotection, il faut éviter d'utiliser des émetteurs γ associés à l'émission d'électrons (désintégration β–).
La TEP utilise, quant à elle, des MRP émetteurs de positons (désintégration β+). Les positons sont des électrons chargés positivement ; ils ne sont pas détectables en externe car ils s'annihilent avec un électron à proximité de leur site d'émission. Mais cette annihilation donne naissance à une paire de photons γ d'énergie 511 keV (ce qui correspond à l'équivalent énergétique de la masse d'un électron ou d'un positon) émis à l'opposé l'un de l'autre, qui sont détectés en TEP.
Les deux techniques d'imagerie de la médecine nucléaire diffèrent donc par la nature des radionucléides qu'elles utilisent. Les principaux critères de choix de ces radionucléides sont néanmoins communs aux deux techniques :
- le radionucléide doit posséder une période suffisamment courte pour limiter la durée d'exposition du patient. Elle doit cependant être suffisamment longue pour permettre la préparation du MRP, son administration au patient, sa répartition dans l'organisme via un processus métabolique parfois lent, puis l'acquisition des images. Une période de quelques heures à quelques jours est adaptée à la médecine nucléaire ;
- l'efficacité de marquage du vecteur par le radionucléide est un critère essentiel, ce marquage étant généralement réalisé juste avant l'administration au patient ;
- la facilité d'approvisionnement en radionucléide doit être prise en compte. Elle dépend du mode de production du radionucléide (réacteur nucléaire, cyclotron ou générateur) et de sa période radioactive.
Propriétés biochimiques du vecteur
Le vecteur utilisé en médecine nucléaire peut être de nature très variée. Il peut s'agir du radionucléide lui-même, comme l'iode (123I ou 131I), qui est capté directement par la thyroïde, ou le thallium (201Tl), qui présente la même cinétique de fixation myocardique que le potassium.
Le vecteur peut être une molécule plus complexe dont on veut mesurer le métabolisme ou la distribution dans l'organisme. Il peut s'agir d'un substrat énergétique (analogue du glucose 18F-FDG), d'un ligand (ligand des transporteurs dopaminergiques 123I-ioflupane), voire d'un élément figuré du sang (hématies marquées au 99mTc).
La stabilité de la liaison vecteur/radionucléide est un critère important pour le choix du vecteur. Il faut également s'assurer que la présence du radionucléide ne perturbe pas significativement le comportement biologique du vecteur. Ces critères de stabilité et de comportement biologiques du vecteur dépendent principalement de la nature métallique ou non des radionucléides :
- le marquage d'un vecteur par un radionucléide métallique (99mTc, 111In, 68Ga) nécessite un grand nombre de liaisons vecteur/métal. En effet, les vecteurs sont des molécules organiques qui se lient difficilement avec les atomes métalliques : la liaison métal/molécule organique est intrinsèquement faible, si bien qu'une liaison unique serait trop instable. La fixation se fait via un complexe de plusieurs liaisons formant une pince – appelée chélate2 – autour du radionucléide métallique. L'inconvénient principal de cette chimie de chélation tient à l'encombrement du site de liaison vecteur/radionucléide. Le choix du chélate est le résultat d'un compromis entre la stabilité de la liaison vecteur/métal et son encombrement : plus le complexe contient un nombre élevé de liaisons, plus le MRP est stable, mais plus son encombrement perturbe le comportement biologique du vecteur ;
- pour les radionucléides non métalliques (123I, 131I, 18F, 11C), le marquage repose sur la chimie de l'élément considéré (carbone, iode, etc.) : une simple liaison covalente suffit à synthétiser un MRP stable dont le comportement biologique est peu modifié par le radionucléide.
Principaux MRP utilisés en scintigraphie conventionnelle
Le tableau 5.1 présente les principaux MRP (radionucléides et vecteurs) utilisés en scintigraphie conventionnelle et les fonctions physiologiques ou les tissus explorés par ces radiopharmaceutiques.
Tableau 5.1 - Radiopharmaceutiques les plus utilisés en scintigraphie conventionnelle
|
Radiopharmaceutique |
Fonction/tissu explorés |
|||
|
Radionucléide |
Vecteur |
|||
|
Isotope |
Énergie |
Période |
||
|
Technétium 99mTc |
140 keV |
6,0 h |
HMDP |
Accrétion osseuse (ostéoblastes) |
|
Sestamibi Tétrofosmine |
Perfusion myocardique, parathyroïdes |
|||
|
Hématies |
Fraction d'éjection ventriculaire Recherche d'hémorragie |
|||
|
Pertechnétate (TcO4−) |
Fonction thyroïdienne |
|||
|
HMPAO |
Perfusion cérébrale |
|||
|
Acide iminodiacétique (IDA) |
Fonction hépatobiliaire |
|||
|
Macro-agrégats d'albumine |
Perfusion pulmonaire |
|||
|
Microparticules de carbone (Technegas®) |
Ventilation pulmonaire |
|||
|
Acide dimercaptosuccinique (DMSA) |
Masse rénale fonctionnelle |
|||
|
DTPA |
Filtration rénale |
|||
|
MAG3®, Nephromag® |
Perfusion rénale, sécrétion, drainage urinaire |
|||
|
Leucocytes marqués à l'hexaméthyl propylène amine oxime (HMPAO) |
||||
|
Thallium 201Tl |
69 keV, 71 keV, 80 keV |
3,1 j |
– |
Perfusion myocardique |
|
Krypton(81mKr) |
190 keV |
13 s |
– |
Ventilation pulmonaire |
|
Iode 123I |
159 keV |
13 h |
– |
Fonction thyroïdienne |
|
Ioflupane |
Ioflupane |
|||
|
MIBG |
Médullosurrénale (phéochromocytome, neuroblastome) |
|||
|
131I |
364 keV |
8 j |
Noriodocholestérol |
Corticosurrénale |
|
Indium(111In) |
171 keV, 245 keV |
2,8 j |
Pentétréotide |
Récepteurs à la somatostatine (tumeur neuroendocrine) |
Pour chaque radionucléide, le tableau ne mentionne que l'énergie du ou des rayonnements γ utilisés pour la détection scintigraphique. Il faut savoir que les radionucléides ne se désintègrent presque jamais selon une transition unique vers leur état stable : leur désintégration s'effectue selon un schéma complexe impliquant de nombreux intermédiaires et de nombreuses émissions γ d'énergies différentes. La scintigraphie ne détecte que les émissions les plus abondantes dont l'énergie est adaptée à la sensibilité des détecteurs (entre 70 et 360 keV).
Le radionucléide de loin le plus utilisé en scintigraphie conventionnelle est le 99mTc métastable. Sa désintégration est associée à l'émission très majoritaire de photons γ de 140 keV (énergie bien adaptée aux gamma-caméras) ; sa période est de 6 heures. Il peut être utilisé en solution directe ou pour marquer différents vecteurs, préconditionnés pour le radiomarquage sous forme de précurseurs dans des flacons (appelés « trousses » ou « kits ») ; enfin, il ne pose pas de problème d'approvisionnement puisqu'il est produit dans le service de médecine nucléaire à partir d'un générateur qui doit être renouvelé toutes les semaines.
Les MRP utilisant d'autres radionucléides que le 99mTc doivent être livrés quotidiennement (à l'exception du 81mKr, produit sur place par un générateur). Comme le montre le tableau 5.1, certains examens peuvent être effectués au moyen de différents MRP. C'est le cas de l'évaluation de la perfusion myocardique (visualisée après injection de 201Tl ou de 99mTc-sestamibi) ou de la fonction thyroïdienne (visualisée après injection d'123I ou de 99mTcO4–). Les MRP technétiés sont en général plus disponibles et moins coûteux que leurs équivalents non métalliques, mais ils ont tendance à être un peu moins spécifiques de la fonction étudiée.
Principaux MRP utilisés en TEP
Généralités
La désintégration β+ se traduit par l'émission de deux photons γ de 511 keV chacun, quel que soit le radionucléide. Cette énergie correspond en effet à l'énergie d'annihilation entre un positon et un électron, grandeur indépendante du radionucléide. Les principaux radionucléides utilisables en TEP (18F, 11C, 15O et 13N) ont des périodes courtes, inférieures à 20 minutes pour le 11C, 15O et le 13N (tableau 5.2) ; ils ne peuvent donc être réalisés que dans les rares centres de recherche produisant ces nucléides sur place au moyen d'un cyclotron. Seul le 18F possède une période de 110 minutes compatible avec une utilisation en routine clinique. Cela nécessite de livrer le service de médecine nucléaire plusieurs fois par jour en MRP marqués au 18F. Le tableau 5.3 présente les MRP couramment utilisés en TEP.
Tableau 5.2 - Période des principaux radionucléides utilisables en TEP
|
Radionucléide |
Période |
|
18F |
110 min |
|
68Ga |
68 min |
|
82Rb |
75 s |
|
11C |
20 min |
|
13N |
10 min |
|
15O |
2 min |
Tableau 5.3 - Radiopharmaceutiques les plus utilisés en TEP
|
Radiopharmaceutique |
Fonction explorée |
|
18F-FDG (fluorodésoxyglucose) |
Métabolisme glucidique |
|
18F-FCH (fluorocholine) |
Métabolisme lipidique membranaire |
|
18F-(fluorure ou FNa) |
Accrétion osseuse |
|
18F-FDOPA |
Métabolisme des acides aminés Neurotransmission dopaminergique |
Intérêt du 18F-FDG
Le radiopharmaceutique de loin le plus utilisé est un analogue du glucose : le 18F-FDG. Il diffère du glucose par la substitution d'un groupe hydroxyle par un 18F. Le 18F-FDG est transporté vers le milieu intracellulaire par les transporteurs membranaires du glucose (GLUT). Il est phosphorylé en 18F-FDG-6-P par l'hexokinase comme le glucose (première étape de la glycolyse). À la différence du glucose, le 18F-FDG n'est pas davantage transformé car la présence du 18F empêche le 18F-FDG-6-P d'intégrer la deuxième étape de la glycolyse (isomérisation en fructose-6P). Le MRP s'accumule ainsi dans les cellules sous forme de 18F-FDG-6-P, sa concentration reflétant le métabolisme glucidique. Le succès de la TEP au 18F-FDG tient à sa grande sensibilité pour la détection de nombreux cancers et de certaines maladies inflammatoires ou infectieuses. Ces maladies sont en effet caractérisées par un métabolisme glucidique souvent très élevé.
Fixations physiologiques du 18F-FDG
L'avidité pour le 18F-FDG n'est toutefois pas spécifique des processus pathologiques : de nombreux tissus accumulent physiologiquement ce MRP. Ainsi, le 18F-FDG se concentre fortement au niveau cérébral, le glucose étant le principal substrat énergétique neuronal. Le tissu lymphoïde de l'anneau tonsillaire du pharynx (anciennement anneau de Waldeyer : tonsilles pharyngées, tubaires, palatines et linguales) est fréquemment hyperfixant, surtout chez l'enfant et au décours de processus infectieux ; cette fixation est d'intensité variable mais bilatérale et globalement symétrique. Il existe une très faible excrétion salivaire du traceur 18F-FDG, entraînant une fixation diffuse des glandes parotides, submandibulaires et sublinguales ; cette fixation est peu intense, bilatérale et symétrique. Les hyperfixations dites « de réactivation de graisse brune » sont fréquentes chez l'adulte jeune. Elles sont liées en général au froid et au stress ; elles sont souvent très intenses, bilatérales, symétriques, et intéressent les espaces graisseux cervicaux et thoraciques. Une hyperfixation diffuse en regard du reliquat thymique du médiastin antérieur est fréquente chez l'enfant et le sujet jeune. Elle peut également se voir chez l'adulte au décours d'un traitement par chimiothérapie. La fixation myocardique peut être intense, mais elle est très variable et dépend du régime alimentaire du patient. Le 18F-FDG peut également s'accumuler dans l'intestin grêle en conditions physiologiques normales. Le côlon présente plus fréquemment une accumulation intense de topographie très variable (diffuse ou plus segmentaire). Les ovaires et l'utérus des femmes non ménopausées présentent parfois un hypermétabolisme glucidique, qui varie selon les phases du cycle menstruel. La fixation musculaire est variable et dépend du degré d'activité des muscles, en particulier en cas d'effort ou de tension musculaire accrue pendant la période suivant l'injection. Enfin, contrairement au glucose, le 18F-FDG n'est pas réabsorbé par le tubule rénal ; il est ainsi éliminé par voie urinaire et s'accumule dans les cavités pyélocalicielles, les uretères et la vessie.
MRP pour la thérapie
La médecine nucléaire comprend également des applications thérapeutiques qui consistent à administrer des MRP fortement irradiants pour détruire un tissu cible. Il s'agit de la radiothérapie interne vectorisée (RIV) (voir chapitre 16). Les critères de choix du radionucléide sont différents des critères retenus pour l'imagerie diagnostique : pour la RIV, on utilise classiquement des émetteurs β– dont la désintégration s'accompagne de l'émission d'un électron. Contrairement aux photons γ, les électrons interagissent fortement avec les tissus biologiques et ne parcourent que quelques millimètres avant de céder leur énergie au tissu. Ce principe est couramment mis en œuvre pour le traitement des hyperthyroïdies ou des cancers différenciés de la thyroïde. Le MRP utilisé est alors l'131I. À noter que la désintégration de l'131I se traduit par une émission β– et une émission γ associée, cette dernière étant mise à profit pour acquérir des images au décours du traitement des cancers thyroïdiens.
Évolutions récentes
La TEP est une technique d'imagerie relativement récente pour laquelle de nombreux MRP ont été récemment développés.
Pour la cancérologie, on peut citer les analogues de la somatostatine (de type pentétréotide) marqués au gallium 68 (68Ga), l'avantage du 68Ga étant qu'il peut être produit dans le service de médecine nucléaire à partir d'un générateur dont la durée de vie est de plusieurs mois. Le 68Ga-DOTATATE a ainsi démontré son efficacité pour la détection des tumeurs neuroendocrines intestinales. Les ligands du prostate-specific membrane antigen (PSMA) sont une autre piste prometteuse en oncologie. Ces ligands peuvent être marqués au 68Ga ou au 18F. Ils présentent une excellente spécificité pour les adénocarcinomes prostatiques.
En neurologie, des autorisations de mise sur le marché (AMM) ont été accordées récemment pour les ligands de la plaque amyloïde marqués au 18F (18F-PIB, 18F-AV45 ou 18F-AV1). Ces MRP peuvent être utiles pour le diagnostic de certaines formes de la maladie d'Alzheimer.
En cardiologie, la TEP au rubidium 82 (82Rb), analogue du potassium, fournit des images quantitatives de la perfusion myocardique de meilleure résolution spatiale que la tomoscintigraphie des gamma-caméras conventionnelles. Le 82Rb présente l'avantage de pouvoir être produit dans le service par un générateur, tout comme le 68Ga.
Sur le versant thérapeutique, la RIV fait également l'objet de nombreux travaux de recherche. On peut citer le développement d'émetteurs α (noyaux d'hélium) qui interagissent plus fortement que les particules β– avec les tissus biologiques ; ils libèrent leur énergie en quelques dizaines de micromètres seulement. On passe ainsi d'une radiothérapie tissulaire à une radiothérapie cellulaire. La RIV avec émetteur α a été récemment proposée pour le traitement des métastases osseuses des adénocarcinomes prostatiques. Le MRP utilisé est le 223Ra, dont le comportement biologique est analogue à celui du calcium.
Ces dernières années, la RIV a connu des développements spectaculaires fondés sur l'utilisation du lutécium 177 (émetteur β–). Le 177Lu-DOTATATE, ligand des récepteurs de la somatostatine, a obtenu l'AMM pour le traitement des tumeurs neuroendocrines intestinales métastatiques. En outre, des essais cliniques prometteurs sont en cours sur le 177Lu-PSMA dans le traitement des cancers de la prostate résistants à la castration.
L'utilisation de MRP émettant à la fois des β– ou des α (utilisés pour la thérapie) et des γ ou β+ (utilisés pour l'imagerie) est à l'origine du concept de « théranostique », contraction de thérapie-diagnostique : en injectant un MRP diagnostique, on peut prédire de manière quantifiée la biodistribution du MRP thérapeutique et donc mieux planifier l'irradiation. Le couple 68Ga-DOTATATE/177Lu-DOTATATE permet ainsi une approche théranostique des tumeurs neuroendocrines métastatiques.
Instrumentation
La scintigraphie conventionnelle est réalisée au moyen d'une gamma-caméra et la TEP au moyen d'une caméra TEP. Ces appareils sont deux variantes de caméras à scintillation ; ils partagent les mêmes principes de détection des photons γ, mais ils reposent sur deux principes différents de localisation du MRP émetteur :
- la gamma-caméra localise l'émetteur γ par un principe de collimation qui consiste à détecter uniquement les photons γ émis dans une direction particulière ;
- en TEP, la localisation repose sur la détection des deux photons γ émis à 180° l'un de l'autre après annihilation du positon, sans besoin de collimateurs.
Détection des photons γ
Interaction avec le cristal scintillant
Les photons γ sont faiblement atténués par les tissus biologiques. Leur détection externe est effectuée au moyen d'un cristal dense constitué d'atomes très massiques qui absorbe leur énergie. L'utilisation de cristaux scintillants permet de convertir l'énergie cédée par les photons γ en photons visibles. L'énergie des γ est cédée aux électrons du cristal qui quittent alors leur orbite ; le retour à l'état fondamental des électrons se traduit par un phénomène de scintillation, c'est-à-dire par l'émission de multiples photons dont l'énergie est beaucoup plus faible que celle du photon γ incident, mais dont la longueur d'onde est dans le domaine du visible (photons lumineux), et pour lesquels le cristal est transparent. La détection de chaque photon γ entraîne l'émission de 103 à 104 photons lumineux (figure 5.2) qui vont traverser le cristal sans interagir.
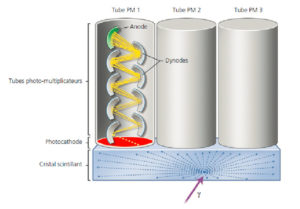
Détection des photons γ par un cristal scintillant couplé à des tubes PM.
L'interaction d'un photon γ avec le cristal se traduit par l'émission de 103 à 104 photons lumineux (flèches bleues) qui traversent le cristal sans interagir avec lui. Le principe du tube PM est illustré pour le tube PM1. Sous l'impact d'un photon lumineux, la photocathode (rouge) libère un électron (flèche jaune) qui est ensuite accéléré par la différence de potentiel photocathode/dynode et vient frapper la première dynode. Chaque électron incident arrache plusieurs électrons secondaires à la dynode, qui sont à leur tour accélérés puis démultipliés sur une dizaine de dynodes successives avant de frapper l'anode (vert).
Dessin : Cyrille Martinet.
Photomultiplication
L'étape suivante consiste à transformer les photons lumineux en un signal électrique et à l'amplifier suffisamment pour qu'il puisse être mesuré sous forme d'une tension électrique. C'est le rôle du tube photomultiplicateur (PM) constitué d'une photocathode (face d'entrée des photons lumineux), d'une série de dynodes (électrodes portées à des potentiels croissants) et d'une anode (figure 5.2). Sous l'impact des photons lumineux, la photocathode libère des électrons qui sont ensuite accélérés par la différence de potentiel photocathode/dynode et viennent frapper la première dynode. Chaque électron incident arrache plusieurs électrons secondaires à la dynode, qui sont à leur tour accélérés puis démultipliés sur une dizaine de dynodes successives avant de frapper l'anode. Les démultiplications successives se traduisent par un gain d'amplification considérable, de l'ordre de 109, conduisant à un signal mesurable sous la forme d'une impulsion électrique.
À noter que le nombre d'électrons frappant l'anode est proportionnel au nombre de photons lumineux en entrée du PM, lui-même proportionnel à l'énergie du photon γ détecté. Ainsi, ces étapes de détection conservent la proportionnalité entre l'énergie du photon γ et l'amplitude du signal (impulsion de tension à l'anode).
Sélection par l'énergie
Pour un MRP dont la désintégration entraîne une émission γ d'énergie donnée, on pourrait s'attendre à mesurer des impulsions de tension d'amplitudes identiques. Ce serait le cas si les photons γ n'interagissaient pas avec les tissus biologiques. Or, une partie des photons γ interagit avec la matière organique, principalement sous forme de diffusion Compton. Au cours de cette interaction, le photon γ d'origine disparaît au profit d'un nouveau photon γ (le photon diffusé) qui est émis dans une direction différente de celle du γ d'origine et possède une énergie plus faible. En scintigraphie conventionnelle comme en TEP, les photons diffusés peuvent représenter une part importante – parfois majoritaire – des photons détectés. L'interaction Compton pouvant se dérouler à distance du site d'émission du photon γ d'origine, la détection des photons diffusés est source d'erreur de localisation du MRP. Il convient donc d'éliminer du comptage le signal issu des photons diffusés. Pour ce faire, il suffit de conserver uniquement les impulsions dont l'amplitude correspond à l'énergie des photons émis par le MRP. On effectue ainsi une sélection par l'énergie. Outre qu'elle permet de s'affranchir des erreurs de localisation liées à la diffusion Compton, cette méthode de sélection par l'énergie permet de détecter simultanément les photons γ issus de deux radionucléides différents administrés à un patient. Cette technique de double marquage permet ainsi de suivre simultanément deux processus physiologiques. On peut citer l'exemple de la ventilation pulmonaire mesurée par du 81mKr (190 keV) et de la perfusion pulmonaire mesurée par des agrégats d'albumine marqués au 99mTc (140 keV).
Localisation de l'impact du photon γ sur le cristal
L'absorption d'un photon gamma sur le cristal entraîne l'émission de 103 à 104 photons lumineux dans des directions aléatoires. Pour localiser ce point d'impact, on utilise la logique d'Anger, du nom de l'inventeur de la gamma-caméra. Cette approche consiste à « tapisser » la surface du cristal d'une batterie de PM. Le nombre de photons lumineux captés par un PM est inversement proportionnel à la distance entre le PM considéré et le point d'impact du photon γ. La détection d'un photon γ est donc associée à la réception par plusieurs PM d'impulsions électriques dont les amplitudes respectives permettront de remonter au lieu exact de l'impact. La figure 5.2 illustre cette logique de localisation : le tube PM2 reçoit davantage de photons lumineux que le tube PM3 qui en reçoit davantage encore que le PM1. La comparaison entre les nombres de photons lumineux détectés par chaque PM permet de déterminer la position du point d'impact sur le cristal. À noter que la répartition des photons scintillants sur plusieurs PM n'entraîne pas la perte de l'information sur l'énergie du photon γ détecté. Il suffit pour recouvrer cette information de sommer les impulsions de tension générées par tous les PM à un instant donné. On arrive ainsi à localiser le point d'impact tout en gardant la possibilité de faire une sélection par l'énergie.
Types d'enregistrement des données
Les coordonnées du point d'impact du photon γ sont transformées en une position numérique traitée informatiquement pour former l'image. Au cours de l'examen d'imagerie, le nombre d'impacts photoniques peut être considérable (plusieurs millions). Ces données peuvent être stockées de plusieurs manières, selon la capacité de stockage de l'imageur et la résolution temporelle souhaitée :
- le mode intégratif (ou incrémental) consiste à sommer les impacts successifs détectés pour chaque adresse numérique ;
- le mode liste consiste à enregistrer, pour tous les photons γ détectés, leur temps d'impact et leur position. Les images ne sont disponibles qu'à la fin de l'acquisition, mais on peut choisir a posteriori le temps d'accumulation des images. Par exemple, une acquisition de 2 minutes pourra être reconstruite sous la forme de 20 images d'une minute ou d'une image de 20 minutes ;
- le mode liste peut être combiné avec l'enregistrement indépendant d'un mouvement physiologique périodique comme le cycle cardiaque. Cela permet de synchroniser a posteriori le signal d'imagerie (constitué des impacts photoniques) et le signal physiologique. On peut alors reconstruire séparément les images correspondant à différentes phases du cycle. Ce mode d'acquisition synchronisé est couramment utilisé en médecine nucléaire cardiologique ;
- il est également possible d'acquérir des images à divers temps après l'injection (par exemple 5 minutes, 3 heures, 24 heures) pour apprécier l'évolution de la distribution du MRP.
L'enregistrement des points d'impact des photons γ tel que décrit ci-dessus ne suffit pas à déterminer la position spatiale du MRP. Pour ce faire, il faut utiliser un système de collimation. C'est sur ce point que les gamma-caméras et les caméras TEP diffèrent fondamentalement, la scintigraphie conventionnelle utilisant une collimation physique tandis que la TEP utilise une collimation électronique.
Gamma-caméra
Collimation physique
En l'absence de collimation, les photons γ seraient détectés de façon identique quelle que soit l'incidence avec laquelle ils atteignent le cristal. Ainsi, la seule connaissance de leur point d'impact ne permettrait pas de déterminer leur origine, et donc de localiser leur source.
Les collimateurs des gamma-caméras sont des plaques de plomb percées de canaux séparés par des cloisons, les septums (figure 5.3). Les collimateurs à canaux parallèles, orientés perpendiculairement à la surface du cristal, sont les plus utilisés. Ils permettent de détecter uniquement les photons ayant une incidence perpendiculaire au cristal, les photons obliques étant arrêtés par les septums de plomb. Le point d'impact du photon γ dans le cristal correspond ainsi à la position spatiale du MRP ; le collimateur à canaux parallèles fournit une image en projection de la distribution du MRP.
D'autres géométries de collimateurs peuvent être utilisées, comme le collimateur sténopé (pinhole en anglais) qui se présente sous la forme d'un cône de plomb percé à son sommet (figure 5.3). Il permet une excellente résolution spatiale par effet de grandissement, aux dépens d'une sensibilité médiocre liée à la petite taille du trou. Il est principalement utilisé pour la scintigraphie de la thyroïde, organe de petite taille.
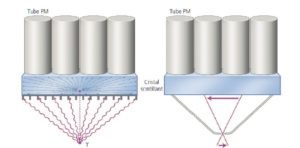
Collimateurs parallèle (gauche) et sténopé (droite) installés devant le cristal plan d'une gamma-caméra.
Dessin : Cyrille Martinet.
Détecteurs plans de grande dimension
La plupart des gamma-caméras actuelles sont constituées de deux détecteurs plans de grande taille mesurant typiquement 40 × 60 cm2 (figure 5.4A). Chaque détecteur est constitué d'une dalle de cristal d'iodure de sodium dopé au thallium NaI(Tl) d'environ 2 cm d'épaisseur couplée à une centaine de PM. Le NaI est suffisamment dense et de nombre de masse suffisamment élevé pour qu'une épaisseur de 2 cm interagisse efficacement avec les photons γ. L'efficacité d'interaction varie cependant avec l'énergie des photons γ : elle est plus élevée pour les photons peu énergétiques comme ceux émis par le 201Tl (80 keV) que pour ceux émis par l'131I (364 keV).
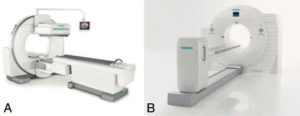
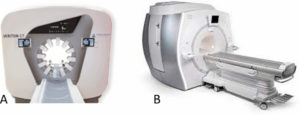
Gamma-caméra (A) et caméra TEP (B).
Source : avec l'aimable autorisation de la société Siemens.
Les deux détecteurs sont montés sur un statif, dispositif permettant leur rotation autour du patient pour un positionnement adapté à chaque type d'examen.
Résolution spatiale et sensibilité
La résolution spatiale d'une gamma-caméra dépend principalement de la géométrie du collimateur (épaisseur des septums, diamètre et profondeur des canaux). Cette géométrie est le fruit d'un compromis entre résolution spatiale et sensibilité : des canaux très étroits séparés par des septums épais améliorent la résolution spatiale aux dépens du nombre de coups détecté par canal.
Ce compromis n'est pas le même pour des photons γ incidents de basse et de haute énergie, si bien qu'une gamma-caméra dispose en général de plusieurs collimateurs adaptés aux différents niveaux d'énergie des radionucléides utilisés.
Quelle que soit la géométrie du collimateur, son rôle est d'arrêter tous les photons γ qui ne sont pas émis dans la direction souhaitée, si bien qu'une très faible fraction des photons émis – de l'ordre de 1/10 000 – atteint le cristal. Cette faible sensibilité de détection limite la résolution spatiale des gamma-caméras à environ 10 mm.
Images planaires
La détection avec collimation physique fournit une projection de la distribution du MRP sur le plan du détecteur. Cette image planaire peut être acquise de manière statique, dynamique ou par balayage.
Pour une acquisition statique, les détecteurs sont placés en regard de la région du corps à explorer et conservent une position fixe pendant la durée de l'acquisition, typiquement une dizaine de minutes.
L'acquisition dynamique procède de la même manière, à cela près que plusieurs images sont acquises successivement en mode cinéma, ou à différents instants après l'administration du MRP. On peut citer l'exemple de la scintigraphie rénale qui permet l'évaluation de l'excrétion par mesure de la cinétique d'élimination rénale du MRP.
La taille limitée des détecteurs plans (environ 40 × 60 cm2) ne permet pas d'acquérir des images du corps entier en mode statique. Pour ce faire, on effectue une acquisition par balayage qui consiste à déplacer le détecteur le long du patient au cours de l'acquisition, de sorte que l'ensemble du corps passe devant le détecteur. En pratique, le balayage est le plus souvent effectué en déplaçant le lit du patient par rapport au détecteur, ce qui revient strictement au même pour les images.
Tomoscintigraphie
Les images planaires sont une superposition des plans situés à différentes profondeurs du sujet par rapport au détecteur. Ces images sont souvent suffisantes pour obtenir l'information clinique recherchée. Cependant, elles ne permettent pas de différencier les fixations du MRP situées à différentes profondeurs. S'il est possible d'acquérir des images planaires selon différentes incidences pour lever certaines ambiguïtés, l'acquisition planaire reste limitée par une localisation anatomique imprécise et un contraste médiocre (l'intensité de fixation est moyennée sur toute la profondeur du sujet).
Lorsque la question médicale nécessite une localisation précise, on utilise un mode d'acquisition similaire aux techniques d'imagerie en coupe de type TDM : la tomographie d'émission monophotonique (TEMP) ou tomoscintigraphie (single photon emission tomography [SPECT]). Le principe consiste à faire pivoter le détecteur autour du patient pendant l'acquisition, ce qui revient à acquérir des projections de l'activité selon un grand nombre d'incidences (figure 5.5A). À partir de ces projections, on peut reconstruire la distribution tridimensionnelle du MRP par rétroprojection filtrée ou par méthode itérative (voir chapitre 9).
Tomographie d'émission monophotonique (A) et TEP (B).
Dessin : V. Lebon.
La tomoscintigraphie est d'utilisation courante et permet d'explorer les patients sur une hauteur d'environ 40 cm correspondant à la taille du détecteur. La durée d'acquisition relativement longue – typiquement 15 minutes – fait que l'acquisition tomoscintigraphique est généralement ciblée sur une zone spécifique, sans être répétée pour couvrir l'ensemble du corps. Il n'est généralement pas non plus possible de réaliser des acquisitions dynamiques en mode tomographique. Parmi les applications les plus courantes de la tomoscintigraphie, on peut citer la cardiologie (figure 5.6), les explorations ostéoarticulaires (figure 5.7) ou neurologiques (scintigraphie cérébrale de perfusion ou des transporteurs dopaminergiques).
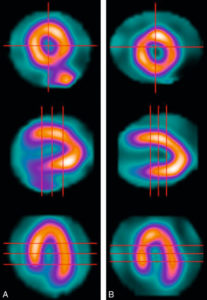
Tomoscintigraphie de perfusion myocardique chez un patient au repos.
Coupes petit axe (haut), grand axe verticale (milieu) et grand axe horizontale (bas) acquises en 18 minutes sur une gamma-caméra conventionnelle NaI (A). Mêmes coupes acquises en 4 minutes sur une gamma-caméra CdZnTe cardiologique General Electric (B).
Source : avec l'aimable autorisation du Dr Gimelli, Fondazione Toscana/CNR G. Monasterio, Pise, Italie.
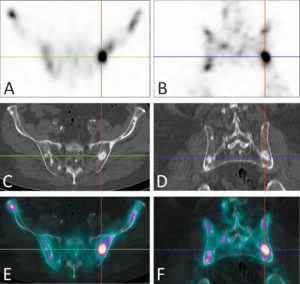
Tomoscintigraphie osseuse acquise sur une caméra hybride gamma-caméra/TDM chez un patient présentant des métastases de cancer de la prostate.
La tomoscintigraphie dans les plans axial (A) et coronal (B) révèle plusieurs foyers d'hyperfixation osseuse au niveau du bassin. La TDM acquise dans les mêmes plans retrouve des lésions condensantes en regard de ces foyers (C, D). La fusion des deux modalités conforte le diagnostic de métastases osseuses (E, F).
Source : Université Paris-Saclay/CEA-SHFJ, Orsay, France.
Caméra TEP
Collimation électronique
La TEP détecte les photons d'annihilation des positons produits par la désintégration d'émetteurs β+. Si le principe de détection des photons γ par cristal scintillant couplé aux PM est identique à celui utilisé dans les gamma-caméras, le principe de collimation est fondamentalement différent en TEP. L'annihilation d'un positon produit en effet deux photons γ de 511 keV émis simultanément (en coïncidence) à 180° l'un de l'autre. En utilisant une couronne de détecteurs placés autour du corps, la TEP permet de détecter les deux photons d'annihilation (figure 5.5B). La détection simultanée de deux photons de 511 keV en deux points de la couronne implique que l'annihilation du positon se situe sur la ligne reliant ces deux points qu'on appellera « ligne de réponse ». En enregistrant les détections en coïncidence selon toutes les directions, on obtient des projections selon un grand nombre d'incidences. La reconstruction d'images en coupes se fait ensuite selon le même principe que pour la tomoscintigraphie. En pratique, on enregistre les détections intervenant quasi simultanément, dans une fenêtre temporelle appelée « fenêtre de coïncidence ». L'utilisation d'une fenêtre suffisamment large – environ 10 ns – est nécessaire car les deux photons d'annihilation se déplacent à la vitesse de la lumière et n'atteignent pas strictement simultanément leur détecteur (la désintégration se produit nécessairement plus près d'un détecteur que de l'autre). Ainsi, la détermination de l'incidence des photons γ en TEP ne nécessite pas de collimateur physique : elle repose sur le réglage de la fenêtre temporelle de mesure du signal, d'où la terminologie « collimation électronique ».
Blocs détecteurs arrangés en couronne
Les caméras TEP (voir figure 5.4B) actuellement commercialisées sont constituées d'une centaine de blocs détecteurs parallélépipédiques disposés en couronne. La détection au sein de chaque bloc s'effectue de la même manière que dans le détecteur plan d'une gamma-caméra : par interaction avec un cristal scintillant couplé à des PM, puis détermination du point d'impact par la logique d'Anger à l'échelle du bloc. Une différence notable tient à la pixellisation du cristal : chaque bloc ne contient pas une dalle de cristal unique, mais une matrice de cristaux (typiquement 8 × 8) séparés les uns des autres par un matériau réfléchissant.
Contrairement à la scintigraphie conventionnelle, la TEP détecte des photons γ de même énergie quel que soit le MRP utilisé. Cette énergie (511 keV) est par ailleurs supérieure à celle des photons γ détectés en scintigraphie conventionnelle (70-360 keV). Cela impose l'utilisation de cristaux plus denses constitués d'atomes plus massiques (de type germanate de bismuth [BGO], orthosilicate de lutétium [LSO], oxyorthosilicate d'yttrium [YSO], YSO couplé au LSO [LYSO]).
Résolution spatiale et sensibilité
L'absence de collimateur physique confère à la TEP :
- une sensibilité (capacité à détecter une faible quantité de MRP) supérieure à la scintigraphie conventionnelle de plusieurs ordres de grandeur (puisque le rôle du collimateur est d'arrêter une grande majorité des rayons) ;
- une meilleure résolution spatiale (puisque le collimateur est le facteur qui limite la résolution des gamma-caméras). Cette résolution dépend principalement des dimensions des cristaux scintillants. Elle est d'environ 4 mm sur les caméras TEP commercialisées actuellement.
Nous avons vu précédemment que l'annihilation du positon ne se produit pas exactement à l'endroit où se désintègre le MRP. Cependant, la distance parcourue par le positon avant annihilation est en général inférieure à la résolution spatiale des caméras TEP, si bien que ce phénomène n'affecte pas significativement la localisation du MRP.
La sensibilité de détection de la TEP peut être améliorée par la technique du temps de vol, qui consiste à mesurer la différence entre les temps d'arrivée des deux photons sur leur détecteur. Le premier détecteur à interagir avec un photon est situé plus près du MRP que le détecteur qui interagit plus tard avec le second photon. Les caméras peuvent distinguer les temps d'arrivée des photons avec une précision de l'ordre de 300 ps. Compte tenu de la vitesse de la lumière, cela correspond à une localisation spatiale à une précision de l'ordre de :
δx = c × δt = 3.108 m ⋅ s-1 × 3.10-10 s = 9.10-2 m ≈10 cm
Cela n'est possible que pour les cristaux possédant une très bonne résolution temporelle (les photons de scintillation ne sont émis que très brièvement après l'absorption du photon γ) : seuls les cristaux d'oxyorthosilicate de germanium (GSO), de LSO ou d'YSO présentent une résolution temporelle suffisante. Le temps de vol n'améliore pas la résolution spatiale des images TEP, mais il améliore la sensibilité de détection car l'information temps de vol permet de réduire le bruit statistique dans l'image reconstruite. Cette technique est désormais proposée sur la quasi-totalité des caméras TEP.
La sensibilité élevée de la TEP permet de réaliser des tomographies dynamiques (3D + t), ce qui n'est généralement pas possible en tomoscintigraphie compte tenu de la durée d'acquisition élevée. Cela est couramment utilisé pour la recherche de métastases des cancers de la prostate en TEP à la 18F-fluorocholine (FCH) : l'acquisition d'images dynamiques précoces permet d'étudier la région pelvienne avant l'élimination urinaire du MRP susceptible de masquer les lésions. Les autres régions du corps sont analysées sur une acquisition plus tardive.
Caméras hybrides et dosimétrie
La plupart des caméras de médecine nucléaire combinent un système de détection des photons γ ou β+ et une TDM ; ce sont des appareils hybrides « gamma-caméra-TDM » ou « TEP-TDM » dont l'intérêt est double :
- ils permettent de combiner les données fonctionnelles de la médecine nucléaire (tomoscintigraphie ou TEP) aux données morphologiques de la TDM. Les images fonctionnelles (représentées en couleur) et les images morphologiques (représentées en noir et blanc) sont fusionnées, permettant une localisation anatomique précise des sites de fixation du MRP (figures 5.7 et 5.8) ;
- la TDM permet en outre de corriger les images de médecine nucléaire de l'atténuation des photons. Les photons γ sont en effet atténués par diffusion Compton dans les tissus mous et par effet photoélectrique dans l'os, ce phénomène étant d'autant plus important que les photons sont émis dans des régions profondes ou très atténuantes comme le tissu osseux. Pour éviter de sous-estimer la fixation de ces régions, il faut corriger l'activité mesurée en chaque point du corps en estimant l'atténuation des photons γ émis depuis ce point. Or, la TDM, par construction, représente l'atténuation des photons X en chaque point du corps. On peut facilement en extrapoler l'atténuation des photons γ et effectuer une correction d'atténuation des images de tomoscintigraphie ou de TEP.
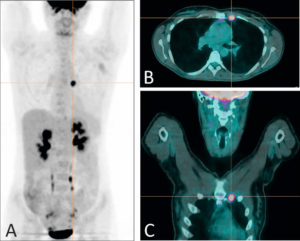
TEP au 18F-FDG chez une patiente présentant une atteinte métastatique de cancer du sein.
La représentation en mode maximum intensity projection (A) permet une visualisation de tous les sites d'accumulation du 18F-FDG ; outre les sites physiologiques (cerveau, reins, urètres, vessie), la TEP révèle un foyer hypermétabolique pathologique au niveau thoracique. La fusion avec la TDM dans les plans axial (B) et coronal (C) permet d'attribuer ce foyer à une métastase lymphatique mammaire interne gauche.
Source : Université Paris-Saclay/CEA-SHFJ, Orsay, France.
Pour limiter l'exposition des patients, les images TDM acquises sur les caméras hybrides utilisent en général un flux relativement faible de photons X. L'objectif de la TDM couplée à la médecine nucléaire étant la localisation des fixations et la correction d'atténuation, des images de moins bonne qualité qu'en TDM diagnostique suffisent. En pratique, la diminution du flux de photons X permet de diminuer la dose efficace de la TDM d'environ 50 %, à environ 8 mSv pour un corps entier. Ce niveau est similaire à celui d'une TEP au 18F-FDG, légèrement supérieur à celui d'une scintigraphie osseuse au 99mTc- hydroxyméthylène diphosphonate (HMDP) (environ 5 mSv).
Quantification de la fixation
Les images de médecine nucléaire peuvent être interprétées de manière visuelle qualitative, c'est-à-dire en décrivant la topographie des fixations anormales (hyperfixations ou hypofixations). Il est parfois possible de les interpréter de manière quantitative en estimant l'activité dans une région du corps (en kBq/mL), c'est-à-dire la quantité de MRP fixé dans cette région. Une telle quantification absolue n'est possible que pour les acquisitions tomographiques (TEP ou tomoscintigraphie).
La quantification est particulièrement utile pour l'évaluation thérapeutique des patients (comparaison de la fixation entre deux examens successifs). Elle peut apporter une information diagnostique (une fixation supérieure à un seuil donné peut orienter vers une maladie) ou pronostique (l'intensité de fixation de certaines tumeurs est corrélée à la survie des patients). Elle peut également contribuer à affiner la stratégie thérapeutique en permettant de délimiter des champs de radiothérapie.
Pour quantifier la fixation d'un MRP, il faut au préalable corriger les images de nombreux biais :
- l'atténuation des photons γ par les tissus biologiques (corrigée grâce aux images TDM) (voir plus loin) ;
- la diffusion Compton : la sélection par l'énergie ne permet pas d'éliminer les photons diffusés qui possèdent une énergie très proche de celle des photons de désintégration mais dont la direction a changé (ces photons sont donc mal localisés). Certaines techniques de traitement d'image permettent de corriger cet effet ;
- les coïncidences fortuites en TEP : deux photons issus de l'annihilation de deux positons différents peuvent en effet être détectés simultanément (dans la fenêtre de coïncidence). Ce phénomène n'est pas rare compte tenu du taux très élevé de désintégrations dans l'anneau de la caméra TEP. La détection de coïncidences fortuites peut être limitée par la réduction de la largeur de la fenêtre de coïncidence. Les signaux fortuits détectés peuvent aussi être estimés et un traitement des données permet de les soustraire.
En pratique, la correction des biais de quantification en tomoscintigraphie est imprécise. Elle souffre principalement d'une correction d'atténuation approximative et d'une résolution spatiale médiocre. Cela n'empêche pas de corriger les images de leurs biais pour en améliorer l'aspect et faciliter l'interprétation visuelle.
La correction des biais de quantification en TEP est beaucoup plus précise (la correction d'atténuation en TEP est exacte et la résolution spatiale très supérieure à la tomoscintigraphie). Les images de TEP se prêtent donc à une analyse quantitative. L'accumulation locale du MRP est mesurée par la valeur de fixation normalisée standard uptake value (SUV). La SUV peut se définir comme le rapport C/C0 où C est la concentration du MRP dans le voxel et C0 la concentration de dilution homogène dans le volume du corps (concentration théorique obtenue si le MRP se répartissait de façon homogène dans le patient) :
C0 = q / ( m/ρ) donc SUV = (C × m) / (q × ρ)
où q est l'activité injectée, m la masse du patient et ρ sa masse volumique estimée à 1 kg/L.
Évolutions technologiques récentes
Gamma-caméras à cristaux semi-conducteurs
Les principales limitations des gamma-caméras tenant à leur faible résolution spatiale et leur faible sensibilité, la recherche s'est portée sur le développement de cristaux plus sensibles. La principale voie d'amélioration réside dans le remplacement des cristaux scintillants par des cristaux semi-conducteurs de la famille du tellure de cadmium (CdTe ou CdZnTe ou CZT). Ces derniers convertissent directement l'énergie du photon γ absorbé en impulsion électrique, sans l'intermédiaire de photons lumineux, ce qui permet de s'affranchir des PM. Ils permettent aussi de mesurer la profondeur d'interaction du photon γ dans le cristal, ce qui améliore la localisation de la source radioactive. Ces cristaux peuvent être pixellisés (comme ceux des blocs de détection de la TEP), chaque cristal individuel pouvant posséder sa propre électronique de détection. Le couplage direct entre le cristal et l'électronique permet de s'affranchir de la logique d'Anger. Cette nouvelle génération de détecteurs est plus compacte que la précédente. Cela permet de disposer les détecteurs au plus près du patient et d'augmenter ainsi la sensibilité de détection et la résolution spatiale.
Les premières gamma-caméras à cristaux semi-conducteurs ont été développées pour la cardiologie. Elles sont constituées d'une dizaine de blocs de détection disposés en arc de cercle autour du thorax, chaque bloc comprenant un cristal pixellisé couplé à un collimateur sténopé. Comparativement à une gamma-caméra conventionnelle, le gain peut atteindre un facteur 5 à 10 pour la sensibilité et un facteur 2 à 3 pour la résolution spatiale (voir figure 5.6B). Une partie importante de ces gains s'explique par la géométrie optimisée de la caméra, les détecteurs se trouvant presque au contact de la paroi thoracique. Depuis peu, les gamma-caméras à cristaux semi-conducteurs permettent des explorations corps entier ; on parle alors de caméras CZT « grand champ ». Les modèles les plus récents utilisent une douzaine de détecteurs mobiles répartis autour du sujet sur un anneau de 360° ; chaque détecteur se positionne automatiquement au plus près du sujet, maximisant ainsi la sensibilité de détection quel que soit l'étage imagé (figure 5.9A).
Gamma-caméra CZT « grand champ » à détecteurs mobiles (A) et imageur hybride TEP-IRM (B).
Source : avec l'aimable autorisation des sociétés Spectrum Dynamics et General Electric.
Caméras TEP « numériques » et TEP-IRM
Les évolutions récentes en TEP portent sur le remplacement des tubes PM (très encombrants) par des photodiodes plus compactes. Cela permet d'associer à chaque cristal « pixellisé » (de quelques millimètres de côté) sa propre diode photomultiplicatrice, alors que dans les caméras TEP « classiques », chaque tube PM est couplé à un ensemble de quatre ou neuf cristaux. La sensibilité est ainsi améliorée par le couplage de chaque cristal à sa propre électronique de détection. Ce couplage permet en outre de s'affranchir de la logique d'Anger. Les caméras TEP équipées de photodiodes au silicium sont parfois appelées « TEP numériques ».
Un autre avantage des photodiodes au silicium est leur compatibilité avec les champs magnétiques. Leur développement a permis de lever le principal obstacle à la réalisation de caméras hybrides TEP-IRM (figure 5.9B). Ces caméras sont installées depuis peu. Leur intérêt diagnostique est en cours d'évaluation.
Essentiel à retenir
- L'imagerie de la médecine nucléaire repose sur la localisation d'un médicament radiopharmaceutique (MRP) préalablement administré au patient.
- La spécificité des images scintigraphiques tient à leur caractère fonctionnel : elles reflètent le comportement cinétique ou métabolique du MRP administré.
- La médecine nucléaire propose deux techniques d'imagerie : la scintigraphie dite « conventionnelle » et la TEP. La scintigraphie conventionnelle est effectuée au moyen d'une gamma-caméra et de MRP émetteurs de photons γ. La TEP utilise des MRP émetteurs de positons (désintégration β+). Les positons s'annihilent avec un électron à proximité de leur site d'émission, donnant naissance à une paire de photons γ qui sont détectés en TEP.
- Les MRP utilisés pour l'imagerie sont constitués d'un radionucléide (qui émet un rayonnement γ ou β+) lié à un vecteur (qui se fixe sur une structure particulière de l'organisme). Les MRP sont administrés à des concentrations extrêmement faibles (très inférieures à la nanomole), ce qui distingue la médecine nucléaire des autres techniques d'imagerie fonctionnelle.
- La scintigraphie conventionnelle dispose d'une grande variété de MRP différents, adaptés aux différentes questions diagnostiques. Le 99mTc est le radionucléide le plus couramment utilisé pour ces MRP.
- En routine clinique, la TEP utilise des MRP marqués au 18F, au sein desquels le 18F-FDG, marqueur de métabolisme glucidique, occupe une place prépondérante.
- Les gamma-caméras et les caméras TEP sont deux variantes de caméras à scintillation ; elles partagent le même principe de détection des photons γ, mais elles utilisent deux principes différents de localisation du MRP émetteur.
- La détection des photons γ en scintigraphie conventionnelle comme en TEP repose sur l'utilisation de cristaux scintillants couplés à des PM.
- Les gamma-caméras localisent le MRP au moyen de collimateurs placés entre le patient et le cristal scintillant.
- Les caméras TEP localisent le MRP en détectant les deux photons γ émis simultanément à 180° l'un de l'autre lors de l'annihilation du positon dans le patient.
- Les caméras TEP présentent une sensibilité et une résolution spatiale meilleures que celles des gamma-caméras.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 4 - Tomodensitométrie (TDM)
F. Pontana , B. Longère et A. Lalande
Plan du chapitre
- Introduction
- Principes de base
- Formation de l'image
- Principaux artefacts
- Produits de contraste
- Radioprotection en TDM
- Indications cliniques
- Conclusion
Objectifs
- Connaître les principes physiques et les risques de la tomodensitométrie (TDM).
- Connaître les bases de la formation et du traitement de l'image.
- Connaître les principes de prescription des TDM et des produits de contraste iodés.
- Connaître les indications et les limites de cette technique.
Introduction
Depuis l'apparition de la radiographie conventionnelle, consécutive à la découverte des rayons X par Wilhelm C. Röntgen en 1895, d'autres techniques d'imagerie permettant de visualiser plus de structures anatomiques de manière volumique ont été développées. En effet, la principale limitation de la radiographie conventionnelle est liée au principe même de cette technique qui repose sur la projection en deux dimensions d'un ensemble tridimensionnel de structures traversées par le faisceau de rayons X incident. Par conséquent, une partie des informations contenues dans l'image formée demeure inexploitable, masquée par les superpositions. De plus, la position des différentes structures les unes par rapport aux autres peut être ambiguë. La multiplication des incidences radiographiques, plus ou moins complexes à mettre en œuvre, permet par déduction de dégager certaines structures sans être néanmoins exhaustif.
L'ancêtre de la TDM, la tomographie, quant à elle, créait un flou cinétique permettant d'effacer du cliché radiographique toutes les structures situées hors du plan que l'on cherchait à imager, au prix d'une dose d'exposition plus importante et de la perte de toute information contenue dans les plans effacés (par exemple orthopantomographie ou panoramique dentaire).
La tomographie laissait entrevoir jusque dans son nom les prémices de la TDM qui permet d'explorer un volume en réalisant de multiples projections de plans selon des angles différents, au sein desquelles les structures sont différenciées en fonction de leur densité radiologique, c'est-à-dire leur capacité à absorber plus ou moins les rayons X. La discrimination à l'œil nu de leurs différentes densités nécessite une aide informatique permettant de voir les équivalents en densité des tonalités osseuse, hydrique et aérique de la radiographie conventionnelle.
Il revient à Godfrey Hounsfield d'avoir décrit et réalisé en 1972 la première TDM alors qu'Allan Cormack avait bâti 15 ans plus tôt le corpus mathématique nécessaire à son développement ; ils se partagèrent le prix Nobel de médecine de 1979.
Depuis les premières images TDM acquises en 1972, cette technique a connu un important et rapide essor technologique permettant d'abord une diminution du temps d'acquisition (de 6 coupes de 13 mm chacune en 35 minutes initialement à 384 coupes contiguës de 0,6 mm en 66 ms en 2016). Les principales innovations se sont efforcées récemment d'apporter une diminution notable de la dose d'exposition délivrée au patient tout en améliorant la qualité de l'image.
En 2012, en France, près de 82 millions d'actes diagnostiques utilisant des rayonnements ionisants ont été réalisés. Les examens TDM représentaient 10,5 % des actes réalisés mais 71 % de la dose efficace collective délivrée à la population française. La dose individuelle moyenne a augmenté de 20 % environ entre 2007 et 2012, du fait notamment d'une augmentation de 12 % du nombre d'examens TDM pendant cette période. Rapporté au nombre d'habitants, en 2019, la France était le troisième pays de l'Union européenne à prescrire le plus d'examens TDM. Ces données illustrent l'importance de maîtriser la dose délivrée au patient. Ce concept s'intègre dans le principe de radioprotection que le radiologue est, entre autres, en charge de faire respecter et de faire appliquer (voir « Radioprotection en TDM »).
L'augmentation du recours à la TDM ne doit pas faire négliger l'importance de l'examen clinique, prérequis indispensable afin de guider la demande.
Après avoir expliqué la formation de l'image à partir des principes de base de la TDM, l'utilisation des produits de contraste, quelques exemples d'indications de la TDM en pratique courante seront abordés dans ce chapitre.
Principes de base
« Anatomie » d'un scanner
Élément mobile tournant au sein d'un support fixe
Afin de pouvoir reconstruire les images dans le plan axial, il est nécessaire d'obtenir de multiples projections de rayons X réalisées selon les incidences couvrant de 0 à 180° autour de l'axe craniocaudal du patient. Ces incidences en projections multiples sont rendues possibles par deux grandes structures de la mécanique d'un scanner (figure 4.1) : le stator (statique) servant de support au rotor (rotation) de forme annulaire qui tourne autour du stator (rotor à ne pas confondre avec celui de l'anode tournante citée dans le chapitre 3).
Représentation schématique simplifiée d'un scanner multidétecteur simple source de troisième génération.
Représentation du rotor (en gris) embarquant le système de gestion de l'alimentation électrique, le tube radiogène et les détecteurs. Il tourne au sein du stator auquel il est relié par les « slip rings » de sorte que le faisceau de rayons X décrit autour du patient installé sur la table en mouvement une trajectoire hélicoïdale (en rouge).
Au fil de l'évolution technologique de la TDM, il s'est avéré plus efficace d'appliquer une rotation continue au couple tube radiogène-détecteur autour du patient de manière à ne pas perdre de temps avec de multiples accélérations et décélérations du rotor (de l'ordre de ± 100 m/s2). Le poids de ce dernier (une tonne environ pour un scanner classique) implique d'importantes contraintes mécaniques, liées notamment aux frottements et à la force centrifuge générée par des vitesses de rotation de plus en plus élevées (actuellement jusqu'à quatre tours/seconde) pour des machines qui peuvent, pour certains modèles non présentés dans ce chapitre ici car bien moins répandus, embarquer sur leur rotor deux couples tube-détecteur (scanners bitubes). Compte tenu du grand nombre de tours effectués, il n'est pas possible de conduire l'alimentation électrique du système par un câblage classique ; la conduction électrique se fait par un système de bagues et de frotteurs (système « slip rings »). Le transfert de données peut s'effectuer par leur biais ou, plus fréquemment de nos jours, par une communication sans fil.
Le rotor électriquement relié au stator par les slip rings supporte la majorité des éléments de la chaîne radiologique :
- le tube à rayons X ou tube radiogène (dont les principes de fonctionnement ont été décrits dans le chapitre 3). Plus performant et donc plus onéreux qu'en radiologie classique, il doit répondre aux contraintes inhérentes à la technique TDM. Du fait d'une durée de balayage de l'anode tournante par le faisceau d'électrons plus importante qu'en radiologie conventionnelle, celle-ci doit pouvoir supporter un échauffement plus intense (capacité thermique élevée). Par ailleurs, elle doit être en mesure de se refroidir suffisamment rapidement pour permettre les acquisitions successives (dissipation thermique élevée) ;
- les filtres et collimateur primaire situés à la sortie du tube radiogène. Les premiers sont constitués d'une fine couche de métal (aluminium, étain) et ont pour objectif d'absorber les rayons X les moins énergétiques qui sont à l'origine d'une irradiation inutile (ils ne ressortiraient pas du patient et n'apporteraient donc aucune information). Le collimateur primaire, quant à lui, permet de modifier la géométrie du faisceau de rayons X afin de s'adapter aux largeurs d'exploration et aux épaisseurs de coupes désirées ;
- le système de détection. Son but est de restituer en signal électrique l'information contenue dans le faisceau de photons X ayant traversé le patient. De nos jours, les détecteurs les plus répandus consistent en des cristaux de céramique photoluminescents qui transforment les photons X en photons de lumière visible. Ces derniers sont captés par une photodiode située juste sous le cristal scintillant et convertis en courant électrique. Le cristal constitue l'unité élémentaire du système de détection. Ces cristaux de taille millimétrique sont disposés sur un arc de cercle dont le centre est occupé par le tube radiogène, de manière à couvrir le secteur angulaire du faisceau divergent de rayons X. Les scanners contemporains sont dits « multibarrettes » ou « multidétecteurs », par opposition aux scanners dits « monocoupes » désormais disparus. On désigne par « barrette » (ou par abus de langage « détecteur ») une rangée de cristaux scintillants disposés en arc de cercle. La juxtaposition de ces barrettes de détecteurs permet d'augmenter le nombre de coupes axiales acquises simultanément (16, 32, 64, 128, voire jusqu'à 320 coupes), la totalité de la surface de cristaux scintillants ainsi formée étant couverte par le faisceau. Les scanners de dernière génération utilisent des cristaux de 0,5 à 0,625 mm. Un scanner de 128 barrettes par exemple permet donc l'acquisition simultanée de 128 coupes couvrant une hauteur de 6 à 8 cm dans l'axe craniocaudal du patient. L'augmentation de la sensibilité des détecteurs est un enjeu important puisqu'elle permet une réduction significative de la dose d'exposition délivrée au patient pour une qualité d'image au moins équivalente.
Autres éléments
- L'alimentation électrique, de l'ordre de 150 kV, doit permettre le fonctionnement d'un circuit à basse tension et d'un circuit à haute tension pour le fonctionnement du tube.
- La table d'examen sur laquelle le patient est allongé est mobile, aussi transparente aux rayons X que possible et elle permet un mouvement de translation longitudinale au sein de l'anneau formé par le rotor.
- La console d'acquisition est un poste informatisé qui permet non seulement de programmer l'acquisition, mais également de reconstruire et visualiser les images. Le reconstructeur d'images de la console nécessite une importante puissance de calcul informatique car il pourrait constituer un facteur limitant aux avancées technologiques, notamment logicielles (un système informatique mal adapté retardant la disponibilité immédiate des images par un temps de reconstruction trop long).
Interaction des rayons X avec la matière
Les principes d'interaction des photons X avec la matière sont les mêmes qu'en radiographie conventionnelle (voir chapitre 3).
Réalisation en pratique d'une TDM
Le patient est accueilli au secrétariat et son identité est vérifiée. Il est ensuite pris en charge par un manipulateur en électroradiologie médicale (MER) qui l'installe dans une cabine s'il est valide. Le patient se déshabille partiellement en fonction du type d'examen. On s'assure qu'il n'y a pas de métal (bouton pression sur une chemise, boucle de ceinture par exemple), susceptible d'entraîner des artefacts sur l'image. La recherche de contre-indications à l'injection de produit de contraste, effectuée préalablement par le demandeur d'examen, est confirmée lors de l'examen. En fonction de la demande transmise par le médecin demandeur, le radiologue, s'il valide l'indication, détermine la (ou les) zone(s) anatomique(s) à explorer et la nécessité ou non d'utiliser un produit de contraste iodé. Des acquisitions successives peuvent être réalisées au cours d'un même examen sur tout ou partie du volume d'étude ; il s'agit du protocole d'acquisition. Si une injection intraveineuse de produit de contraste iodé est nécessaire, une voie veineuse périphérique est alors mise en place. Le patient est allongé sur la table d'examen et le manipulateur lui explique si une apnée est nécessaire pendant l'acquisition. L'anneau étant peu profond, il n'y a pas de problème lié à une éventuelle claustrophobie.
Depuis la console d'acquisition, le manipulateur, sous la responsabilité du radiologue, programme les différentes phases de l'examen selon le protocole :
- topogramme ou mode radio réalisé de face et parfois de profil : des radiographies (voir plus loin « Mode radio ») sont réalisées de manière à définir les limites du ou des volumes d'acquisition, représentés sous la forme de « boîtes » que l'on ajuste sur les clichés de repérage ;
- pour chaque volume d'acquisition programmé, plusieurs paramètres techniques doivent être ajustés afin d'optimiser le compromis entre la dose délivrée et la qualité de l'image qui devra rester compatible avec le diagnostic. Il est alors possible de modifier la quantité de rayons X émis (charge du tube, dépendant du milliampérage utilisé), l'énergie des photons X (en keV, dépendant du kilovoltage utilisé), les vitesses de rotation du tube autour du patient (en seconde par tour) et d'avancée de la table d'examen (définissant le pas de l'hélice décrite par le faisceau de rayons X autour du patient) ;
- l'acquisition est réalisée selon les paramètres précédemment renseignés. Une injection ou une ingestion de produit de contraste est réalisée si besoin. Le temps d'acquisition est très court (quelques secondes) sur les appareils récents ;
- les données obtenues, dites « données brutes », ne sont pas des images mais un profil global d'atténuation. Un traitement informatique est nécessaire pour générer les images (voir plus loin « Formation de l'image »). Cette phase de reconstruction des images peut nécessiter plus ou moins de temps (ancienneté du système informatique, nombre de coupes, protocoles spécifiques). Le radiologue consulte rapidement les images reconstruites afin de déterminer si des acquisitions complémentaires sont nécessaires ou si, au contraire, l'examen est terminé ;
- les images acquises sont traitées puis interprétées par le radiologue. Le temps de l'interprétation est plus long que celui de l'acquisition car une TDM peut générer plusieurs centaines de coupes auxquelles on applique des filtres divers (voir plus loin « Filtres ») et un traitement particulier en fonction de la question posée (voir plus loin «Traitement des images en TDM »). Les images produites lors de l'examen sont archivées afin d'être sauvegardées (voir chapitre 2).
Formation de l'image
Modes d'acquisition
Les mouvements de la table d'examen, associés ou non à la rotation du tube, permettent différents modes d'acquisition.
Mode radio
Le couple tube-détecteur restant fixe (pas de rotation), la translation de la table permet un balayage du patient par un faisceau de rayons X selon une incidence donnée et produit une image radiographique (dite « topogramme » ou « scout view »). Ce cliché permet notamment de repérer et de délimiter les volumes à explorer.
Le profil d'atténuation du topogramme permet de déterminer les variations d'absorption des photons X le long du volume exploré et de moduler automatiquement le flux de rayons X émis lors de l'acquisition. Cette modulation automatique de dose permet d'augmenter automatiquement le flux de rayons X lors du passage sur les structures plus absorbantes (ceintures scapulaire et pelvienne par exemple) et de le diminuer automatiquement au cours de la même acquisition lors de l'exposition de structures moins atténuantes comme le parenchyme pulmonaire.
Mode séquentiel
Ce mode d'acquisition était le seul utilisé sur les scanners des générations précédentes. La table étant immobile, le couple tube-détecteur effectue une rotation autour du patient et génère autant de coupes que de « barrettes ». À l'arrêt de la rotation, la table se déplace de manière à présenter au flux de rayons X la suite du volume à explorer. Un « tir » de rayons X est donc effectué autour du patient à chaque palier d'avancée de table (mode « step and shoot »).
Ce principe reste appliqué en imagerie cardiaque, en radiologie interventionnelle scanoguidée et en angioscanographie pour surveiller l'arrivée du bolus de produit de contraste dans les vaisseaux et déclencher l'acquisition au temps artériel approprié.
Mode hélicoïdal
Ce mode d'acquisition a presque complètement remplacé le mode séquentiel et constitue le mode habituel d'un scanner contemporain. La table d'examen effectue une translation à vitesse continue au centre du rotor, de sorte que le couple tube-détecteur décrit une hélice autour de l'axe craniocaudal du patient (figure 4.1). La vitesse d'avancée de table est déterminée lors de la programmation et dépend de la région anatomique explorée. Le terme de « scanner spiralé » est parfois employé, bien que la trajectoire décrite autour du patient ne soit pas une spirale mais bien une hélice.
De nos jours, une acquisition thoraco-abdomino-pelvienne peut être réalisée en une seconde sur quelques appareils récents (vitesse d'avancée de table de plus de 70 cm/s), permettant, entre autres, de diminuer les quantités de produit de contraste iodé injectées pour l'exploration d'une aorte complète et de limiter les artefacts induits par les mouvements du patient (mouvements respiratoires du patient confus ou dyspnéique, battements cardiaques). Cette accélération conséquente permet également la réalisation d'une étude multiphasique consistant en la répétition des acquisitions après injection de produit de contraste (voir plus loin « Produits de contraste ») avec en corollaire l'augmentation inévitable de la dose d'exposition délivrée au patient.
Densité
La densité « radiologique » a été définie par G. Hounsfield. Parfois appelée « densité » par abus de langage, elle n'a rien à voir avec la grandeur physique que représente le rapport de la masse volumique d'un corps à celle de l'eau pure.
La capacité d'un milieu à atténuer les photons X est représentée par son coefficient d'atténuation linéique (μ, ou coefficient linéaire d'atténuation, dont l'unité est l'inverse d'une longueur). Ce coefficient ne dépend pas de la quantité de photons l'abordant mais de leur énergie. Une définition plus simple et indépendante de l'énergie des rayons X est proposée : comme pour la densité physique, c'est l'eau pure qui a été retenue comme référence et tous les tissus ou éléments susceptibles d'être rencontrés dans l'organisme sont situés sur l'échelle dite « de Hounsfield », s'étalant initialement de –1000 à + 1000 Unités Hounsfield (UH) définie par :
Densite Hounsfield = 1000 x (µ - µH2O) / µH2O
(où μ est le coefficient d'atténuation linéique du volume étudié, et μH2O celui de l'eau pure).
Le coefficient d'atténuation de l'air étant très proche de zéro (qui est le coefficient du vide), l'atténuation des photons X dans les épaisseurs d'air, séparant le patient du tube radiogène d'une part, et du capteur d'autre part, est considérée comme nulle et la densité Hounsfield d'un tissu ne dépend ni de la largeur de l'anneau du rotor, ni de la corpulence du patient. On en déduit par ailleurs que l'air présente une densité radiologique de –1000 UH ; il s'agit de la limite inférieure de l'échelle de Hounsfield. Les structures moins denses que l'eau (air, graisse) présentent une densité Hounsfield négative.
En revanche, la limite supérieure de l'échelle de Hounsfield, qui avait initialement été fixée de façon symétrique mais arbitraire à + 1000 UH, a été repoussée en fonction des capacités matérielles à discriminer d'importantes atténuations. Ainsi, l'os très dense (comme le rocher) ou les prothèses métalliques peuvent présenter, vu leur coefficient d'atténuation, des densités bien supérieures à 1000 UH (si μ > 2 × μH2O). La répartition des densités rencontrées dans le corps humain est représentée dans la figure 4.2.
Échelle de Hounsfield.
Représentation schématique de la répartition des densités rencontrées dans l'organisme sur l'échelle de densité arbitraire utilisée en pratique. Les densités TDM sont exprimées en UH. Les densités correspondant aux parties molles et organes pleins sont très proches les unes des autres si l'on considère toute l'amplitude de l'échelle (de –1000 à + 1000 UH). L'utilisation de fenêtres, représentées à droite, permet de ne se concentrer que sur une plage donnée de l'échelle afin d'accentuer le contraste et de rendre perceptibles par l'œil humain ces faibles différences de densité. Les pixels situés en dessous de la borne inférieure de la fenêtre apparaissent tous en noir tandis que ceux situés au-dessus de la borne supérieure apparaissent tous en blanc. SB : substance blanche ; SG : substance grise.
La description des images TDM et leur interprétation feront donc référence à des structures hypodenses, isodenses ou hyperdenses (par rapport à la structure normale) et à des éléments de densités aérique, graisseuse, hydrique, osseuse, etc. Les termes de « tonalité » ou d'« opacité » sont à réserver à la radiographie conventionnelle, tandis que ceux de « signal » ou d'« intensité » sont propres à l'IRM.
Traitement des images en TDM
Les images natives sont les coupes axiales obtenues lors de l'acquisition et reconstruites par rétroprojection filtrée ou par itérations à partir des données brutes.
Le traitement des images désigne l'ensemble des applications effectuées à partir des images natives afin d'en tirer davantage d'informations, aboutissant à la formation d'images dites « reconstruites ». Ces reconstructions ne dispensent pas de l'analyse des images natives qui restituent plus fidèlement l'information contenue dans les données brutes (voir chapitre 10).
Filtres
La reconstruction des données brutes en images s'accompagne de l'application de filtres numériques. Ceux-ci vont intensifier sélectivement certaines données, dans le but notamment de mieux définir les contours au prix d'une augmentation du bruit (voir chapitre 2) dans l'image (filtre « dur ») ou, au contraire, de privilégier le contraste en acceptant d'induire une part de flou dans les contours (filtre « mou »). Le rapport signal/bruit (S/B, en anglais S/N) rend compte de cet effet : un filtre mou améliore le rapport S/B aux dépens de la résolution spatiale, et inversement pour un filtre dur (figure 4.3, figure 4.4). Il existe donc différents types de filtres selon les structures anatomiques que l'on souhaite étudier ; on peut reconstruire plusieurs jeux d'images successifs à partir des mêmes données brutes en leur appliquant le filtre souhaité. Une seule acquisition est effectuée pour reconstruire par exemple des images thoraciques en filtre mou dit « médiastinal » ou en filtre dur dit « parenchymateux pulmonaire »).
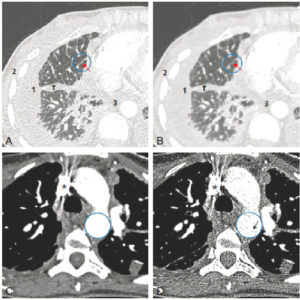
Angio-TDM thoracique réalisée chez une patiente souffrant d'une néoplasie mammaire évoluée (coupes axiales).
A. Reconstruction en filtre dur affichée en fenêtre parenchymateuse pulmonaire. Le filtre dur autorise une bonne résolution spatiale permettant de bien mettre en évidence les épaississements des lignes septales comportant de petites formations micronodulaires (flèche) dans le cadre de cette lymphangite carcinomateuse. Le contraste spontané avec l'air étant élevé, une fenêtre large est utilisée. En revanche, le faible contraste de cette fenêtre ne permet pas la distinction entre l'épanchement pleural (1) ou sa composante scissurale (1′), le muscle dentelé antérieur (2) et la graisse médiastinale (3). B. Même coupe qu'en A reconstruite en filtre mou et affichée en fenêtre parenchymateuse pulmonaire. Le filtre mou diminue le bruit au sein de l'image au détriment de la résolution spatiale, rendant moins évidente la composante micronodulaire au sein de l'épaississement septal (flèche). L'amélioration du rapport S/B par ce filtre ne permet néanmoins pas d'améliorer la différenciation entre les structures hydriques, musculaires et graisseuses (1 à 3) qui dépend du fenêtrage. C. Autre plan de coupe avec reconstruction en filtre mou affichée en fenêtre médiastinale. Le filtre mou offre un rapport S/B meilleur (zone agrandie au sein du cercle), permettant de bien étudier les structures tissulaires ou vasculaires. Noter la présence d'artefacts de durcissement du faisceau (atténuation des photons de basse énergie, laissant une forte proportion de photons de haute énergie) autour de la veine cave supérieure et liée au bolus de produit de contraste très dense (astérisque). D. Même coupe qu'en C reconstruite en filtre dur et affichée en fenêtre médiastinale. Bien qu'affichée en fenêtre médiastinale, l'étude du médiastin et des vaisseaux n'est pas optimale car le rapport S/B est faible. Le bruit davantage présent dans l'image se manifeste sous la forme d'un aspect granuleux visible (flèche au sein de la zone agrandie).
TDM cérébrale sans injection réalisée dans le cadre d'un traumatisme craniofacial sévère (même coupe axiale reconstruite selon différents filtres en utilisant différents fenêtrages).
1. Corps vitré de l'œil gauche (densité hydrique : 0 UH) ; 2. graisse rétro-orbitaire (densité graisseuse : –80 UH) ; 3. écaille temporale (densité osseuse : 950 UH) ; 4. air au sein de la corne temporale du ventricule latéral gauche (densité aérique : –980 UH) ; 5. sang au sein de la citerne prépontique (densité hématique : 65 UH) ; 6. parenchyme cérébral (densité tissulaire : 30 UH). A. Reconstruction en filtre mou affichée en fenêtre parenchymateuse cérébrale. Le fenêtrage permet la bonne visibilité de l'hémorragie sous-arachnoïdienne traumatique diffuse moulant les sillons corticaux et les citernes droites (5) ainsi que la différenciation entre les substances blanche et grise (6). La pneumencéphalie (astérisque) en temporopolaire droit est également bien visible et signe la présence d'au moins une fracture. B. Reconstruction en filtre mou affichée dans une fenêtre proche d'une fenêtre parenchymateuse pulmonaire. Cette fenêtre est plus large que la précédente, diminuant ainsi le contraste. L'hémorragie est nettement moins visible (5) et la distinction entre les substances blanche et grise n'est plus possible (6), la rendant inappropriée pour l'étude du parenchyme cérébral. La nuance entre les densités graisseuse (2) et aérique (4) est mieux visible qu'en A. C. Reconstruction en filtre dur affichée en fenêtre osseuse. Cette fenêtre est centrée sur les densités plus élevées et est large. Le contraste naturel entre l'os cortical et les autres structures ne nécessite pas une fenêtre étroite (3). Le filtre dur augmente par ailleurs la résolution spatiale, rendant ainsi visibles les fins traits de fracture du processus frontal de l'os zygomatique droit et des os nasaux (flèches). Ces fractures ne sont pas décelables sur les reconstructions en filtre mou, d'autant plus qu'elles ne sont pas affichées en fenêtre osseuse.
Un autre exemple est l'utilisation d'un filtre dur pour étudier l'os. En effet, bien que le contraste naturel entre les tissus mous et l'os ne nécessite pas d'être amplifié, dans l'os lui-même, les anomalies recherchées (fin trait de fracture par exemple) nécessitent un filtre dur pour une délimitation très nette des contours sur des coupes très fines. À l'inverse, un filtre parenchymateux cérébral est mou car l'étude TDM du parenchyme cérébral va s'attacher à rechercher, sur des coupes volontiers épaisses, des faibles différences de densité et non de très fines anomalies structurelles (voir figure 4.4).
Fenêtrage
À chaque pixel, structure élémentaire de l'image, est attribuée une valeur numérique proportionnelle à la densité moyenne qu'il représente et apparaît en nuances de gris. Sur un écran, plusieurs centaines de niveaux de gris sont représentées alors que l'œil humain ne peut en discerner qu'entre 20 et 30. Il est donc nécessaire de compenser les limites imposées par notre physiologie par un artifice numérique nommé « fenêtrage ».
L'ensemble des pixels d'une image peut être réparti sur un histogramme présentant en abscisse les valeurs numériques que peuvent prendre les pixels (216 valeurs de 0 à 65 535 pour une image codée sur 2 octets) et en ordonnée le nombre de pixels présentant cette valeur. Afin de représenter sous forme d'image ces valeurs numériques, on attribue à l'histogramme une table de correspondance (look-up table [LUT]) qui affecte un gradient de niveaux de gris à l'abscisse, de son origine à sa valeur maximale ; elle fait donc correspondre des niveaux de gris à l'écran avec la valeur numérique du pixel. Par convention, la LUT utilisée en TDM va du noir au blanc de sorte que les pixels présentant de faibles valeurs apparaissent plus sombres, et inversement (voir chapitre 11).
En diminuant la largeur d'abscisse le long de laquelle la LUT s'étend, tous les pixels présentant une valeur au-delà des bornes inférieure ou supérieure de la LUT apparaissent respectivement noirs ou blancs. Aux pixels situés entre ces bornes, une nouvelle nuance de gris est attribuée, permettant à l'œil de discriminer davantage de valeurs et donc de densités, tandis que l'information située hors de cet intervalle est volontairement masquée. Le terme de « fenêtre » désigne la largeur de la LUT. Une fenêtre large permettra d'afficher une vaste palette des densités explorées, quitte à ne pas en percevoir toutes les nuances, tandis qu'une fenêtre plus étroite n'affichera qu'un échantillon des densités explorées mais en permet une meilleure discrimination. Ainsi, la largeur de la fenêtre définit le contraste de l'image restituée.
Une fois la largeur de fenêtre fixée, il est également possible d'en définir le centre (appelé aussi niveau) le long de l'axe des abscisses. Une fenêtre centrée sur les valeurs les plus faibles sera propice à l'étude détaillée des structures les moins denses, et inversement. La modification du centre de la fenêtre permet donc de modifier la luminosité de l'image.
Le fenêtrage désigne le réglage de la largeur et du centre de la fenêtre pour optimiser l'étude d'une région donnée (voir figure 4.2).
Les notions de fenêtre et de filtre sont à bien distinguer (voir figures 4.3 et 4.4) : le filtre permet la reconstruction des images à partir des données brutes en accentuant certaines informations (contours ou contraste), tandis que la fenêtre permet de modifier l'affichage des images reconstruites selon un filtre donné. Ainsi, une acquisition thoracique reconstruite en filtre dur pourra être affichée en fenêtre dite « parenchymateuse », relativement large et centrée sur les très faibles densités aériques, tandis que le cadre osseux apparaîtra très « blanc » et de façon homogène ; les mêmes images en filtre dur peuvent également être affichées en fenêtre dite « osseuse », cette fois-ci centrée sur les hautes densités afin de pouvoir distinguer l'os cortical des trabéculations, tandis que le parenchyme pulmonaire apparaîtra uniformément « noir ». En revanche, l'analyse du médiastin et des vaisseaux nécessitera des images reconstruites selon un filtre mou afin de limiter le bruit dans l'image et affichées avec une fenêtre dédiée à l'étude des parties molles (plus étroite et centrée sur les densités hydriques).
Mesures
La reconstruction des images sur la matrice se fait selon les lois de la géométrie (symétrie centrale, projections, rotations, agrandissements), de sorte qu'il est possible de calculer et d'afficher des paramètres géométriques. En effet, il est possible d'effectuer diverses mesures, par l'intermédiaire d'outils graphiques, sur les images affichées : longueurs (rectilignes ou non), aires, angles, volumes. Par ailleurs, il est possible de mesurer en UH la densité d'une région dite « région d'intérêt » (region of interest [ROI]) afin de caractériser un tissu ou d'en quantifier le rehaussement après injection de produit de contraste.
Reconstructions de données volumiques
Du fait des dimensions inframillimétriques des récepteurs actuels, regroupés en barrettes couvrant de larges hauteurs, l'empilement des coupes permet l'obtention de véritables volumes d'acquisitions. Le passage d'un objet bidimensionnel à un niveau tridimensionnel implique de redéfinir l'unité élémentaire qu'est le pixel ; on lui ajoute une dimension qui ne correspond plus à un carré mais à un cube appelé « voxel » (volume element).
Il est alors possible de reconstruire une coupe du volume selon n'importe quel plan de l'espace : il s'agit des reconstructions multiplanaires (multiplanar reconstruction ou multiplanar reformating [MPR]) (figure 4.5). Ces reconstructions multiplanaires peuvent également permettre de suivre la trajectoire d'une structure (un vaisseau par exemple) afin de la dérouler et ainsi de permettre la visualisation d'une structure curviligne sur une seule image (MPR curviligne). D'autres modes de reconstructions sont disponibles : sommation dans l'épaisseur des structures les plus denses (maximal intensity projection [MIP]), sommation dans l'épaisseur des structures les moins denses (minimal intensity projection [MinIP]), reconstruction du volume, en affectant une texture, un jeu de lumière et une couleur à chaque structure reconstruite (rendu surfacique, surface rendering, mode SR, ou rendu volumique, volume rendering, mode VR) (voir chapitre 10).
MPR d'une angio-TDM thoracique.
Le mode MPR permet l'affichage d'une même série d'images natives dans les plans axial (cadre rose), coronal (cadre violet) et sagittal (cadre orange) de manière simultanée ou dans tout autre plan de l'espace. Ici, une reconstruction sagittale oblique dans le plan de la crosse aortique permet d'afficher le vaisseau sur toute sa longueur (cadre vert).
Traitements spécifiques
Ces applications sont dérivées des reconstructions sur les acquisitions volumiques : endoscopie digestive ou bronchique virtuelle permettant de naviguer dans les organes creux pour rechercher des structures bourgeonnantes, détection automatisée de lésions pulmonaires ou hépatiques (par exemple computer-aided diagnosis [CAD]), reconstruction de volumes aux différents temps du cycle cardiaque, et calcul des volumes et fonctions ventriculaires, étude dynamique de la perfusion d'un organe avec établissement de courbes de rehaussement, permettant notamment la caractérisation tissulaire, cartographie de la répartition du produit de contraste iodé injecté, fusion avec d'autres modalités d'examens d'imagerie.
Principaux artefacts
Il existe de nombreux types d'artefacts en TDM : de mouvement, métalliques, de volume partiel, de durcissement, d'hélice, en cible. Les plus caractéristiques et les plus fréquents sont abordés ici.
Artefacts de mouvement
Même si l'acquisition est rapide, elle n'est pas instantanée, et donc il est nécessaire que le sujet demeure immobile de manière à ne pas produire de flou sur les images. En TDM, l'artefact de mouvement se manifeste sous la forme d'un dédoublement des contours en mouvement. La coopération du patient est donc nécessaire pour l'exploration TDM, afin d'obtenir de lui qu'il n'effectue aucun mouvement. Cela implique généralement une apnée d'une dizaine de secondes pour les explorations thoraciques ou abdominopelviennes. L'immobilité peut néanmoins être difficile à obtenir selon le terrain : patient confus ou agité, enfant non coopérant, dyspnée sévère, patient algique, etc. Une sédation ou une contention physique, voire une anesthésie générale peuvent se révéler nécessaires. La pulsatilité des artères, le péristaltisme digestif ou les battements cardiaques restent incontrôlables. Au niveau de la racine de l'aorte, cela peut entraîner de fausses images de dédoublement des contours de la racine aortique pouvant en imposer à tort pour une dissection aortique. On peut l'éviter en utilisant une synchronisation de l'acquisition TDM à l'électrocardiographie (ECG) et en utilisant un module de reconstruction des images dédié à l'exploration cardiaque et vasculaire, au prix d'une irradiation plus importante (figures 4.6 et 4.7).
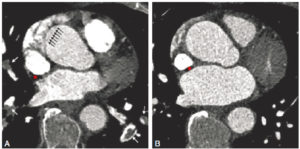
Angio-TDM thoracique réalisée dans le cadre d'une suspicion de dissection aortique (coupes axiales).
A. Les battements cardiaques se répercutent sur la racine aortique et sont responsables d'artefacts cinétiques se manifestant sous la forme d'un dédoublement des contours, mimant ainsi une dissection de l'aorte thoracique ascendante (flèches noires). Noter la présence d'une embolie pulmonaire (défaut de rehaussement endoluminal ; flèches blanches). B. Le recours à une synchronisation cardiaque (« gating » cardiaque) permet de s'affranchir des artefacts cinétiques et d'écarter ici le diagnostic de dissection aortique. La synchronisation cardiaque n'est pas toujours possible dans le cadre de l'urgence, ce qui n'empêche habituellement pas le diagnostic (en particulier lorsque la dissection atteint l'aorte descendante, fixe et donc moins sensible aux artefacts cinétiques). A, B. Le bolus de produit de contraste concentré au sein de la veine cave supérieure est responsable d'artefacts de durcissement du faisceau, se manifestant par des bandes hypodenses (astérisque).
Angio-TDM thoracique réalisée dans le cadre d'une suspicion de dissection aortique (coupe sagittale oblique).
L'absence de synchronisation cardiaque et une résolution temporelle insuffisante (temps de rotation du rotor trop long) génèrent des artefacts de mouvement avec un aspect crénelé de l'aorte thoracique qui gêne son évaluation.
Artefacts métalliques
On parle d'artefact métallique lorsque le phénomène de durcissement du faisceau est provoqué par l'interaction du faisceau de rayons X avec un corps étranger métallique, produisant des artefacts en bandes caractéristiques, souvent plus marqués que lorsqu'ils sont produits par des structures osseuses denses. Ces corps étrangers sont le plus souvent des implants dentaires ou des prothèses orthopédiques (figures 4.8 et 4.9).
TDM abdominopelvienne en coupe axiale à l'étage pelvien.
L'examen est réalisé dans le cadre d'un traumatisme grave du bassin ayant nécessité le tamponnement d'un saignement par des compresses après laparotomie puis fermeture (cette technique d'hémostase chirurgicale en urgence est également appelée packing). Les compresses présentent des bandes métalliques permettant leur repérage radiographique ou comme ici en TDM. Ces bandes sont responsables d'artefacts métalliques (flèches noires). Par ailleurs, il existe probablement un problème de calibration sur le scanographe ayant réalisé l'examen, se manifestant sous la forme de bandes disposées en cible (lignes pointillées). Noter la thrombose de l'artère iliaque primitive gauche qui n'est pas opacifiée (astérisque blanc), contrairement à son homologue controlatérale (astérisque noir).
Dissection aortique sur TDM thoraco-abdomino-pelvienne (coupe axiale à l'étage abdominal).
La vitesse d'avancée de table élevée utilisée est responsable d'artefacts en hélice au pôle supérieur du rein gauche, ou en étoiles en regard des structures vasculaires, propres à la technique hélicoïdale (flèches). Les électrodes du scope ECG posées sur la peau sont responsables d'artefacts métalliques (doubles flèches). Noter l'opacification du vrai chenal (astérisque noir), tandis que le faux chenal, circulant plus lentement, n'est pas encore opacifié (astérisque blanc).
Effet de volume partiel
Il ne s'agit pas à proprement parler d'un artefact mais plutôt d'une limite de l'imagerie tomodensitométrique. Le principe est que plusieurs entités de densités différentes sont codées au sein d'un seul voxel. Le signal résultant est une moyenne du signal de l'ensemble des entités pondérées par leur volume relatif au sein du voxel. Alors, le signal obtenu ne correspond plus à une structure en particulier. Ce phénomène est d'autant plus fréquent que les coupes sont plus épaisses et l'objet plus petit. L'analyse multiplanaire permet souvent de confirmer l'effet de volume partiel suspecté.
Produits de contraste
Principes
Le contraste naturel entre les tissus de certaines régions anatomiques étant limité (abdomen par exemple), le recours à des produits de contraste est souvent nécessaire en TDM. L'augmentation du contraste est due à la présence d'atomes à numéro atomique élevé (Z = 53 pour l'iode, Z = 56 pour le baryum) qui augmentent l'absorption des photons X.
L'iode en lui-même est toxique du fait de son interaction avec la thyroïde et est donc intégré dans une enveloppe moléculaire cyclique (benzènes) rendue hydrophile afin d'empêcher sa métabolisation. Il existe plusieurs spécialités de produits de contraste iodés distribuées par différents laboratoires pharmaceutiques, chacune correspondant à une enveloppe benzénique différente. Ces différentes spécialités sont souvent disponibles en plusieurs concentrations différentes (jusqu'à 400 mg/L d'iodure). Les produits de contraste sont des médicaments sur liste I (uniquement délivrés sur prescription médicale).
Les modalités d'administration des produits de contraste iodés sont multiples. Bien que la voie intraveineuse soit largement la plus utilisée en TDM, il est également possible, entre autres, de faire ingérer le produit de contraste, de l'injecter en intrathécal (pour les recherches de fistule ostéodurale par cisternoscanner) ou de l'injecter directement au sein d'une cavité par ponction directe, ou par l'intermédiaire d'un drain ou d'une sonde.
Comme pour tout médicament, la prescription des produits de contraste impose la recherche préalable de contre-indications. En cas d'urgence, l'indication prime généralement sur la contre-indication, sous réserve de la mise en œuvre des moyens permettant la prise en charge des éventuelles complications (dialyse ou prise en charge d'une réaction allergique).
On notera, parmi les évolutions technologiques, l'utilisation actuellement du scanner spectral qui permet de décomposer le rayon X en différentes énergies. Ainsi, en fonction de l'énergie (keV), il est possible de distinguer les structures osseuses et calciques, les vaisseaux, les tissus mous en réduisant l'utilisation de produit de contraste iodé.
Effets indésirables, contre-indications et interactions
Des fiches pratiques de recommandation ont été rédigées par le Comité interdisciplinaire de recherche et de travail sur les agents de contraste en imagerie (CIRTACI), à destination des radiologues et des médecins prescripteurs. Ces fiches sont disponibles sur le site de la Société française de radiologie (SFR) [1]. Les effets négatifs liés à l'injection intravasculaire de produits de contraste iodés sont fréquents, certains d'entre eux étant parfaitement bénins.
Réactions non allergiques
Réaction physiologique à l'injection de produit de contraste
L'injection du produit de contraste augmente l'osmolalité plasmatique, ce qui provoque un appel d'eau depuis les cellules endothéliales et une vasodilatation diffuse. L'effet ressenti est celui d'une bouffée de chaleur diffuse, sans caractère pathologique, et dont on prévient systématiquement le patient afin qu'il ne s'inquiète pas inutilement au moment de l'injection. Les autres signes souvent ressentis au cours de l'injection sont un goût métallique et une fausse sensation de miction.
Réaction d'hypersensibilité immédiate non immunoglobulines E (IgE)-dépendante
L'injection peut par ailleurs provoquer une dégranulation des polynucléaires basophiles, la libération d'histamine provoquant alors des démangeaisons, voire une urticaire et, éventuellement, nausées et vomissements. Cette hypersensibilité immédiate non IgE dépendante (histaminolibération non spécifique) n'est pas de type allergique et est considérée comme mineure. Elle est plus fréquente à débit d'injection élevé et si le produit de contraste a une concentration élevée. Certains patients sont davantage sujets à ce type de réactions non allergiques, notamment les patients présentant un terrain atopique ou les patients asthmatiques (aggravation des symptômes respiratoires). Cette réaction ne contre-indique pas l'injection ultérieure de produit de contraste mais justifie une surveillance au décours de l'examen afin de ne pas méconnaître une réaction allergique vraie. Une préparation par antihistaminiques H1 est efficace dans ce cas.
Réactions allergiques : réactions d'hypersensibilité immédiate allergique
Il s'agit alors de réactions d'hypersensibilité immédiate IgE-dépendantes, impliquant une reconnaissance spécifique des molécules du produit de contraste par des IgE spécifiques produites lors d'une première phase de sensibilisation. Cette reconnaissance immunologique spécifique entraîne une activation des mastocytes et des polynucléaires basophiles provoquant une réaction allergique vraie de sévérité variable, habituellement dans les premières minutes suivant l'injection. Les réactions allergiques ont été décrites et classées en fonction de leur sévérité par Ring et Messmer et sont présentées dans le tableau 4.1 [2].
Tableau 4.1
Classification de Ring et Messmer des réactions allergiques [2]
|
Grade |
Symptômes |
|
Signes cutanéomuqueux Érythème, urticaire avec ou sans angio-œdème |
|
| II |
Atteinte multiviscérale modérée Cardiovasculaire : hypotension, tachycardie Respiratoire : toux, dyspnée Gastro-intestinal : nausées, vomissements Téguments : érythème, urticaire, angio-œdème |
|
III |
Choc anaphylactique, défaillance mono-/multiviscérale sévère Cardiovasculaire : état de choc, tachycardie, voire bradycardie, troubles du rythme Respiratoire : bronchospasme, détresse respiratoire Gastro-intestinal : douleurs abdominales Téguments : apparition parfois retardée, après restauration hémodynamique |
|
IV |
Arrêt cardiorespiratoire |
Il est donc recommandé d'adresser le patient à une consultation d'allergologie en cas de réaction consécutive à l'injection de produit de contraste iodé. Tout produit de contraste engendrant une réaction positive aux tests cutanés devra être contre-indiqué, mais pourra être substitué par une autre spécialité de produit de contraste (absence de réactions croisées).
Il est important de rappeler que les réactions allergiques vraies ne sont pas provoquées par l'atome d'iode (déjà présent dans la thyroïde) : l'allergie à l'iode n'existe pas ! Par conséquent, il ne faut pas contre-indiquer l'injection de produit de contraste chez un patient prétendument « allergique » aux produits de la mer ou à la polyvidone iodée (Bétadine®) qui n'ont aucune communauté antigénique avec les produits de contraste iodés. L'allergie est liée aux molécules associées à l'iode, qui varient d'un produit à l'autre.
D'ailleurs, il n'existe pas de réaction allergique croisée entre les différents produits de contraste iodés disponibles sur le marché. Lors des tests allergologiques suivant une réaction d'hypersensibilité aux produits de contraste, différentes spécialités sont testées, même si la probabilité d'être authentiquement allergique à deux spécialités différentes est très faible. Une fois la spécialité responsable identifiée, il n'existe pas de contre-indication fondée à utiliser une autre spécialité iodée (d'autant qu'elle aura en général également été évaluée lors des tests allergologiques).
Néphrotoxicité et insuffisance rénale
Les produits de contraste iodés sont éliminés par filtration rénale. Ils peuvent induire une néphropathie au produit de contraste définie par une élévation de plus de 30 % de la créatininémie de base ou par une oligurie survenant dans les 72 heures suivant l'injection. Le dosage de la créatininémie est donc indispensable avant toute injection intraveineuse de produit de contraste iodé.
Les patients présentant un débit de filtration glomérulaire (DFG) inférieur à 60 mL/min/1,73 m², une néphropathie diabétique, un myélome avec protéinurie, un traitement néphrotoxique (anti-inflammatoires non stéroïdiens [AINS], sels de platine, etc.) ou un âge supérieur à 65 ans sont davantage susceptibles de développer une néphropathie induite par les produits de contraste et représentent une population à risque.
En cas d'insuffisance rénale sévère (DFG < 30 mL/min/ 1,73 m²), l'injection de produit de contraste est en principe contre-indiquée. La prescription, en particulier dans la population à risque décrite plus haut, devra être réfléchie et une méthode d'exploration alternative (échographie, IRM) sera privilégiée lorsque cela sera possible. Si l'injection est malgré tout nécessaire, certaines précautions devront être mises en place : injection réalisée si possible à 7 jours d'intervalle de l'administration d'un autre médicament néphrotoxique (AINS, cure de chimiothérapie) et délai d'au moins 3 à 5 jours entre deux injections de produit de contraste iodé.
En cas d'insuffisance rénale modérée, des mesures de néphroprotection seront nécessaires : hydratation suffisante encadrant l'injection (2 litres per os entre les 24 heures précédant et les 24 heures suivant l'injection), de préférence par une eau riche en sodium et en bicarbonate.
Les antécédents de transplantation rénale doivent faire considérer le patient comme insuffisant rénal sévère (contre-indication) tandis que l'hémodialyse ne justifie pas de précaution particulière.
La metformine est une molécule à élimination rénale favorisant le métabolisme anaérobie et la production d'acide lactique. Les patients diabétiques de type II sous metformine devront interrompre leur traitement après l'injection de produit de contraste. Si une néphropathie induite par les produits de contraste survient (la néphropathie diabétique étant l'un des facteurs de risque), la metformine n'est plus éliminée et s'accumule dans l'organisme au fil des prises du traitement. Il en résulte une dangereuse acidose lactique, qui peut être prévenue par la suspension systématique du traitement après injection de produit de contraste. La réintroduction de la metformine est autorisée après contrôle de la créatininémie à 48 heures. Il n'est en revanche plus recommandé d'interrompre la metformine en amont de l'examen [1].
Perturbation du métabolisme thyroïdien
Malgré l'incorporation de l'iode à des molécules benzéniques, des iodures libres sont susceptibles d'être captés par la thyroïde et d'induire une hyper- ou une hypothyroïdie. Cela est plus fréquent chez le nouveau-né et chez les patients présentant une affection thyroïdienne (hyperthyroïdie non équilibrée).
Une hyperthyroïdie non contrôlée, d'autant que le patient est âgé ou souffre d'une maladie cardiaque, contre-indique l'injection de produit de contraste iodé du fait du risque de cardiothyréose induite. Les patients souffrant d'hyperthyroïdie mais suivant un traitement par antithyroïdiens ne relèvent en revanche d'aucune précaution spécifique.
L'administration de produits de contraste iodés peut enfin perturber le métabolisme d'autres agents pharmacologiques. L'iode libre dans le produit de contraste iodé est capté par la thyroïde qu'il sature, empêchant ainsi par compétition la fixation de l'iode 123 ou de l'iode 131. Ainsi, lorsqu'une scintigraphie thyroïdienne ou qu'un traitement par iode radioactif sont nécessaires, ils doivent être réalisés avant une TDM avec injection de produit de contraste iodé et non après.
Grossesse
Aucune étude animale ne met en évidence d'effet tératogène des produits de contraste iodés. Néanmoins, comme souvent lorsqu'il s'agit de ce terrain spécifique, le principe de précaution est de mise (et se surajoute aux problèmes liés à la radioprotection chez la femme enceinte exposés plus loin). Autant que possible, la réalisation des examens sera reportée après l'accouchement. Cependant, si l'examen est urgent et ne peut pas être reporté, la patiente, le demandeur et l'équipe d'obstétrique s'accordent sur la réalisation de l'examen et doivent être informés de l'injection nécessaire de produit de contraste iodé ainsi que du risque théorique d'hypothyroïdie néonatale.
Acquisition multiphase
L'injection de produit de contraste s'effectue habituellement sur une voie veineuse périphérique posée au membre supérieur. Le produit est administré le plus souvent à l'aide d'une seringue automatique permettant de délivrer un volume et un débit prédéfinis, sur une durée par conséquent aisée à calculer. Le bolus de contraste suit le sens physiologique de la circulation sanguine : le produit transite par les veines du membre supérieur pour rejoindre la veine cave supérieure se drainant dans l'atrium droit. Le contraste arrive ensuite dans le ventricule droit et opacifie les artères pulmonaires puis les veines pulmonaires avant de revenir à l'atrium gauche et au ventricule gauche. Le contraste est alors éjecté au sein de l'aorte, puis se distribue à tous les organes par le biais des branches artérielles partant de l'aorte. Après le rehaussement parenchymateux qui nécessite un délai variable d'un organe à l'autre, le retour veineux s'effectue par les veines systémiques et le réseau porto-mésentérique, et se collecte finalement dans les systèmes caves supérieur et inférieur. L'élimination est principalement rénale et a minima biliaire (part majorée en cas d'insuffisance rénale).
En fonction du délai fixé pour le déclenchement de l'acquisition, l'exploration pourra s'effectuer à différents moments de la chronologie (figure 4.10 et 4.11). Les différents temps sont détaillés dans le tableau 4.2. Les acquisitions peuvent être répétées à différents délais après le début d'une seule injection afin d'obtenir plusieurs « temps » ou phases sans recourir à des injections itératives. Le choix des phases et de leur nombre relève de la responsabilité et de la décision du radiologue, et est guidé par l'indication pour laquelle le patient a été adressé. Même s'il n'y a pas de nouvelle injection de produit de contraste, chaque phase supplémentaire s'accompagne d'une nouvelle acquisition et donc d'une augmentation de la dose délivrée au patient.
Tableau 4.2
Les différents temps de l'injection en TDM
|
Temps |
Délai* |
Opacification |
Exemples |
|
Phlébographique |
10 à 15 s |
Réseau veineux du membre injecté |
Perméabilité veineuse |
|
Artériel pulmonaire |
20 à 25 s |
Artères pulmonaires |
Embolie pulmonaire |
|
Artériel |
30 à 35 s |
Artères systémiques |
Dissection aortique Carcinome hépatocellulaire |
|
Cortical |
40 s |
Cortex rénal |
Carcinome rénal |
|
Portal |
80 à 90 s |
Organes pleins (parenchymographie) Réseau porto-mésentérique |
Lésions secondaires Étude de wash-out |
|
Tubulaire |
90 à 100 s |
Néphrographie |
Abcès rénal |
|
Tardif |
> 3 min |
Organes pleins Fibrose |
Etude de wash-out Infarctus du myocarde |
|
« Excréteur » |
7 min 30 s |
Voies urinaires excrétrices |
Lésion urothéliale |
* Les délais sont définis à partir du début de l'injection de produit de contraste. Les valeurs sont données à titre indicatif et peuvent varier, notamment en fonction de l'indication, des habitudes du radiologue, du débit et de la concentration de produit de contraste, de l'état hémodynamique du patient et de son âge, du site d'injection et du type de machine TDM utilisée.
Progression du bolus de produit de contraste dans les vaisseaux thoraciques.
Le bolus de contraste suit le sens physiologique de la circulation sanguine. En 1, acquisition sans injection sur les gros vaisseaux thoraciques. Le produit est injecté par une veine du membre supérieur droit. En 2, le produit rejoint la veine cave supérieure (flèche blanche) et opacifie l'atrium droit puis le ventricule droit (non montrés) puis il opacifie l'artère pulmonaire et ses branches (flèche blanche en pointillés). Il passe ensuite dans la circulation pulmonaire puis les veines pulmonaires avant d'opacifier l'atrium et le ventricule gauches. En 3, le produit est éjecté dans l'aorte thoracique ascendante (flèche noire) et descendante (flèche noire en pointillés). Chaque étape correspond à une nouvelle acquisition qui suit la circulation du produit de contraste dans les structures vasculaires.
Dessin : Eléonore Blondiaux.
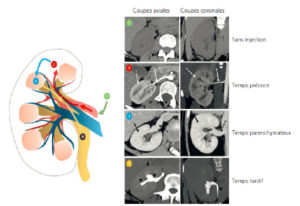
Rehaussement parenchymateux : exemple du rein.
En 1 : acquisition sans injection de produit de contraste. En 2 : à partir de l'aorte, le produit de contraste se distribue aux branches artérielles aortiques : l'artère rénale est opacifiée (flèche blanche) et dans le même temps le cortex rénal (flèche blanche en pointillés). En 3 : le rehaussement parenchymateux (cortex + médullaire) s'effectue selon un délai variable d'un organe à l'autre (flèche noire), le retour veineux s'effectue par la veine rénale (flèche noire en pointillés) et se collecte finalement dans le système cave inférieur. En 4 : l'élimination du produit de contraste est principalement rénale, ce qui permet d'obtenir une opacification des calices et de l'uretère (pointes de flèche).
Dessin : Eléonore Blondiaux.
Lorsque l'objectif est d'obtenir une opacification optimale du réseau artériel, il est courant d'utiliser une technique de suivi du bolus. Il s'agit de la répétition d'une coupe en mode séquentiel à un niveau anatomique donné, de manière à suivre en temps réel l'opacification progressive d'une artère. L'acquisition est déclenchée lorsque la densité au sein de l'artère sélectionnée franchit un seuil de densité Hounsfield prédéfini.
Radioprotection en TDM
Devant le nombre croissant d'examens TDM, le respect des principes de radioprotection détaillés dans le chapitre 6 est fondamental.
Le recours aux explorations utilisant des rayonnements ionisants doit répondre au principe as low as reasonably achievable (ALARA) que l'on peut traduire littéralement par « aussi faible que raisonnablement possible ». En d'autres termes, lorsque le recours à la TDM est nécessaire et justifié, l'examen doit délivrer la dose la plus faible possible permettant de répondre à la question posée. La limitation du nombre de zones anatomiques explorées, la réduction du nombre d'acquisitions à différents temps après une injection de produit de contraste et l'adaptation des paramètres d'acquisition permettent de limiter la dose délivrée. Ces principes s'appliquent avec d'autant plus d'attention chez la femme enceinte et chez l'enfant (voir chapitre 31). La mention de cette dose délivrée au patient sur le compte-rendu de scanner est une obligation médico-légale.
Indications cliniques
Les principales indications de la TDM sont détaillées dans les chapitres suivants, mais on notera en particulier :
- l'exploration du corps entier (crâne au pelvis en général) en urgence des patients polytraumatisés ;
- l'exploration cérébrale : même si l'IRM est à privilégier le plus souvent, sa disponibilité plus faible et la nécessité d'une parfaite immobilité en IRM laissent une place importante à la TDM ;
- l'étude du parenchyme pulmonaire et plus globalement du thorax ;
- l'exploration de l'abdomen, souvent couplée à celle du pelvis ;
- l'exploration du squelette (souvent localisée à une zone d'intérêt) ;
- l'exploration du réseau vasculaire ;
- la radiologie interventionnelle guidée par TDM : de multiples acquisitions centrées sur la zone d'intérêt sont alors réalisées au cours d'un geste diagnostique (biopsie, etc.) ou thérapeutique (infiltration, drainage, destruction de tumeur) par voie percutanée.
Conclusion
Les progrès technologiques de la TDM permettent de réaliser en routine des acquisitions de volumes importants en quelques secondes reconstruits en coupes inframillimétriques. La diffusion de cette technique la rend facilement disponible, en particulier dans le cadre de l'urgence.
Néanmoins, son accès aisé tend à accroître le nombre d'examens avec un impact non seulement économique participant à l'augmentation des dépenses de santé (voir chapitre 14), mais également en termes dosimétriques (environ trois quarts de la dose effective annuelle sont délivrés à la population par les 10 % des examens d'imagerie médicale que représente la TDM – voir chapitre 6). La demande d'examens complémentaires doit donc toujours être guidée par l'examen clinique, une exploration en imagerie ne devant en principe pas être effectuée avant une évaluation clinique.
L'examen TDM nécessitant fréquemment une injection de produit de contraste iodé, la recherche de contre-indications lors de la prescription et celle de complications après la réalisation de l'examen doivent être systématiques.
Essentiel à retenir
- Modalité d'imagerie en coupes : multiples projections angulaires autour du patient ; reconstructions informatiques (imagerie numérique) ; acquisitions volumiques : post-traitement de l'image (reconstruction MPR par exemple).
- Utilisation de rayons X : interaction avec le milieu traversé selon les densités rencontrées ; terrains particuliers : grossesse, pédiatrie.
- Examen accessible et rapide : apnée souvent nécessaire, coopération du patient nécessaire ; exploration multiphasique en quelques minutes (quelques secondes par acquisition) ; modalité d'imagerie de choix en situation urgente ;
- Prescription médicale par le radiologue indispensable : guidée par l'examen clinique (cibler la recherche, question précise) ; contre-indications : produits de contraste, grossesse ; complications liées à l'injection : allergie, dysthyroïdie, néphrotoxicité ; aide pour la demande des examens d'imagerie : Guide du bon usage (http://gbu.radiologie.fr/).
Références
- Comité interdisciplinaire de recherche et de travail sur les agents de contraste en imagerie (CIRTACI), pour la SFR. Fiches pratiques pour l'utilisation des produits de contraste [Internet], 2004. www.sfrnet.org http://www.sfrnet.org/sfr/societe/5-groupes-de-travail/qualite-securite-gestion-des-risques/agents-de-contraste-cirtaci/index.phtml.
- Ring J, Messmer K. Incidence and severity of anaphylactoid reactions to colloid volume substitutes. Lancet 1977 ;1:466–9.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 3 - Radiographie
P.A. Gondim Teixeira et G. Grimon
Plan du chapitre
- Introduction
- Principes fondamentaux
- Détection des rayons X transmis, fabrication de l'image radiographique
- Représentation des images
- Artefacts et distorsion de l'image
- Indications et limites
- Conclusion
Objectifs
- Connaître les principes physiques des radiographies standard.
- Connaître la base de la formation de l'image radiographique.
- Connaître les principales indications et les limites de la radiographie par projection.
Introduction
Les radiographies sont réalisées grâce aux rayons X qui sont des photons, particules associées au rayonnement électromagnétique, au même titre que la lumière visible, l'ultraviolet (UV), l'infrarouge, les ondes radio, les micro-ondes ou les rayons γ.
Sans revenir sur la dualité onde-corpuscule, le photon peut être décrit comme une onde électromagnétique, où un champ électrique est couplé à un champ magnétique qui lui est orthogonal, oscillant à la même fréquence, s'engendrant mutuellement et se propageant dans le vide avec une célérité (c) = 3.108 m/s.
Le faisceau de rayons X peut traverser ou interagir avec les différents tissus traversés en fonction de ses propres caractéristiques et de celles du tissu exposé : une fraction du faisceau est arrêtée ou déviée par le tissu (on dit que le faisceau est atténué). Il existe quatre contrastes naturels en imagerie radiologique standard : l'air, la graisse, l'eau et l'os. Des agents de contraste artificiels peuvent également être introduits.
Dans ce chapitre seront présentés les principes de base de la radiographie par projection, la formation de l'image et ses artefacts. Les indications les plus courantes et les limites de la radiographie standard seront ensuite abordées.
Principes fondamentaux
Les radiographies sont réalisées à l'aide d'un appareil à rayons X. Le principe général, en simplifiant à l'extrême, revient à celui des ombres chinoises où une source lumineuse éclaire un objet qui atténue les photons visibles et crée une ombre qui est projetée sur un écran. En réalité, l'atténuation des photons X par les tissus explorés n'est pas en tout ou rien, et on pourrait plutôt prendre l'analogie d'une bobine de cinéma qui atténue plus ou moins la lumière blanche qui la traverse, l'image ainsi formée étant projetée sur un écran récepteur. Ces simplifications permettent de comprendre que l'image finale résulte des propriétés successives de la source de photons, des caractéristiques de la lumière émise, des interactions à l'intérieur de la cible traversée, du type et des propriétés du récepteur, mais aussi des conditions géométriques de l'ensemble.
Présentation de la chaîne de détection
Les composants principaux d'un système d'imagerie utilisant les rayons X sont illustrés sur la figure 3.1.
Le tube à rayons X (tube de Coolidge, encore appelé tube à anode tournante) crée le faisceau de rayons X (figure 3.2). Le principe est le suivant : un faisceau d'électrons est fortement accéléré vers une anode de tungstène. Ces électrons devenus très énergétiques interagissent avec la cible (tant avec ses électrons qu'avec les noyaux), et perdent leur énergie dont une partie est transformée en rayons X. Ce faisceau X émis peut être modulé ensuite par différentes collimations et différents filtrages en sortie de tube.

Principaux composants d'une installation permettant la réalisation de radiographies standard (A, B).
Schéma représentatif du tube à rayons X (tube de Coolidge).
Dessin : Cyrille Martinet.
Le faisceau de rayons X traverse d'abord l'air sans modification, puis l'objet étudié (en général le patient, mais ce peut être aussi une pièce anatomique, ou une mire par exemple). Le faisceau y est atténué différemment selon les différentes densités des tissus ; on peut aussi modifier cette atténuation en introduisant des produits de Z élevé dits « de contraste ».
L'effet photoélectrique est responsable de l'atténuation du faisceau incident et de la qualité de l'image radiologique, mais un autre effet, l'effet Compton, intervient également et contribue à la dégradation de cette image. Après avoir traversé le patient, le faisceau atténué constitue l'« image radiante ». Ce faisceau est ensuite capté par un détecteur qui fournit l'image finale. Ces différentes étapes sont détaillées ci-dessous.
Production des rayons X
Première étape : créer un faisceau d'électrons dans une ampoule sous vide
Comme dans le filament « historique » de la lampe à incandescence, un courant électrique très précisément régulé en intensité provoque l'échauffement d'un filament (cathode, généralement en tungstène pour des raisons de solidité à haute température). La chaleur provoque une agitation des électrons, dont une proportion acquiert une énergie suffisante pour être éjectée du filament. L'ordre de grandeur du courant d'électrons émis est de 10 à 20 % de celui du courant de chauffe.
Faisceau d'électrons fortement accélérés vers l'anode génératrice des rayons X
Une tension élevée (40 000 à 150 000 volts, soit 40 à 150 kilovolts [kV]) et parfaitement régulée entre le filament cathodique (négatif) et l'anode (positive) accélère les électrons issus du filament vers l'anode. Les caractéristiques essentielles de ce faisceau d'électrons sont :
- son intensité en milliampères (mA) (proportionnelle au courant utilisé pour chauffer le filament) et sa durée (en secondes) : le produit (en mA· s) détermine le nombre d'électrons, donc à une charge totale qu'on pourrait théoriquement exprimer en millicoulombs (mC) ;
- son énergie cinétique (Ec) en kilo-électron-volts (keV) : l'électron acquiert une énergie correspondant à la tension d'accélération (par exemple 150 keV pour une tension d'accélération de 150 kV).
Ces caractéristiques influencent fortement les images radiologiques.
Interactions sur l'anode du tube
Les électrons percutent l'anode au niveau d'une zone appelée foyer. L'anode est un bloc métallique, généralement en tungstène. L'électron incident étant une particule chargée, il interagit de manière « obligatoire » à distance, sans nécessité d'un réel « choc » avec les constituants chargés de la cible. Les interactions électrons-matière se font soit avec les électrons de la cible, soit avec les noyaux :
- par interaction sur un électron de la cible : l'électron incident repousse et arrache un électron du tungstène hors de sa couche électronique. Il s'ensuit un phénomène de fluorescence : le trou créé est immédiatement comblé par un électron d'une couche périphérique moins lié au noyau, avec émission d'un photon Efluorescence dont l'énergie correspond exactement à la différence d'énergie entre les deux couches, selon un spectre d'émission de raies caractéristique de l'anode ;
- par interaction sur un noyau du tungstène : le passage de l'électron incident au voisinage du noyau positif génère une force électromagnétique d'attraction. L'électron est freiné, émettant l'énergie perdue en « rayonnement de freinage » (en allemand, « bremsstrahlung »). L'énergie de ce rayonnement X dépend de la distance électron incident-noyau, qui peut être très grande ou très petite ; le spectre X produit est donc un spectre continu. Quand le choc est frontal, toute l'énergie de l'électron incident est rayonnée ; l'énergie maximale des photons émis est donc numériquement égale à la tension d'accélération du tube.
Ces deux types de rayonnement (spectre de raies par fluorescence et spectre continu par freinage) constituent le faisceau initial de rayons X.
Quelle que soit son origine, fluorescence ou freinage, l'émission de rayons X est un phénomène peu fréquent : 99 % de l'énergie mise en jeu se dissipe sous forme de chaleur et 1 % seulement sous forme de rayons X. La chaleur produite est donc importante, entraînant des contraintes technologiques lourdes : choix du tungstène (matériau résistant à la chaleur), anode tournante pour répartir le foyer thermique sur une couronne, constant refroidissement par un bain d'huile circulant.
Trois paramètres utilisés pour régler la qualité et l'intensité du faisceau de rayons X
Ces paramètres sont les suivants :
- la tension du tube (ou « kilovoltage ») en kV, qui détermine l'énergie du rayonnement X produit (on pourrait dire la qualité des photons X) ;
- l'intensité électrique (ou « milliampérage ») en mA ;
- le temps d'exposition en secondes (s).
Les deux derniers paramètres sont le plus souvent réunis par leur produit exprimé en mA·s qui détermine la quantité de photons X produits par seconde.
La gestion optimale assure usuellement le plus petit temps de pose en choisissant l'intensité maximale du courant (en mA) que le tube peut supporter sans dommage.
Aspects géométriques du faisceau
La taille non ponctuelle du foyer d'émission des rayons X engendre un flou géométrique qui altère la qualité de l'image. Ce flou peut être réduit par une diminution de la taille apparente du foyer grâce à une inclinaison plus importante de l'anode par rapport à l'axe de sortie des photons (voir figure 3.2).
Trajet des rayons X entre la cathode et le patient : collimation
La production de rayons X au niveau du foyer est multidirectionnelle ; des rayons X partent donc dans toutes les directions de l'espace. Pour limiter cette diffusion, puisque seul le rayonnement en direction de l'objet étudié est utile, des filtres en plomb (volets) et un blindage en béryllium laissant une fenêtre dans la direction de la cible sont utilisés. Les rayonnements émis dans une autre direction que celle du patient sont ainsi extrêmement atténués.
Entre la sortie du tube et le patient, le trajet des rayons X n'est, comme celui de la lumière, ni atténué ni dévié.
Interaction des rayons X chez le patient
De la même manière qu'au cinéma la pellicule cinématographique arrête plus ou moins la lumière de la lanterne de projection et crée l'image, le corps du patient atténuera plus ou moins le faisceau de rayons X, créant le contraste de l'image radiographique.
Dans le patient, les rayons X interagissent au niveau des électrons de la matière. On observe deux phénomènes sans pouvoir privilégier l'un ou l'autre : l'effet photoélectrique (phénomène à l'origine de la formation des images radiographiques) et la diffusion (effet Compton).
Effet photoélectrique
L'effet photoélectrique se produit quand le photon transfère toute son énergie à un électron (figure 3.3). Celui-ci est arraché de sa couche électronique, à condition que l'énergie du photon soit supérieure à l'énergie de liaison de l'électron. Il est nécessaire que l'électron soit au voisinage immédiat du noyau qui va pouvoir « encaisser » une énergie cinétique de recul ; cela se produit, d'une part, sur les électrons très liés (donc avec une énergie de liaison non négligeable) et, d'autre part, pour des énergies faiblement supérieures à cette énergie de liaison, qui tient l'électron lié au noyau. Comme dans la nature, le volume des atomes varie peu en fonction de Z. Les atomes de Z élevé avec beaucoup d'électrons (par exemple le calcium des os, l'iode d'un produit de contraste) auront beaucoup d'électrons au voisinage du noyau, candidats à cet effet photoélectrique.
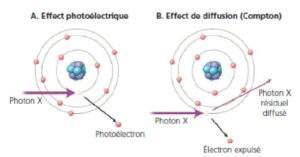
Schéma démontrant les effets photoélectrique et Compton.
A. Effet photoélectrique : un photon X frappe un électron d'une couche profonde de l'atome ; le photon disparaît et l'électron absorbe toute son énergie. B. Effet Compton : un photon X frappe un électron ; une partie de l'énergie du photon entraîne l'expulsion d'un électron d'une couche superficielle et l'ionisation de l'atome ; le photon X résiduel est d'énergie plus faible et subit une déviation de sa trajectoire, pouvant dégrader l'image sur le détecteur.
Dessin : Cyrille Martinet.
L'électron arraché part avec une énergie cinétique égale à l'énergie du photon X diminuée de l'énergie de liaison ; il sera arrêté en quelques millimètres.
La probabilité d'interaction photoélectrique dépend :
• du milieu, essentiellement de sa densité en électrons, donc du numéro atomique Z des atomes qui le composent. Plus le milieu est dense, plus la probabilité d'effet photoélectrique est importante ; elle est donc plus importante pour l'os que pour les muscles (ou l'eau), la graisse ou l'air (dans l'ordre de probabilité d'interaction décroissante) ;
• de l'énergie des rayons X : les rayons X faiblement énergétiques ont une probabilité d'interaction très supérieure aux autres, à la condition naturellement qu'ils aient une énergie supérieure à l'énergie d'ionisation des couches profondes du noyau cible. Un faisceau de rayons X de faible énergie est donc très fortement atténué dans le patient.
Surtout, la différence d'atténuation (différence entre les coefficients d'atténuation de deux tissus d'atténuation voisine) augmente fortement quand l'énergie des rayons X diminue ; le contraste est alors fortement augmenté (au prix d'une atténuation globale plus importante comme expliqué précédemment). A contrario, des rayons X de haute énergie, dits « durs », sont moins absorbés, mais génèrent une image moins contrastée.
Effet Compton
L'effet Compton se produit quand le transfert d'énergie est partiel, entraînant, d'une part, l'expulsion d'un électron avec une partie de l'énergie et, d'autre part, la diffusion d'un photon d'énergie inférieure à l'énergie initiale selon un angle aléatoire plus ou moins grand (pouvant atteindre 180° ; on dit alors rétrodiffusé). Il n'y a pas d'énergie de recul, donc pas de nécessité d'être proche du noyau ; l'effet Compton se produit ainsi préférentiellement sur les électrons périphériques peu liés, plus nombreux.
Le photon diffusé a plusieurs inconvénients en radiodiagnostic :
- il peut continuer vers l'avant en direction du détecteur, à l'origine d'un flou des images appelé voile de diffusion ;
- il peut être fortement diffusé dans une direction hors du champ d'exposition directe. L'opérateur pourra donc recevoir une dose de rayonnement ionisant rétrodiffusé, qui peut également contourner des écrans protecteurs. De la même manière que la lumière d'une seule ampoule éclaire toute une pièce par réflexions, les rayons X diffusés vont irradier l'ensemble de la pièce.
L'effet Compton s'observe avec une probabilité relative plus importante pour des énergies élevées. Aux énergies utilisées en radiodiagnostic, l'effet Compton est quatre à cinq fois plus fréquent que l'effet photoélectrique. À titre d'exemple : une radiographie pulmonaire doit 50 % de sa densité aux photons diffusés, une radiographie de l'abdomen sans préparation (ASP) comporte 90 % de photons diffusés, mais une mammographie à 25 keV, « seulement » 37 %.
Pour limiter l'effet Compton, une grille antidiffusante est utilisée ; il s'agit d'une mince grille constituée de fines lames de plomb de quelques millimètres de largeur et quelques centièmes de millimètres d'épaisseur, disposées parallèlement sur un cadre sur toute la longueur du champ du film radiologique, de telle sorte qu'elles soient orientées vers le tube à rayons X. La majorité du diffusé oblique est arrêtée par l'épaisseur de la lame, au prix de l'atténuation d'une faible proportion des rayons X contribuant à la formation de l'image (compensée par une augmentation des mA ∙ s). Pour éviter les fines lignes noires parallèles correspondant à cette atténuation, le cadre est animé d'un mouvement transversal (grille « Potter », du nom de l'inventeur de cet artifice).
Pour résumer, l'atténuation résulte donc des deux interactions possibles entre les photons incidents et la matière traversée (effet photoélectrique et effet Compton). La probabilité globale d'interaction est appelée « coefficient linéique d'atténuation », et s'exprime comme une probabilité d'interaction (nombre, sans dimension) par unité de distance (généralement en cm–1). Cette atténuation suit une loi exponentielle décroissante fonction de l'épaisseur des tissus traversés par le faisceau.
Influence des paramètres sur la formation de l'image
Pour obtenir une image, l'opérateur peut agir sur deux paramètres modifiant le contraste de l'image :
- le kilovoltage (kV) (ou tension) : les rayons de basse énergie donnent des contrastes plus visibles mais au prix d'une atténuation globale plus importante ;
- le produit mA ∙ s (la quantité de photons X produits) : pour un voltage donné et un patient donné, cette quantité conditionne l'exposition correcte du détecteur, la surexposition (image trop noire : trop de photons) ou la sous-exposition (image trop blanche : pas assez de photons).
La figure 3.4 illustre les modifications du contraste chez la même personne en fonction des paramètres utilisés : du même objet, la radiographie peut fournir des images différentes.
Deux radiographies de thorax de face prises avec des paramètres différents chez une patiente de 24 ans victime d'un traumatisme.
A. Cliché réalisé pour la visualisation des structures osseuses (rachis, gril costal) avec les paramètres d'exposition suivants : 60 kV ; 400 mA ; temps d'exposition : 140 ms.
B. Cliché de la même patiente réalisé pour l'évaluation du parenchyme pulmonaire avec les paramètres suivants : 120 kV ; 320 mA ; temps d'exposition : 20 ms. Noter une inspiration différente entre les deux clichés.
Influence de la taille du champ exploré
L'effet Compton qui est produit sur un volume exposé entraîne un voile de diffusion sur le détecteur ; l'augmentation de la largeur explorée (outre qu'elle augmente la dose au patient) va également augmenter de manière proportionnelle ces photons diffusés. L'augmentation de la surface explorée (largeur × hauteur) augmente considérablement le Compton, alors que l'effet photoélectrique à l'origine de l'image radiologique est inchangé. Élargir inconsidérément le champ d'exploration de part et d'autre de la structure explorée dégrade l'image finale, augmente la dose au patient, et augmente la dose reçue professionnellement par tous les opérateurs présents.
Détection des rayons X transmis, fabrication de l'image radiographique
Les images sont obtenues par l'exposition d'un système de détection au faisceau de rayons X après traversée de la cible.
Films photographiques et couple écran renforçateur-film
Historiquement, les films radiographiques étaient fabriqués avec des microcristaux de sels d'argents ioniques Ag+ qui étaient réduits en Ag0 sous l'effet des électrons arrachés par les rayons X. Comme en photographie conventionnelle, on utilisait ensuite le processus chimique photographique (amplification par un révélateur, fixateur, lavage des Ag+) pour révéler l'image jusque-là latente. On voyait alors un noircissement du film, dû à l'apparition de grains d'argent métal, partout où il avait été exposé par les rayons X. C'est pourquoi les régions situées derrière un matériau atténuant, comme l'os, apparaissant blanches sur le film, ont été appelées « opacités » (opaques aux rayons X), tandis que les régions noires peu atténuantes ont été appelées « clartés » (les rayons X passent à travers).
La sensibilité des films photographiques était très faible, de l'ordre de quelques pourcents. Elle a été secondairement améliorée par l'adjonction d'un « écran renforçateur », couches de sels fluorescents à Z élevé situées de part et d'autre du film, qui arrêtent d'avantage les rayons X et les convertissent en photons lumineux qui impressionnent les sels d'argent. L'intensification est de × 10 à × 20 au prix d'une petite perte de netteté.
L'utilisation de ces systèmes est quasi abandonnée compte tenu des possibilités limitées de post-traitement des images obtenues, de la nécessité de consommables (films, solutions de traitement peu écologiques), du prix des sels d'argent, ainsi que des difficultés de stockage et de conservation des radiographies.
Ils sont remplacés par les détecteurs non argentiques dont quatre types sont présentés ci-dessous.
Écran radioluminescent à mémoire (computed radiography [CR])
Dans ce système, le film est remplacé par un écran photostimulable qui conserve pendant plusieurs heures les modifications provoquées par l'exposition aux rayons X. Après exposition aux rayons X, il existe sur la plaque photostimulable une image dite « latente » qui sera ensuite révélée par le balayage d'un faisceau laser, créant d'emblée une image numérisée. Ce système est largement utilisé car il est peu coûteux.
Capteurs plans (digital radiography [DR])
Dans ce système, les rayons X sont détectés par les interactions qu'ils créent dans un détecteur soit directement sur un circuit imprimé de silicium (CMOS comparable à celui d'un appareil de photographie numérique), soit indirectement après scintillation sur un cristal de Z élevé, donc de rendement meilleur. Le signal résultant est un signal électrique. Ce type de système est très sensible aux photons X, ce qui permet de réduire de façon significative la dose délivrée au patient. L'utilisation des capteurs plans permet aussi la réalisation de techniques comme la double énergie et la tomosynthèse, augmentant ainsi la performance diagnostique des radiographies (mais systèmes assez coûteux).
Amplificateur de luminance et télévision en circuit fermé
Les rayons X sont détectés par un écran fluorescent qui est vu par une caméra « classique » de type caméra de télévision. Ce système, en plus de réaliser des radiographies statiques, est capable de produire des images successives en temps réel à une cadence permettant la visualisation du mouvement sans scintillement, ni rémanence (en pratique, 25 images ou 50 images/seconde). Les amplificateurs de luminance sont souvent utilisés pour guider les gestes en radiologie interventionnelle.
Système EOS
Ce système s'appuie sur la haute sensibilité d'un détecteur gazeux au xénon sous pression inventé par Georges Charpak (dérivé de la chambre à fils de la recherche nucléaire qui lui valut le prix Nobel de physique en 1992). Les ionisations créées dans un gaz sont amplifiées dans un champ électrique élevé, et détectées sur des pistes conductrices gravées à l'échelle du micron sur les parois du détecteur. Ces détecteurs de haute sensibilité permettent la réalisation de radiographies à très basse dose. Dévolu à l'exploration rachidienne et des membres inférieurs (E pour électron, OS pour os), le système réalise simultanément deux images orthogonales. L'acquisition des images se fait sur un patient débout, permettant ainsi une évaluation de la statique rachidienne dans des conditions physiologiques. Une modélisation en 3D du squelette peut ensuite être calculée par le système, permettant de réduire encore la dose d'exposition aux rayonnements ionisants en se « contentant » de l'information suffisante pour guider le modèle.
Représentation des images
Avec la généralisation des détecteurs numériques, les radiographies ne sont plus lues sur des négatoscopes, mais sur des écrans d'ordinateur. Les radiographies sont des images représentées en échelle de gris selon le même codage que celui des anciens films argentiques. Elles sont composées par des opacités et des lignes qui représentent une projection de la cible sur un plan, le détecteur. Les différents degrés d'opacités d'une radiographie dépendent de l'énergie du faisceau de rayons X, de la composition (numéro atomique) du tissu évalué et de l'épaisseur de la cible. Les différences du nombre et de la qualité des photons X qui arrivent au système de détecteurs sont responsables du contraste de l'image. Le contraste en radiographie standard peut être défini par la différence entre les opacités et les transparences d'une image (figure 3.5).
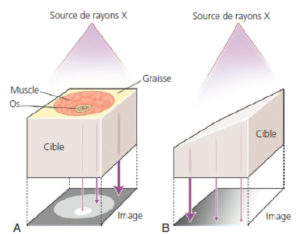
Formation de l'image radiographique.
A. Effet de la différence de densité des matériaux. Une cible avec trois composants de densités différentes et d'épaisseurs identiques est exposée à un faisceau de rayons X. L'épaisseur des flèches violettes représente l'intensité du faisceau ayant traversé la cible. Noter la relation inversement proportionnelle entre la densité et l'intensité du faisceau transmis.
B. Effet de la différence d'épaisseur. Une cible de densité homogène mais d'épaisseur variable est traversée par un faisceau de rayons X. L'épaisseur des flèches violettes représente l'intensité du faisceau de rayons X après traversée de la cible. Noter la relation inversement proportionnelle entre l'épaisseur de la cible et l'intensité du faisceau transmis.
Dessin : Cyrille Martinet.
Pour une énergie donnée des rayons X, cela se traduit en image inversée de la façon suivante : plus la densité du tissu est élevée, plus le faisceau incident sera atténué, moins le détecteur sera impressionné ; l'image sur le détecteur apparaîtra blanche (peu modifiée par l'image radiante). On dit qu'elle est opaque (aux rayons X), radio-dense ou dense. Au contraire, plus la densité du tissu est faible, moins le faisceau incident sera absorbé, plus le détecteur sera impressionné par l'image radiante ; l'image sera noire. On dit qu'elle est claire ou radiotransparente.
La description des radiographies utilise donc la terminologie suivante :
- image opaque/radiodense ;
- image claire/radiotransparente.
En radiographie standard, les densités radiographiques peuvent être classifiées de façon schématique en quatre types présentés ci-dessous en densité croissante (figure 3.6) :
- aérique-gazeuse (par exemple poumon, gaz intestinal) ;
- graisseuse (par exemple tissu sous-cutané) ;
- hydrique (par exemple muscle, reins, foie) ;
- calcique (par exemple os).
- à part, les pièces métalliques (pacemaker) ou le matériel prothétique généralement plus dense que les os.
Les différentes atténuations en radiographie.
A. Un tube à essai contenant de la craie, de l'eau, de l'huile et de l'air a été radiographié pour illustrer les quatre atténuations correspondantes en radiographie : calcique, hydrique, graisseuse et aérique.
B. Exemple des quatre atténuations visibles sur la radiographie d'avant-bras et de main d'un enfant de 2 ans. Les muscles, les cartilages, les capsules et les ligaments ont la même atténuation, celle de l'eau, ce qui ne permet pas de les distinguer les uns des autres en radiographie.
Le tissu adipeux présente une basse densité, composé par des atomes de faible numéro atomique, pouvant donc être traversé sans interaction par un grand nombre de photons (faible absorption). Inversement, le tissu osseux minéralisé est composé par des cristaux de phosphates de calcium au numéro atomique élevé et sera donc traversé par un nombre relativement faible de photons (grande absorption). Le contraste est fondamental pour la formation et pour l'interprétation des radiographies. Par exemple, un nodule pulmonaire tissulaire entouré de parenchyme pulmonaire aéré, normal, est visible en radiographie standard. En revanche, le même nodule dans une zone de poumon non aéré peut ne pas être visible (figure 3.7).
A. Radiographie du thorax de face. Un nodule pulmonaire de contours lobulés est visible dans le tiers inférieur du poumon droit (flèche). Ce nodule est visible car il est plus opaque que le parenchyme pulmonaire aéré qui l'entoure.
B. Radiographie du thorax de face chez un patient présentant une réduction importante de la transparence du champ pulmonaire droit en rapport avec une pneumopathie et un volumineux épanchement pleural. Noter que, dans ce contexte, un nodule de caractéristiques similaires à celui de la figure A ne serait pas visible car sa densité est la même que celle de l'épanchement et du foyer de pneumopathie. Les deux opacités pleuro-pulmonaire et du nodule sont de densités hydriques identiques et se superposent : ces opacités sont indissociables (c'est le signe de la silhouette).
L'autre composant fondamental des images radiographiques correspond aux lignes et contours. La formation des lignes et des contours sur un cliché radiographique est régie par la loi des tangentielles : un trait prend naissance sur une image radiographique lorsque le faisceau de rayons X aborde tangentiellement la surface d'une structure opaque ou l'interface séparant deux structures d'opacités différentes (figure 3.8). L'aspect d'un objet en radiographie standard est donc fortement dépendant de la direction du faisceau de rayons X et de la position de l'objet cible.
Schéma démontrant l'influence de la loi des tangentielles.
Le même objet dans la même position est exposé à deux faisceaux de rayons X de directions différentes (A et B). Les lignes formées dans l'image de cet objet sont différentes.
Dessin : Cyrille Martinet.
Le contraste spontané des tissus en radiographie standard est parfois insuffisant pour permettre la visualisation de certaines structures. L'utilisation des produits de contraste à base d'iode ou de baryum (éléments à numéros atomiques élevés) modifie le contraste radiographique en atténuant le faisceau de rayons X de façon plus importante que les tissus non calcifiés. Les produits de contraste iodés sont plus souvent utilisés pour des applications digestives, urinaires ou vasculaires. Les produits de contraste barytés sont le plus souvent utilisés pour visualiser (on dit opacifier) la lumière de l'appareil digestif. Comme pour tous les médicaments, il existe des contre-indications à l'utilisation des produits de contraste : l'insuffisance rénale ou l'allergie à des produits de contraste iodés.
Artefacts et distorsion de l'image
Différents éléments géométriques doivent être considérés lors de l'interprétation d'une radiographie : la projection planaire, l'agrandissement et le flou de l'image, la distorsion géométrique, la superposition et la sommation des structures explorées.
Projection planaire
La radiographie standard projette sur le plan du détecteur des informations provenant du volume traversé par le faisceau X. Puisqu'un objet tridimensionnel est représenté par une image bidimensionnelle, seules la largeur et la longueur des objets peuvent être évaluées. La profondeur n'est pas accessible sur un cliché radiographique unique et il est donc nécessaire de réaliser au moins deux projections différentes (on parle d'incidences), souvent orthogonales, pour pouvoir se représenter un objet dans les trois plans de l'espace figure 3.9).
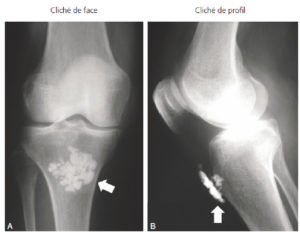
Radiographies du genou d'un patient se plaignant de douleurs antérieures du genou.
A. Radiographie de face montrant une image opaque d'allure calcique projetée sur le tibia proximal (flèche). Il est impossible de savoir sur ce cliché à quelle profondeur se situe l'image calcique et de préciser si elle est intra-osseuse ou dans les parties molles : la possibilité d'une tumeur osseuse ne peut pas être exclue.
B. Radiographie de profil du même patient montrant une projection superficielle de l'image calcique (flèche). Cette image est extra-osseuse et localisée en projection de la bourse infrapatellaire superficielle : il s'agissait d'une bursite chronique (inflammation chronique d'une bourse séreuse) chez un carreleur, liée à la position répétée à genoux.
Agrandissement et flou
Comme dans toutes les méthodes d'imagerie en projection, l'agrandissement de l'image est par construction géométrique fonction de la distance entre la source des rayons X et la cible, ainsi que la distance entre la cible et le système de détection. Par ailleurs, le flou de l'image est proportionnel à l'agrandissement ; c'est le même effet que quand nous regardons l'ombre de notre main sur un mur : au fur et à mesure que nous éloignons notre main du mur, le flou de l'ombre augmente (figure 3.10). Pour réaliser une radiographie, le patient doit donc être positionné aussi loin que possible du tube et aussi près que possible du capteur. Une autre source de flou dans l'image est le flou cinétique lié aux mouvements du patient (ou des organes, par exemple le bord du cœur) pendant l'acquisition, entraînant une perte de netteté de l'image. Les acquisitions avec un temps d'exposition long (permettant une analyse fine de la texture des tissus) sont particulièrement sensibles à ce type d'artefact (figure 3.11).

Influence de l'agrandissement et du flou dans l'image radiographique.
Photographies sans modification d'échelle de l'ombre d'une main interposée entre le mur et une source de lumière. A. La main est positionnée proche de la source de lumière et loin du mur.
B. La main est positionnée plus loin de la source de lumière et plus proche du mur. Noter que l'image A est plus grande, mais moins contrastée et plus floue que l'image B.
Mammographies (radiographies des seins) centrées sur la même région anatomique.
A. La patiente a bougé pendant l'acquisition de l'image.
B. L'examen a été répété et l'image est de bonne qualité. Il existe une image de niveau liquidien-huileux (têtes de flèche) et des calcifications parenchymateuses. Le niveau liquidien dans l'image est nettement plus flou en A qu'en B (flèche en pointillés), de même que certaines calcifications (flèches). L'architecture du parenchyme mammaire est aussi plus floue dans l'image A. L'image avec le niveau correspondait à une galactocèle (rétention lactée dans un conduit lactifère dilaté).
Distorsion géométrique
La distorsion géométrique apparaît en fonction de la position de l'objet par rapport au faisceau de rayons X : plus l'objet est oblique, plus la distorsion de sa forme est importante. De même, plus le rayon directeur (orientation du centre du faisceau de rayons X) est oblique par rapport au plan du système de détection, plus l'effet de distorsion géométrique sera présent dans l'image (figure 3.12).
Bilan radiographique d'une épaule.
A. Incidence de face en rotation interne de l'épaule droite, avec une inclination caudale (vers le bas) de 20° du rayon incident. B. Incidence de la même épaule réalisée avec une inclination caudale de 45° par rapport à l'horizontale du rayon incident (dite de Garth) ; cette incidence permet de dégager le bord antéro-inférieur de la glène. Noter la distorsion géométrique de la tête humérale sur l'incidence de Garth qui apparaît oblongue par rapport à l'incidence de face.
Superposition et sommation des images
Signe de la silhouette.
Les radiographies de face du thorax (A, B) montrent une zone de perte de la transparence du parenchyme pulmonaire dans la projection du lobe inférieur gauche (cercles rouges) compatible avec une pneumopathie. Noter que, dans l'image A, les contours cardiaques (VG) sont effacés à gauche, notamment au niveau de l'apex (flèche blanche), tandis que, dans l'image B, les contours cardiaques sont bien visibles malgré la présence de l'opacité pulmonaire (flèche vide). Il est donc possible d'affirmer que, dans l'image A, le foyer de pneumopathie est localisé dans la portion antérieure du lobe inférieur gauche ; le bord du cœur (de densité liquidienne) n'est plus visible. L'opacité siège donc dans le même plan que le cœur. Puisque celui-ci est en avant dans le thorax, l'opacité est antérieure. Dans l'image B, le foyer de pneumopathie est postérieur car le bord du cœur reste visible ; celui-ci n'est donc pas dans le même plan.
La projection de plusieurs structures sur un plan bidimensionnel entraîne une superposition de différentes opacités, lignes et de différents contours. Quand deux structures de densité identique sont localisées dans deux plans différents, leurs contours sont conservés ; en revanche, quand elles se localisent dans le même plan, elles perdent leurs contours et les images sont confondues. Cette description est communément appelée « signe de silhouette » (figure 3.13 et voir figure 3.7).
Indications et limites
Quelques indications fréquentes des radiographies standard sont présentées dans cette section.
Radiologie ostéoarticulaire
Le tissu osseux a un haut contraste spontané en radiographie standard dû à sa densité, permettant une analyse fine de l'architecture et des contours osseux. Les radiographies standard restent donc l'examen de première intention pour l'évaluation des affections osseuses ou articulaires constitutionnelles, dégénératives, inflammatoires, néoplasiques et traumatiques (voir chapitre 22).
Radiologie thoracique
Le cliché du thorax de face est la base d'une prise en charge d'une affection thoracique. À cause de la dose plus importante qu'il génère, le cliché de profil est exceptionnellement réalisé ; l'analyse du cliché de face étant, en règle générale, suffisante au diagnostic (voir chapitre 25).
Radiologie digestive
Les clichés simples de l'abdomen ou abdomens sans préparation (ASP) ne conservent que quelques indications limitées (recherche de corps étranger ou de calculs rénaux). Par ailleurs, la diffusion de l'endoscopie digestive et des examens tomodensitométriques explique en partie la réduction des examens avec opacifications digestives (voir chapitre 27).
Sénologie
Les mammographies (radiographies des seins) font partie du programme de dépistage national du cancer du sein et sont donc largement réalisées en pratique clinique (voir chapitre 29).
Radiologie interventionnelle
Les radiographies par projection sont fréquemment utilisées pour le guidage d'un grand nombre de procédures interventionnelles (voir chapitre 15). Injections intra-articulaires, biopsies osseuses, traitement percutané de tumeurs par chauffage ou congélation (dite « ablation percutanée ») sont généralement réalisés sous contrôle fluoroscopique qui permet une visualisation durant la procédure du geste réalisé. Les procédures interventionnelles réalisées sur les parties molles sont moins susceptibles de s'adapter à un guidage fluoroscopique et, pour ce type d'intervention, le guidage échographique ou TDM est préférable.
Vasculaire
La radiographie par projection est le moyen de repérage anatomique des vaisseaux dans les salles d'angiographie ; le vaisseau est opacifié à l'aide d'un produit de contraste iodé permettant de visualiser l'arborescence vasculaire. La radiographie interventionnelle concerne pratiquement tous les organes, notamment le cœur, le cerveau, l'appareil digestif, les affections traumatiques, tumorales etc. Compte tenu de leur complexité, certaines de ces procédures sont longues et sont une source importante d'irradiation pour le patient et les opérateurs. Leur champ d'application est vaste ; par exemple la dilatation des sténoses vasculaires, la fulguration de foyers arythmogènes, la chimio-embolisation ou la radio-embolisation des tumeurs, la fermeture de vaisseaux anormaux (varicocèles) ou l'interruption d'un saignement actif.
Conclusion
La radiographie par projection reste largement utilisée en imagerie médicale. Dans un contexte d'innovation technologique rapide en imagerie médicale, avec la mise à disposition de nouvelles techniques d'imagerie avancée (IRM, TEP, TDM de nouvelle génération, cone beam, tomoscintigraphie, échographie, etc.), la radiographie par projection pourrait paraître obsolète. De fait, une large partie des indications classiques a disparu, substituée par ces autres techniques d'imagerie. Cependant, de nombreuses indications de radiographies restent d'actualité, dont la radiographie thoracique et ostéoarticulaire. Par ailleurs, la radiographie par projection continue, elle aussi, de progresser, en particulier grâce aux images numériques, aux capteurs plans, au système EOS et à la tomosynthèse. Cela conduit au développement de nouvelles indications comme l'évaluation de la statique rachidienne en EOS. La radiographie est également utilisée pour guider des procédures interventionnelles dont les applications sont en expansion.
Remerciements
Nous tenons à remercier le professeur Denis Régent pour l'aide dans la révision et l'édition de ce manuscrit.
Essentiel à retenir
- Un système de radiologie utilisant les rayons X emploie un tube radiogène à anode tournante et cathode chaude (tube de Coolidge) permettant de créer un faisceau de rayons X.
- L'atténuation du faisceau de photons X est le principal phénomène physique intervenant dans la formation des images radiographiques. Elle dépend du numéro atomique des atomes du tissu exposé et de l'énergie du faisceau de rayons X utilisé.
- Plus la densité du tissu exploré est basse et plus l'énergie du faisceau de rayons X émergeant est élevée, plus l'atténuation sera faible, conduisant à une plage plus noire ou radiotransparente. Plus la densité du tissu exploré est élevée et plus l'énergie du faisceau de rayons X émergeant est faible, plus l'atténuation sera importante, conduisant à une plage plus blanche ou radio-opaque sur l'image.
- Les radiographies par projection sont des images en échelle de gris, composées par des opacités, des lignes et des contours.
- Un trait prend naissance sur une radiographie lorsque le faisceau de rayons X aborde tangentiellement la surface d'une structure opaque ou l'interface séparant deux structures d'opacité différente.
- Un meilleur contraste est obtenu en diminuant les kV, au prix d'une atténuation globale supérieure obligeant à augmenter les mA, donc l'exposition du patient. La réduction de la dose au patient se fait soit en diminuant l'intensité du faisceau incident, soit en augmentant l'énergie des rayonnements au risque de diminuer le contraste.
- La diffusion Compton augmente pour des énergies de rayons X (en keV) plus élevées, et des champs d'exploration du patient plus larges ; elle dégrade l'image radiologique et provoque une diffusion dans l'ensemble de la pièce d'exploration.
- Il est nécessaire de réaliser au moins deux projections à différentes incidences (si possible orthogonales) pour pouvoir localiser un objet dans les trois dimensions de l'espace.
- Plus l'orientation du faisceau de rayons X par rapport au plan de référence du patient (angle d'incidence) ou par rapport au plan du système de détection (angle de projection) sera grand, plus l'effet de distorsion géométrique dans l'image sera grand.
- Une radiographie entraîne un agrandissement lié à l'effet de projection.
Bibliographie
- Peyret O, Bergot C. L'imagerie par rayons X. In: Biophysique pour les sciences de la vie et de la santé. Omniscience Ed ; 2007. p. 79–813.
- Régent D, Mandry D, Croise-Laurent V, et al. Production des rayons X en imagerie par projection et en scanographie. In: EMC - Radiologie et imagerie médicale - principes et technique - radioprotection. Elsevier ; 2013.
- Wybier M, Bossard P. Musculoskeletal imaging in progress : the EOS imaging system. Joint Bone Spine 2013 ;80(3):238–43.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 2 - Caractéristiques d'une image médicale
E. Durand et E. Blondiaux
Plan du chapitre
- Numérisation, pixels, voxels
- Résolution spatiale
- Bruit
- Contraste
- Images en projection et images en coupes
- Présentation et orientation des images
- Archivage
Une image correspond à la mesure localisée d'un signal physique d'un objet1 dans l'espace, généralement en deux dimensions (2D) ou en trois dimensions (3D). On explore ainsi une partie de l'espace appelée « champ de vue » ou field of view (FOV). Ce champ de vue peut concerner l'organisme entier (imagerie « corps entier ») ou bien être ciblé sur une partie de l'organisme.
1. Le terme d'« objet » est ici utilisé comme en optique où l'on observe l'image d'un objet. En imagerie médicale, l'objet observé est le corps humain ou une partie du corps.
Numérisation, pixels, voxels
Cette image est désormais numérique ou numérisée pour presque toutes les techniques d'imagerie médicale (les films radiologiques à base de sels d'argent, autrefois utilisés, ont désormais disparu ; de même que la photographie numérique a remplacé les anciens films photographiques). On range donc dans des cases d'une mémoire d'ordinateur les mesures des signaux physiques. Comme le nombre de cases est en quantité finie, on ne peut plus conserver une mesure continue de l'information, c'est-à-dire connaître la valeur du signal en chaque point de l'espace ; on est obligé de découper l'objet matériel en petits éléments réguliers appelés voxels (volume elements). Les signaux mesurés dans les voxels sont rangés dans de petits rectangles de l'image en 2D (en petits parallélépipèdes en 3D) qui sont appelés pixels (picture elements). La notion de voxel se rapporte donc à l'élément matériel tandis que la notion de pixel se rapporte à l'image (figure 2.1).
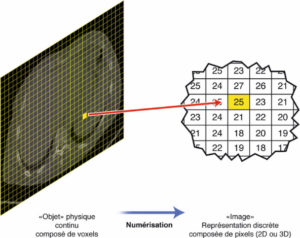
Numérisation d'un objet en image.
Dessin : Emmanuel Durand.
Le signal est donc uniforme au sein d'un pixel dans l'image, alors qu'il ne l'est pas au sein d'un voxel dans l'objet exploré. Ce passage d'un objet réel continu à une image composée de pixels – donc discrète –, appelée conversion analogique-numérique, peut être la source d'artefacts. En particulier, si la taille des pixels est trop grosse, on risque de perdre une partie des détails. Le nombre de pixels dans chacune des dimensions s'appelle la matrice. Par exemple, un champ de vue de 12,8 cm découpé en pixels de 1 mm de côté aura une matrice de 128. Plus la matrice est grande, plus la taille des pixels est petite et plus il est donc théoriquement possible de voir des détails fins (figure 2.2). La matrice est souvent composée de puissances entières de 2, pour des raisons liées aux calculs en traitement de l'image. De même, le nombre de pixels dans les deux dimensions est souvent le même.
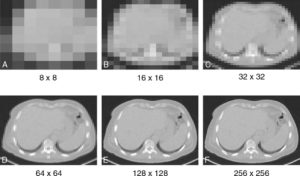
Effet de la matrice (une petite matrice correspond à de gros pixels).
Dessin : Emmanuel Durand.
Résolution spatiale
La résolution spatiale est la capacité à distinguer des structures fines dans l'image. Au sens strict, la résolution spatiale est le nombre de paires de lignes qu'on peut distinguer dans une image par unité de longueur. Par exemple, si on distingue deux points séparés de 2 mm, mais qu'on ne distingue plus des points plus rapprochés, on dira que la résolution spatiale est de 0,5 mm–1. Par abus de langage, on parle le plus souvent d'une résolution de 2 mm dans ce cas.
La résolution est bien sûr conditionnée par la taille des pixels. Par exemple, si la taille d'un pixel est de 2 mm, la résolution la plus fine qu'on puisse espérer voir est de 0,25 mm− 1, c'est-à-dire des structures espacées de 4 mm (figure 2.3).
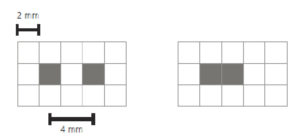
On ne peut distinguer deux pixels noirs que s'ils sont espacés d'un pixel blanc (A) ; sur la figure de droite, on ne distingue qu'une seule structure (B). La résolution spatiale la plus fine permise est donc 1/(2 pixels).
Dessin : Emmanuel Durand.
Toutefois, s'il n'est pas possible de voir une résolution plus fine que ce que permet la taille des pixels, cette dernière ne fait pas tout. En effet, la qualité de l'instrument d'imagerie a un rôle majeur et si la résolution intrinsèque de l'appareil est mauvaise, découper l'image en pixels très fins ne résoudra rien (figure 2.4).
La taille des pixels peut limiter la résolution spatiale, mais la résolution spatiale n'est pas la taille des pixels : elle dépend aussi de la qualité de l'appareil d'imagerie !

La taille des pixels est la même dans les deux figures (A, B) ; pourtant, la figure de gauche a une bien meilleure résolution (A).
Dessin : Emmanuel Durand.
Lorsque des structures sont plus petites que ce que permet de voir la résolution spatiale, elles peuvent :
- ne pas être visibles ;
- être visibles mais floues (figure 2.4) ;
- être vues mais avec un niveau de signal incorrect, par moyennage avec les structures qui les entourent ; on parle alors d'effet de volume partiel (figure 2.5).
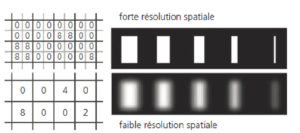
Effet de volume partiel.
En haut, la résolution spatiale est suffisante pour mesurer le signal avec une intensité correcte ; en bas, une résolution spatiale trop faible entraîne en moyennage des structures les plus petites avec leur entourage (ici, les structures sont sur un fond à signal nul : le niveau de signal est donc sous-estimé) : il s'agit d'un effet de volume partiel.
Dessin : Emmanuel Durand.
Bruit
Dans le domaine du traitement du signal et de l'image, le bruit correspond à un phénomène aléatoire qui se surajoute à l'image idéale. Probablement la meilleure approche pour comprendre le bruit est de comprendre que si l'on acquiert plusieurs fois l'image d'un même objet, immobile et inchangé, on n'observera pas exactement le même résultat : la différence est liée au bruit. De la même manière, en lançant plusieurs fois un dé, on n'obtient pas le même résultat : c'est aléatoire (figure 2.6).
Si l'on répète l'acquisition d'une image à différents temps (n = 1, n = 2, etc.), on obtient des images différentes d'une fois à l'autre.
Dessin : Emmanuel Durand.
La partie constante est l'image idéale, la partie variable est le bruit.
Comme tout phénomène aléatoire, le bruit est caractérisé par son écart type (racine carrée de la variance), qu'on note σ.
Pour quantifier le niveau de bruit, on compare généralement l'intensité du signal avec l'écart-type du bruit pour déterminer le rapport signal sur bruit (RSB) :
où S est l'intensité du signal. Le bruit dans l'image peut gêner l'interprétation et, à l'extrême, rendre les images complètement illisibles. La présence de bruit va également détériorer la résolution spatiale puisqu'il peut être impossible de distinguer des structures trop petites dans une image très bruitée (figure 2.7).

Différents niveaux de rapports signal sur bruit (RSB).
Un RSB de 1 permet encore de distinguer les plus grosses structures mais plus les structures les plus fines.
Dessin : Emmanuel Durand.
Contraste
Un diagnostic est généralement fait en discernant le signal anormal d'une lésion au sein d'un organe normal. C'est donc le contraste entre les deux qui permet le diagnostic. Le signal de l'organe normal est parfois appelé « bruit de fond » en français. Ce terme n'est pas très heureux car il fait référence au bruit (aléatoire) alors qu'il ne s'agit pas de bruit ici. Le terme anglais background est plus adapté.
Si l'on note S1 le signal de la lésion et S2 le signal de fond, le contraste est traditionnellement défini comme : C = | S1 - S2 | / | S1 + S2 |
Un signal de 6 sur un fond de 2 donne donc un contraste de 0,5. Toutefois, sur une image numérique, il est aisé de changer le contraste à volonté. Dans l'exemple précédent, si l'on soustrait la valeur 4 à l'image, les deux valeurs précédentes deviennent respectivement + 2 et − 2 avec un contraste qui devient infini. Plus intéressant est donc de considérer le rapport contraste sur bruit (RCB) : RCB = C = | S1 - S2 | / σ
Images en projection et images en coupes
L'objet étudié est fondamentalement tridimensionnel. Certaines modalités d'imagerie fournissent une image tridimensionnelle (imagerie en coupes) ; d'autres ne permettent d'obtenir qu'une image 2D (tableau 2.1). Il s'agit donc d'une projection de l'objet initial, comme une ombre chinoise (figure 2.8). On perd alors l'information de profondeur, la quantification devient difficile et les superpositions peuvent gêner l'interprétation.
Tableau 2.1
Types et mécanismes des différentes modalités d'imagerie
|
Type |
Mécanisme |
Modalité |
2D/3D |
|
Morphologique |
Absorption des rayons X |
Radiographie Angiographie numérisée |
Projection 2D |
|
Angiographie rotationnelle TDM (scanner) |
3D |
||
|
Réflexion des ultrasons |
Échographie |
Coupes 2D |
|
|
Échographie 3D |
3D |
||
|
Mixte |
Échos de l'aimantation des noyaux |
IRM |
3D |
|
Fonctionnelle |
Émission de photons gamma |
Scintigraphie |
Projection 2D |
|
Tomoscintigraphie
|
3D |
||
|
Émission de positons |
TEP |
3D |
Présentation et orientation des images
Par convention, les images sont présentées de la même façon au sein d'une modalité, qu'elle soit en projection ou en coupes (figure 2.8) :
• en projection de face ou en coupe coronale (ou frontale), la droite du patient est présentée à gauche de l'écran : comme si on regardait simplement le patient de face ;
• sur une vue axiale (ou transverse), la droite du patient est toujours située à gauche de l'écran : comme si on regardait le patient – allongé sur le dos – depuis ses pieds ;
• sur une vue sagittale ou de profil, l'image est présentée avec la partie antérieure du patient à gauche de l'écran, comme si on regardait le patient de profil gauche (à l'exception des images d'échographie sur lesquelles le pôle crânial du patient est présenté à gauche de l'écran)
• les images de scintigraphie planaire (projections) sont toujours représentées comme si l'observateur avait le point de vue de la caméra (voir chapitre 5).
Orientation conventionnelle des images : coupes axiales, coronales et sagittales de TDM ; projections de face et profil en radiographie.
L'orientation est normalisée pour ces différentes images. Elle est la même en IRM et en tomoscintigraphie. Les coupes sagittales d'échographie sont représentées différemment, le pôle crânial étant placé à gauche de l'écran.
Dessin : Emmanuel Durand.
Archivage
Les images médicales sont enregistrées sous un format de stockage et d'échange appelé digital imaging communication in medicine (DICOM) qui contient, outre l'image elle-même, des métadonnées la caractérisant (identité du patient, date et heure d'acquisition, type d'appareil, paramètres d'acquisition détaillés, etc.). Dans les établissements de santé, les images sont désormais archivées dans un système en réseau appelé Picture Archiving and Communication System (PACS), habituellement consultable également par les correspondants.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 1 - Histoire de l'imagerie médicale
F. Brunotte et P. Devred
L'histoire de l'imagerie médicale a à peine plus d'une centaine d'années (liste 1.1). Elle a comporté des va-et-vient permanents entre la physique, l'anatomie, la biologie, la chimie et les spécialités médicales qui soulignent son caractère profondément pluridisciplinaire. La liste des prix Nobel qui ont influencé cette spécialité est là pour en témoigner (liste 1.2).
Liste 1.1 - Sélection de quelques dates essentielles de l'évolution de l'imagerie
- 1895 - W.C. Röntgen réalise la première image du squelette de la main de son épouse avec les rayons X
- 1897 - Premier laboratoire de radiologie créé par A. Béclère à l'hôpital Tenon (Paris)
- 1909 - Création par A. Béclère de la Société de radiologie médicale de Paris, devenue depuis Société française de radiologie en se séparant des physiciens : « Nul ne peut devenir un bon radiologiste sans être avant tout un bon clinicien »
- 1914 - Début de l'utilisation des produits de contraste opaques aux rayons X à base de bismuth, potasse, baryum pour le tube digestif et de sels d'argent pour les voies urinaires
- 1914–1918 - La radiologie contribue à la prise en charge des blessés au plus près des combats (voiturettes équipées à l'initiative de Marie Curie)
- 1918 - W.E. Dandy réalise la première ventriculographie gazeuse par injection directe d'air dans les ventricules cérébraux
- 1920 - Début de l'utilisation du thorium (Thorotrast) comme produit de contraste qui se révélera plus tard être responsable de cancers hépatiques du fait de la radioactivité alpha du thorium
- 1921 - A. Bocage dépose le brevet du premier tomographe aux rayons X
- 1923 - E.D. Osborne utilise l'iodure de sodium pour opacifier les voies urinaires
- 1923 - G.C. de Hevesy introduit le concept de traceur en montrant l'intérêt du plomb 210 pour suivre le devenir du plomb dans les plantes
- 1926 - H.L. Blumgart s'injecte du bismuth 214 dans une veine du bras et mesure la vitesse sanguine
- 1927 - Introduction des dérivés iodés de la pyridone comme contraste pour l'urographie par M. Swick
- 1928 - A.E. Moniz, à Lisbonne, publie les premières artériographies cérébrales à l'iodure de sodium par ponction carotidienne directe
- 1929 - W. Forssmann s'introduit un cathéter dans une veine du bras et le pousse jusqu'au cœur et ouvre ainsi la voie de la radiologie vasculaire
- 1932 - O. Chievitz et G.C. de Hevesy suivent le métabolisme du phosphore à l'aide du phosphore 32 chez le rat
- 1936 - Inauguration à Hambourg du monument en l'honneur des pionniers de la radiologie victimes de cancers et de leucémies radio-induits : « à ceux qui ont sacrifié leur vie dans la lutte contre les maladies et ont été les pionniers d'une application féconde des rayons de Röntgen… immortelle est la gloire de ces morts »
- 1937 - J.H. Lawrence utilise le phosphore 32 pour tenter de traiter une leucémie
- 1946 - S.M. Seidlin traite des métastases d'un cancer thyroïdien par l'iode 131 (131I)
- 1950 - B. Cassen introduit le premier dispositif d'imagerie par scintigraphie, le scanner rectilinéaire
- 1952 - J.J. Wild, L. Leksell et I. Edler utilisent pour la première fois les ultrasons pour l'étude du cœur. S.I. Seldinger développe l'abord percutané des artères périphériques pour la radiologie vasculaire
- 1957 - Invention de la gamma-caméra par H.O. Anger à Berkeley
- 1958 - L'Anglais I. Donald réalise la première échographie de l'utérus
- 1958 - W.D. Tucker et M.W. Greene décrivent le générateur de 99mTc au Brookhaven National Laboratory
- 1960 - Premières embolisations de malformations vasculaires en neuroradiologie par S. Wallace, R. Djindjian et J.J. Merland
- 1962 - Le Commissariat à l'énergie atomique (CEA) en France est le deuxième client du générateur de technétium après Chicago
- 1963 - D.E. Kuhl introduit la tomographie d'émission monophotonique
- 1972 - L'Anglais G.N. Hounsfield et l'Américain A.M. Cormack inventent le scanner X
- 1971–1973 - Les Américains R. Damadian et P.C. Lauterbur réalisent les premières images d'IRM
- 1973 - M.E. Phelps et E.J. Hoffman introduisent le premier appareil de tomographie par émission de positons (TEP)
- 1975 - Début de la diffusion de l'échographie médicale. A. Gruentzig crée le cathéter de dilatation vasculaire par ballonnet
- 1976 - Premier scanner X installé en France (Marseille)
- 1976 - A. Alavi injecte du fluorodésoxyglucose marqué au fluor 18 (18F-FDG) pour la première fois à un homme
- 1980 - Commercialisation des premières IRM
- 1983 - Premiers essais cliniques du DTPA-Gd comme agent de contraste en IRM
- 1985 - Premières endoprothèses vasculaires (stent)
- 2000 - T. Beyer et D.W. Townsend introduisent l'imagerie hybride couplant TEP et scanner X
- 2010 - Introduction de l'imagerie couplant TEP et IRM
- 2017 - Premières applications de l'intelligence artificielle susceptibles de se comparer à l'interprétation d'un spécialiste pour la détection d'anomalies sur des examens d'imagerie médicale
Liste 1.2 - Prix Nobel en lien avec l'imagerie
- 1901 - W.C. Röntgen (Allemagne), physique, en reconnaissance des services extraordinaires qu'il a rendus en découvrant les remarquables rayons qui ont été nommés par la suite en son honneur
- 1903 - A.H. Becquerel, P. Curie, M. Curie (France), physique, en témoignage des services extraordinaires rendus par la découverte de la radioactivité spontanée et les phénomènes radiatifs
- 1911 - M. Curie (France), chimie, en reconnaissance des services pour l'avancement de la chimie par la découverte de nouveaux éléments : le radium (Ra) et le polonium (Po), par l'étude de leur nature et de leurs composés
- 1935 - F. Joliot et I. Joliot-Curie (France), chimie en reconnaissance de la synthèse de nouveaux éléments radioactifs
- 1943 - G.C. de Hevesy (Suède), chimie, pour son travail dans le domaine des traceurs radioactifs
- 1944 - I.I. Rabi (États-Unis), physique pour sa méthode de résonance servant à enregistrer les propriétés magnétiques du noyau atomique
- 1946 - H.J. Muller (États-Unis), physiologie et médecine, pour ses recherches sur les mutations induites par les rayons X
- 1949 - A.E. Moniz (Portugal), physiologie et médecine, pour le développement de la leucotomie préfrontale (lobotomie) appliquée au traitement de certaines psychoses et troubles mentaux (inventeur de l'artériographie cérébrale)
- 1952 - F. Bloch et E.M. Purcell (États-Unis), physique pour leur développement de nouvelles méthodes de mesures magnétiques nucléaires fines et les découvertes qui en ont découlé
- 1956 - A.F. Cournand (États-Unis), W. Forssmann (Allemagne), D.W. Richards (États-Unis), physiologie et médecine pour leur découverte concernant le cathétérisme cardiaque et les changements pathologiques dans le système circulatoire
- 1979 - A.M.Cormack (États-Unis), G.N. Hounsfield (Royaume-Uni), physiologie et médecine pour la production d'images tomographiques en imagerie par rayons X
- 1991 - R.R. Ernst (Suisse), chimie pour ses contributions au développement de la méthodologie de la spectroscopie de la résonance magnétique nucléaire à haute définition
- 1992 - G. Charpak (France), physique pour son invention et le développement de détecteurs de particules, en particulier la chambre « multifils »
- 2003 - P.C. Lauterbur (États-Unis), P. Mansfield (Royaume-Uni), physiologie et médecine pour leurs découvertes concernant l'imagerie par résonance magnétique
Si les tout-débuts de son développement ont mis en danger médecins et patients en raison de la nocivité des rayons X, de certains produits de contraste comme le Thorotrast (produit de contraste à base de thorium, composé radioactif utilisé dans les années 1930–1940, qui s'est révélé par la suite cancérigène) ou de certaines techniques, l'imagerie permet aujourd'hui une approche morphologique et fonctionnelle remarquable du corps humain, le plus souvent de manière simple et sans risque.
Ces progrès ont changé l'approche des maladies. Prenons l'exemple du diagnostic des tumeurs cérébrales. L'arrivée des rayons X permit seulement de les mettre en évidence par l'intermédiaire de leur retentissement osseux ou des calcifications qu'elles contenaient. L'idée d'utiliser les agents de contraste apparut donc rapidement, d'abord par un contraste négatif grâce à l'injection d'air dans les espaces liquidiens du cerveau (douloureux), puis par injection de contraste dans les carotides sous anesthésie générale après dénudation chirurgicale de la carotide. En dépit de ses progrès, l'artériographie restait agressive et, à partir de 1950, la médecine nucléaire occupa le terrain de l'imagerie sans danger pour le patient avec la fluorescéine marquée à l'iode, le mercure -203 et surtout l'acide diéthylène triamine penta acétique (DTPA) marqué au technétium -99m (99mTc) qui régna comme la méthode de référence jusqu'au développement explosif du scanner (ou tomodensitométrie [TDM]) à partir de 1971. Depuis la fin des années 1980, l'imagerie par résonance magnétique (IRM) avec le DTPA-gadolinium (Gd) est devenue la méthode de référence de l'imagerie des tumeurs cérébrales.
Ainsi, l'imagerie n'est pas figée et des techniques qui paraissaient incontournables comme l'urographie intraveineuse, les opacifications digestives, ou certaines scintigraphies ont presque disparu, remplacées par l'échographie, la TDM, l'IRM et de nouveaux radiopharmaceutiques en médecine nucléaire.
Chaque technique a ses domaines d'excellence : les ultrasons sont irremplaçables aujourd'hui dans le suivi des grossesses ou en cardiologie ; la TDM et l'IRM ont chacune leur place en neuroradiologie et dans l'ensemble de l'imagerie ; la médecine nucléaire s'est affirmée pour l'approche moléculaire des maladies et de leur traitement, etc.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Terminologie en imagerie
Une structure s'analyse en fonction de son signal absolu ou relatif (par rapport aux organes ou tissus adjacents).
Tableau 1 - Résumé des principaux termes descriptifs du signal en imagerie
|
Radiographie |
TDM |
Echographie |
IRM |
médecine nucléaire |
|
|
Blanc |
opacité |
hyperdense |
hyperéchogène |
hypersignal |
hyperfixant |
|
Gris |
intermédiaire |
isodense |
isoéchogène |
isosignal |
isofixant |
|
Noir |
clarté |
hypodense |
anéchogène |
hyposignal |
hypofixant |
Radiographie
- Opacité = zone de forte densité (blanche)
- Clarté = zone de moindre densité (sombre ou noire)
- Une structure dense (Z élevé), comme l'os, atténue (absorbe) beaucoup les RX c'est à dire est « radio-opaque » (blanche)
- Une structure aérique (Z faible), comme les poumons, atténue peu les RX c'est à dire apparaît comme une « hyper clarté » (sombre ou noire)
- Structure intermédiaire : tissus mous peu contrastés nécessitant parfois l'utilisation de produits de contraste à Z élevé : baryum (Z = 56) ou iode (Z = 53)
Tomodensitométrie
Le principe est le même que pour la radiographie mais on utilise une terminologie un peu différente :
- Hypodense : par exemple la valeur – 1000 UH attribuée à l'air (noir)
- Isodense : la valeur 0 UH est attribuée à l'eau (intermédiaire) ou se dit d'une structure de même densité que le parenchyme normal
- Hyperdense : par exemple la valeur + 1000 UH attribuée à l'os compact (blanc)
Échographie
- Anéchogène (noire) : liquide homogène, absence d'interfaces donc absence d'écho
- Hypoéchogène (intermédiaire)
- Hyperéchogène (blanche)
- Cône d'ombre postérieur : vide d'échos en arrière d'une structure absorbante qui est hyperéchogène
- Renforcement postérieur des ultrasons : renforcement de l'intensité du faisceau d'ultrasons en arrière d'une structure non absorbante qui est anéchogène
- Echos de réverbération ou image en queue de comète : réflexions multiples sur deux interfaces très réfléchissantes
IRM
- Hypersignal (ou hyperintense) : blanc
- Hyposignal (ou hypointense) : noir
- Isosignal (ou isointense) : de signal intermédiaire ou se dit d'une structure de même signal que le parenchyme normal
Médecine nucléaire
- Hyperfixation (ou hypermétabolisme) : signal plus intense lié à une concentration plus forte du radiopharmaceutique injecté, généralement lié à un métabolisme plus intense
- Hypofixation (ou hypométabolisme) : signal moins intense.
Radioanatomie
Noeuds lymphatiques (nomenclature internationale) : lieu de prolifération et de différenciation des cellules immunitaires. Le terme « ganglions lymphatiques » est utilisé dans le langage courant et en de rares occasions dans cet ouvrage. Une technique de repérage des noeuds lymphatiques a une appellation consacrée : « technique du ganglion sentinelle ».
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Préface
La radiologie et imagerie médicale ainsi que la médecine nucléaire sont des spécialités peu connues des étudiants, vues souvent comme complexes et techniques. Leur premier contact se fait souvent au cours des examens de sélection des premières années avec des exercices de doses, d'activité de traceur, de fixation, de décroissance de radioactivité.
Il est vrai qu'un minimum de connaissances est nécessaire pour appréhender les possibilités offertes par les examens d'imagerie. D'un côté, la radio-anatomie exige de l'étudiant que vous êtes de ré-apprendre l'anatomie du corps humain d'une manière différente, dans des plans de coupes transverses, sagittales, coronales, voire obliques ou double-obliques alors que l'apprentissage de l'anatomie demande en soi un investissement conséquent. D'un autre côté, les examens de médecine nucléaire reposent sur des processus physiopathologiques nombreux et variés qui expliquent la biodistribution des médicaments radiopharmaceutiques utilisés. De plus, les examens proposés permettent maintenant de superposer à l'anatomie des informations de fonctions, de métabolisme, de perfusion, de viabilité, de nécrose… venant amplifier les renseignements fournis aux demandeurs.
Et pourtant, tous les jours, quelle que soit votre discipline de demain, vous serez amenés à demander des examens, à les comprendre, à les expliquer à vos patients. Le radiologue et le médecin nucléaire sont des médecins qui seront vos correspondants dans un travail d'équipe permettant des soins de qualité car coordonnés et adaptés aux patients en fonction de la demande de dépistage, de diagnostic, de suivi ou de traitement par radiologie interventionnelle ou par radiothérapie interne vectorisée. L'imagerie est présente pour l'exploration de toutes les pathologies ou presque, quel que soit l'âge de la Vie. Nos disciplines sont transversales dans l'enseignement des EDN et vous devez connaitre les indications, contre-indications, modalités de réalisation, résultats attendus, les conduites à tenir pour les principales pathologies.
La radiologie et la médecine nucléaire ont fait des progrès considérables ces dernières années rendant leurs indications plus complexes et plus nombreuses. Vous trouverez dans ce livre des éléments de base pour comprendre comment sont réalisés les examens afin de pouvoir les expliquer aux patients, obtenir leur accord, connaitre les indications, les contre-indications et les conduites à tenir selon les résultats obtenus. Votre responsabilité sera engagée dès que vous demanderez un examen mais cette responsabilité sera partagée avec le radiologue ou le médecin nucléaire contrairement aux pharmaciens ou biologistes qui exécuteront votre prescription. Sachez travailler main dans la main avec nous pour offrir à nos patients le meilleur des soins. Trop de médecins demandent l'examen radiologique avant de réaliser un examen clinique : cette tendance doit être combattue car à une question vague, la réponse apportée par l'imagerie restera vague. Si la question est ciblée par votre interrogatoire et votre examen clinique, l'examen radiologique ou de médecine nucléaire permettra de vous apporter une réponse plus adaptée.
Dans ce livre vous trouverez toutes les informations utiles pour vos examens. Nous vous souhaitons un bon apprentissage de l'imagerie médicale et vous invitons à ne pas hésiter à compléter vos connaissances par un ou plusieurs stages dans nos services pour mieux vous approprier ces examens. N'hésitez pas à nous contacter pour comprendre les possibilités des examens et traitements proposés, afin de choisir celui qui sera le plus adéquat dans le contexte clinique donnée, nous sommes des médecins et soignants à votre disposition.
Jean-Paul Beregi Pr , Damien Huglo Pr et Michel Montaudon Pr
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Les auteurs
Coordinateurs
- Éléonore Blondiaux, PU-PH, service d'imagerie, Hôpital Armand Trousseau, AP-HP ; Sorbonne Université, Paris
- Emmanuel Duran, PU-PH, chef de service, service de biophysique et médecine nucléaire, Hôpitaux Universitaires Paris Sud, Hôpital Bicêtre, AP-HP, Le Kremlin-Bicêtre ; coordonnateur national du DES de médecine nucléaire, Université Paris Saclay
- Michel Montaudo, PU-PH, laboratoire d'anatomie, Université de Bordeaux, Bordeaux
Auteurs
- Ronan Abgra, PU-PH, service de médecine nucléaire, Hôpital Augustin Morvan, CHRU de Brest, Brest
- Lionel Arriv, PU-PH, service d'imagerie médicale, Hôpital Saint-Antoine, AP-HP ; Sorbonne Université, Paris
- Fayçal Ben Bouallègue†, MCU-PH, médecine nucléaire, Hôpital Lapeyronie, CHU de Montpellier, Montpellier
- Jean-Paul Beregi,PU-PH, service de radiologie, CHU Caremeau, Nîmes
- Florent Besson, MCU-PH, service de biophysique et médecine nucléaire, Hôpitaux Universitaires Paris Sud, Le Kremlin-Bicêtre ; Université Paris Saclay
- Guillaume Bierry, PU-PH, service de radiologie 2, Hôpitaux Universitaires de Strasbourg, Strasbourg
- Cyrille Blondet, MCU-PH, service biophysique et médecine nucléaire, Hôpitaux Universitaires de Strasbourg, Strasbourg
- Alain Blum, PU-PH, service d'imagerie Guilloz, Hôpital Central, CHU de Nancy, Nancy
- Gérald Bonardel, professeur agrégé du Val-de-Grâce, service de médecine nucléaire, Centre, cardiologique du Nord, Saint-Denis
- François Brunotte, professeur émérite, biophysique et médecine nucléaire, Dijon
- Florent Cachin, PU-PH, service de médecine nucléaire, Centre Jean Perrin de lutte contre le cancer, Clermont-Ferrand
- Sophie Cahen-Riehm, PH, service d'imagerie 1, Hôpital de Hautepierre, CHU de Strasbourg, Strasbourg
- Pascal Chabrot, PU-PH, CHU de Clermont-Ferrand, Radiologie Montpied, Institut Pascal, UMR 6602 CNRS SIGMA UCA, Clermont-Ferrand
- Agathe Chammas, PH, service d'imagerie 2, CHU de Hautepierre, Strasbourg
- Jean-François Chateil, PU-PH, chef de service, service d'imagerie anténatale, de l'enfant et de la femme, Université de Bordeaux, CHU Pellegrin, Bordeaux
- Olivier Chevallier, CCA, département de radiologie diagnostique et thérapeutique, Hôpital François Mitterrand, CHU de Dijon, Dijon
- Alexandre Cochet, PU-PH, chef de service, service de médecine nucléaire, Université de Bourgogne, UFR des Sciences de santé, service de spectroscopie RMN et IRM cardiaque Centre Georges-François Leclerc et CHU de Dijon, Dijon,
- Emmanuel Deshayes, MCU-PH, service de médecine nucléaire, Institut du Cancer de Montpellier ; Faculté de médecine Montpellier-Nîmes, Université de Montpellier
- Jean-Yves Devaux, professeur honoraire de biophysique et de médecine nucléaire, Paris
- Philippe Devred, PU-PH, service d'imagerie pédiatrique et prénatale, Hôpital de la Timone Enfant, AP-HM ; Université Aix-Marseille, Marseille
- Gilbert Ferretti, PU-PH, clinique universitaire de radiologie et imagerie médicale, CHU de Grenoble Alpes, Grenoble
- Laure Fournier, PU-PH, service de neuroradiologie, Hôpital européen Georges Pompidou, AP-HP ; Université de Paris Cité, Paris
- Damien Galanaud, PU-PH, Hôpital de la Pitié-Salpêtrière, AP-HP ; Sorbonne Université, Paris
- Pedro Augusto Gondim Teixeira, PU-PH, service de radiologie Guilloz, Hôpital Central, CHU de Nancy, Nancy
- Gilles Grimon, MCU-PH, service de biophysique et médecine nucléaire, Hôpital Bicêtre, AP-HP, Le Kremlin-Bicêtre ; Université Paris Saclay, Faculté de médecine
- Vincent Hazebroucq, MD PhD, MCU-PH détaché en tant que médecin responsable de programmes d'inspection et d'audit à l'ARS Île-de-France
- Damien Huglo, PU-PH, chef de service, service de médecine nucléaire, CHRU de Lille, Lille
- Olivier Humbert, PU-PH, Faculté de médecine de Nice Sophia Antipolis, Nice
- Isabelle Keller-Petrot, PH, service de médecine nucléaire pédiatrique, Hôpital Armand Trousseau, AP-HP ; Sorbonne Université, Paris
- Dris Kharroubi, AHU, service de médecine nucléaire, Groupe hospitalier Pitié-Salpêtrière, AP-HP, Paris
- Stéphane Kremer, PU-PH, service d'imagerie 2, Hôpital de Hautepierre, CHU de Strasbourg, Strasbourg
- Claire de Labriolle-Vaylet, MCU-PH honoraire, service de médecine nucléaire, Hôpital Armand-Trousseau, AP-HP ; Sorbonne Université, Paris
- Alain Lalande, MCU-PH, service de spectroscopie, Hôpital François Mitterrand, CHU de Dijon ; LE2I Faculté de médecine, Université de Bourgogne Franche-Comté, Dijon
- Vincent Lebon, PU-PH, service de médecine nucléaire Frédéric Joliot, Orsay ; UFR de médecine, Université Paris-Saclay, UMR BioMaps, CEA-SHFJ, Orsay
- Florence Le Jeune, PU-PH, service de médecine nucléaire, Centre Eugène Marquis, CHU de Rennes
- Pierre-Yves Le Roux, PU-PH, service de biophysique et médecine nucléaire, CHRU de Brest, Brest
- Romaric Loffroy, PU-PH, département de radiologie diagnostique et thérapeutique, Hôpital François-Mitterrand, CHU de Dijon, Dijon
- Benjamin Longère, PH, service de radiologie et imagerie cardiovasculaire, Institut Cœur-Poumon, CHRU de Lille, Lille
- Olivier Lucidarme, PU-PH, chef de service, service de radiologie polyvalente et oncologique, Groupe hospitalier Pitié-Salpêtrière, AP-HP ; Sorbonne Université, Paris
- Charlotte Lussey-Lepoutre, PU-PH, responsable de l'unité fonctionnelle de radiothérapie interne vectorisée, service de médecine nucléaire, Hôpital Pitié-Salpêtrière, AP-HP, Paris ; Sorbonne Université
- Damien Mandry, PU-PH, service de radiologie, Hôpitaux de Brabois, CHRU de Nancy, Vandœuvre-lès-Nancy ; Université de Lorraine, Faculté de médecine, Nancy
- Denis Mariano-Goulart, PU-PH, chef de service médecine nucléaire, Hôpital Lapeyronie, CHU de Montpellier, Montpellier
- Fatima-Zohra Mokrane, PU-PH, service de radiologie, Hôpital Rangueil, CHU de Toulouse ; Unité INSERM I2MC-équipe 13-Toulouse
- Sébastien Molière, PH, service d'imagerie 1, Hôpital de Hautepierre, CHU de Strasbourg, Strasbourg
- Mickaël Ohana, PU-PH, service d'imagerie diagnostique cardiovasculaire et thoracique, Nouvel Hôpital Civil, Strasbourg
- Frédéric Patat, ingénieur, PU-PH, service échographie Doppler, CHRU de Tours ; CIC IT 1415 Ultrasons et Radiopharmaceutiques, Tours
- François Pontana, PU-PH, chef de service, service radiologie et imagerie cardiovasculaire, Institut Cœur-Poumon, CHRU de Lille, Lille
- Alban Redheuil, PU-PH, département d'imagerie cardiovasculaire et de radiologie interventionnelle et thoracique, Institut de cardiologie, Groupe hospitalier La Pitié Salpêtrière ; Sorbonne Université, Faculté de médecine ; ICAN (Institute of Cardiometabolism and Nutrition) ; LIB Biomedical Imaging Laboratory, Cardiovascular Research Team (INSERM/CNRS/UPMC), Paris
- Raphaële Renard-Penna, PU-PH, Hôpitaux Tenon-Pitié Salpêtrière, AP-HP ; Sorbonne Université, Paris
- Maxime Ronot, PU-PH, service de radiologie, Hôpitaux Universitaires Paris Nord-Val-de-Seine, Hôpital Beaujon, Clichy
- Edmond Rust, médecin nucléaire, médecine nucléaire, Clinique du Diaconat, Mulhouse
- David Taïeb, PU-PH, service de médecine nucléaire, Hôpital de la Timone, AP-HM, Marseille
- Isabelle Thomassin-Naggara, PU-PH, département de radiologie, Hôpital Tenon, AP-HP ; Sorbonne Université, Paris
- Thomas Tourdias, PU-PH, service de neuroimagerie diagnostique et thérapeutique, CHU de Bordeaux
- Paul Michael Walker, MCU-PH, imagerie médicale application clinique, département Vision, LE2I, UMR CNRS 6306, Faculté de médecine, Université de Bourgogne-Franche-Comté, Dijon
Contributeurs de la première édition
- Louis Boyer, PU-PH, pôle radiologie et imagerie médicale, Hôpital Gabriel Montpied, CHU de Clermont-Ferrand, Clermont-Ferrand
- Sophie Chagnon-Lhespitaou†, PU-PH, service de radiologie, Hôpital Ambroise Paré, UFR Paris-Île de, France Ouest
- Philippe Chaumet-Riffaud, PU-PH, service de biophysique et de médecine nucléaire, Hôpitaux Universitaires Paris Sud, Le Kremlin-Bicêtre ; Université Paris Saclay
- Anne Cotten, PU-PH, service de radiologie et imagerie musculosquelettique, CCIAL, CHRU de Lille, Lille
- Olivier Couturier, PU-PH, chef de Service, service de médecine nucléaire et biophysique CHU d'Angers, Angers
- Valérie Croisé-Laurent, PU-PH, Radiologie Brabois adultes, Hôpitaux de Brabois, CHRU de Nancy, Vandœuvre-lès-Nancy
- Jean-Nicolas Dacher, PU-PH, chef de service, service d'imagerie médicale, CHU Charles Nicolle, Rouen
- Jacques Darcourt, PU-PH, Biophysique et médecine nucléaire, Faculté de médecine, Université Côte d'Azur, Nice
- Hubert Ducou le Pointe, PU-PH, chef de service, service de radiologie pédiatrique, Hôpital Armand-Trousseau, AP-HP ; Université Pierre et Marie Curie, Paris
- Olivier Ernst, PU-PH, chef de service, service d'imagerie digestive et endocrinienne, Hôpital Huriez, CHRU de Lille, Lille
- Astrid Girma, médecin nucléaire, médecine nucléaire, Hôpital Foch, Suresnes
- Boris Guiu, PU-PH, chef de service, département de radiologie diagnostique et interventionnelle, Hôpital Saint-Éloi, CHU de Montpellier, Montpellier
- Olivier Hauger, PU-PH, responsable unité d'imagerie ostéo-articulaire, service d'imagerie diagnostique et thérapeutique de l'adulte, Hôpital Pellegrin, CHU de Bordeaux, Bordeaux
- Olivier Hélénon, PU-PH, chef de service, service radiologie adultes, Hôpital Necker-Enfants malades, AP-HP, Paris
- Elif Hindie, PU-PH, service de médecine nucléaire Sud et Pellegrin, CHU de Bordeaux, Pessac
- Emmanuel Itti, PU-PH, chef de service, service de médecine nucléaire, CHU Henri Mondor, AP-HP ; Université Paris-Est Créteil, Créteil
- Bruno Kastler, PU-PH, service de radiologie adultes, Hôpital Necker-Enfants malades, AP-HP, Paris
- Alain Luciani, PU-PH, service d'imagerie médicale, Faculté de médecine de Créteil, Université Paris Est Créteil, INSERM U955 Équipe 18, CHU Henri Mondor, Créteil
- Xavier Marchandise, professeur honoraire de biophysique et médecine nucléaire, service de médecine nucléaire Imanord, Villeneuve d'Ascq
- Pierre-Yves Marie, PU-PH, service de médecine nucléaire, Hôpitaux de Brabois, CHRU de Nancy, Vandœuvre-lès-Nancy
- Guillaume Marzolf, CCA, service d'imagerie 2, Hôpital de Hautepierre, CHU de Strasbourg, Strasbourg
- Nicolas Menjot de Champfleu, PU-PH, service de neuroradiologie, Hôpital Gui de Chauliac, CHU de Montpellier, Montpellier
- Guy Mouli, PU-PH, service de radiologie adultes, Hôpital de la Timone, AP-HM, Marseille
- Olivier Mundle, PU-PH honoraire, service de médecine nucléaire, Hôpital de la Timone, AP-HM, Marseille
- Pierre Olivie, PU-PH, service de médecine nucléaire, Hôpitaux de Brabois, CHU de Nancy, Vandœuvre-lès-Nancy
- Catherine Oppenhei, PU-PH, service d'imagerie morphologique et fonctionnelle, Hôpital Sainte-Anne, Paris
- Philippe Ota, PU-PH, service de radiologie, Hôpital Rangueil, CHU de Toulouse, Toulouse
- Philippe Peti, PU-PH, chef de service, service d'imagerie pédiatrique et prénatale, Hôpital de la Timone Enfant, AP-HM, Marseille
- Pierre Potteche, CCA, département de radiologie diagnostique et thérapeutique, Hôpital François Mitterrand, CHU de Dijon, Dijon
- Alain Prigen, PU-PH honoraire, Université Paris Sud, Université Paris Saclay, Hôpitaux Universitaires Paris Sud
- Caroline Rousseau, MCU-PH, médecine nucléaire, ICO Gauducheau, Saint-Herblain
- Fabien Schneider, MCU-PH, radiologie centrale, Hôpital Nord, CHU de Saint-Étienne, Saint-Étienne
- Patrice Taoure, PU-PH, département d'imagerie médicale, Hôpital Lapeyronie, Université Montpellier 1, Montpellier
- Jean-Pierre Tasu, PU-PH, chef de service, service de radiologie, CHU de Poitiers, Poitiers
- Pierre Vera, PU-PH, directeur général, département radiologie et médecine nucléaire, QuantIF-Litis (EA4108 – FR CNRS 3638) CLCC Henri Becquerel, Rouen
- Paul Michael Walke, MCU-PH, imagerie médicale application clinique, département Vision, LE2I, UMR CNRS 6306, Faculté de médecine, Université de Bourgogne-Franche-Comté, Dijon
 |
Chapitre suivant |
 |
Retour au sommaire |
ANAIMEN - accueil
L'association des assistants et internes en médecine nucléaire représente et informe les jeunes médecins nucléaires
Cas cliniques
Actualités
Rien trouvé.
Agenda
Rien trouvé.
Rechercher un service de médecine nucléaire
